降脂红曲发酵工艺的研究进展
2019-01-10程玉冰胡海峰闵涛玲
程玉冰,胡海峰,*,闵涛玲
(1.中国医药工业研究总院上海医药工业研究院,上海201203;2.国药集团健康产业研究院有限公司,上海 201203)
近年来,高胆固醇血症发生率正以惊人的速度增长,由于其可引发多种心血管疾病并发症,因此严重威胁到公众健康。使用降脂药物治疗高胆固醇血症存在较多副作用,因此通过服用食品或功能性产品来达到降脂疗效[1],引起了广大的关注。红曲菌在次级代谢的过程中,可产生具有降脂活性的莫纳可林K(Monacolin K,以下简称MK)。服用含有MK的红曲制品既可降脂,又能避免药物引发的副作用,在降脂市场上占有重要地位。
1 降脂红曲的发展历史
红曲是指将红曲菌接种于适宜发酵基质后经培养所得的发酵物,属于我国传统的药食同源发酵产品,是我国宝贵的科学文化遗产。在我国古代,红曲又称为丹曲,《本草纲目》中曾记载:“红曲以白饭蒸罨成红色,与营血有同气相求之理,能生血而健脾,气温达肝,味甘益脾之力也”。古代对红曲的食疗作用定义为:“消食、活血、健脾、燥胃”。近年来,随着国内外研究者对红曲的深入研究,其显著的降脂活性被发现。在20世纪70年代,日本的微生物学家Akira Endo和Merck&Co.制药公司的研究人员从紫红曲霉中分离出了monacolins类物质,此后红曲作为一种非处方膳食补充剂,成为洛伐他汀类药物的替代品,活跃在降脂市场中[2]。在20世纪90年代,临床试验表明红曲含有他汀类药物洛伐他汀的天然形式,能够像他汀类药物一样有效地降低胆固醇[3]。因此加强对红曲的深入研究,加强对红曲制品监管力度,使红曲制品标准化,确保红曲食用安全性迫在眉睫。
2 红曲菌发酵的主要成分
红曲菌在次级代谢的过程中,可产生MK,MK(图1)即洛伐他汀,其化学结构中含有β-羟基内酯基团[4],其内酯环经开环反应后,β-羟基内酯基团可转化为β-羟基酸,成为MK的酸式结构(图2),MK的酸式结构与胆固醇合成过程中3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)还原酶的结构最为相似,因而能够阻断胆固醇合成通路,降低胆固醇合成。Monacolin K的内酯形式与它的羟基酸产物在不同pH值条件下可以相互转化,经人体产生的羟基酶水解后,发挥降脂活性。目前,MK的生产主要依靠生物发酵法,生物发酵能够避免化学法生产所具有的反应条件苛刻、副反应多、产品分离纯化困难等一些缺点,具有一定优势[5]。工业生产中主要涉及的他汀产生菌包括土曲霉、红曲霉、青霉菌及链霉菌[6]。与其他发酵菌株相比,红曲发酵物中活性物质更加丰富,且其固体发酵物可不经提取分离,直接作为保健食品所食用,因而有更大优势。
另外,红曲菌具有丰富的聚酮合成体系,能够产生多种丰富的代谢产物:除具有显著降脂活性的MK外,其还可产生具有降压及抗抑郁活性的γ-氨基丁酸,研究表明[7],在小鼠抗抑郁实验的长期测试中,提供相同剂量的γ-氨基丁酸及红曲发酵物,后者具有比γ-氨基丁酸更好的抗抑郁效果,有更大的研究潜力。近年来,随着人们对色素需求量的日益增加,利用微生物来生产色素凸显出巨大的优势:微生物易培养,色素产量高、易获得、可避免化学合成色素所带来的危害[8],具有广阔的发展前景。红曲色素作为一种优质的天然可食用色素,具有多种优势:红曲色素稳定性好、具有抗炎[9]及抗菌[10]活性,可成为有致癌隐患—亚硝酸盐的替代品,在着色的同时还可发挥抑菌作用。另外,在红曲丰富的菌丝体中还含有具有抗氧化活性的辅酶Q10[11];红曲还可产生各种丰富酶类,如淀粉酶、酯化酶、糖化酶等。但是,红曲菌发酵也会产生一种具有致癌活性的真菌毒素—桔霉素,因此,在提高目标产物的同时,控制桔霉素的产生也尤为重要。对红曲进行不同程度的菌种筛选及不同性质的工艺优化,改变其次级代谢方向,可使促其提高相应代谢产物的产量。正是这些丰富的代谢产物,使红曲拥有极高的研究价值,在微生物开发与利用发展史上占有重要地位。
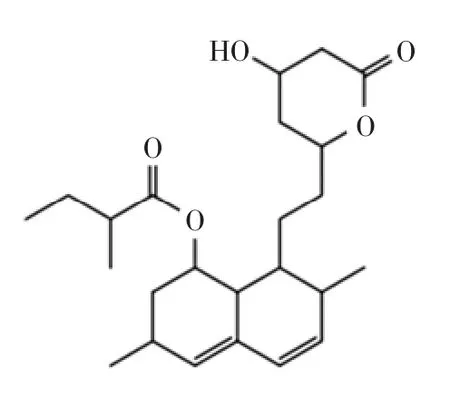
图1 莫纳可林K结构式[3]Fig.1 Chemical structures of Monacolin K[3]
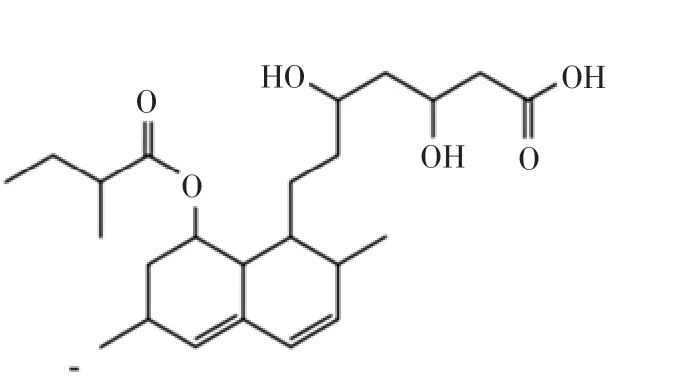
图2 酸式莫纳可林K结构式[3]Fig.2 Chemical structures of Monacolin K hydroxy acid[3]
3 MK的生物合成
MK是由红曲霉聚酮化合物合成酶(polyketides,PKS)合成的次级代谢产物。其有2条生物合成途径[12]见图3:一条在合成过程过程中形成中间体,进一步转化为莫纳可林 L(Monacolin L)、莫纳可林 J(Monacolin J),最后形成MK;另一条在合成过程中形成二甲基丁酰辅酶A,进一步合成MK。
为提高红曲MK产量,一些与红曲霉MK生物合成基因簇有关的基因成为了研究热点。通过对MK生物合成相关基因进行鉴定,研究者[13]发现了9个和洛伐他汀生物合成基因同源性较高的基因簇(图4),推测它们编码MK蛋白质的合成基因:mokA和mokB用于合成肽链骨架;P450单氧酶基因(mokC),氧化还原酶基因(mokD),脱氢酶基因(mokE),转酯酶基因(mokF),HMG-CoA 还原酶基因(mokG),转录因子基因(mokH)及外排泵基因(mokI)。
将mokA基因破坏后[14],菌株不再产生MK,表明mokA编码与MK生物合成相关的PKS基因;将mokB基因破坏后[15],菌株不再产生MK,且Monacolin J含量升高,表明mokB编码侧链多肽部分的PKS生物合成基因;mokH基因编码Zn(II)2Cys6双核DNA结合蛋白,研究表明[16],mokH可以上调MK生物合成基因的转录,促进MK的产生。
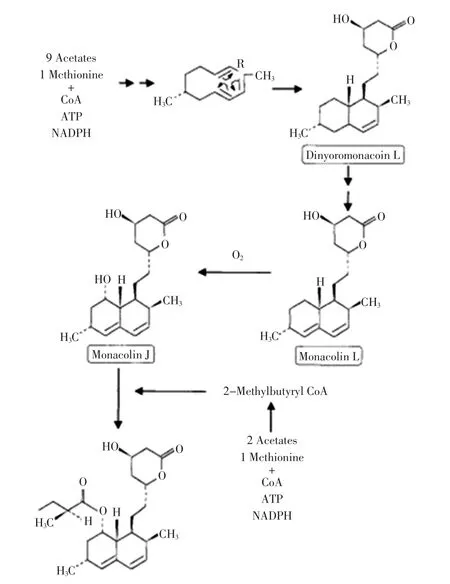
图3 Monacolin K的生物合成途径[12]Fig.3 Monacolin K biosynthetic pathway[12]
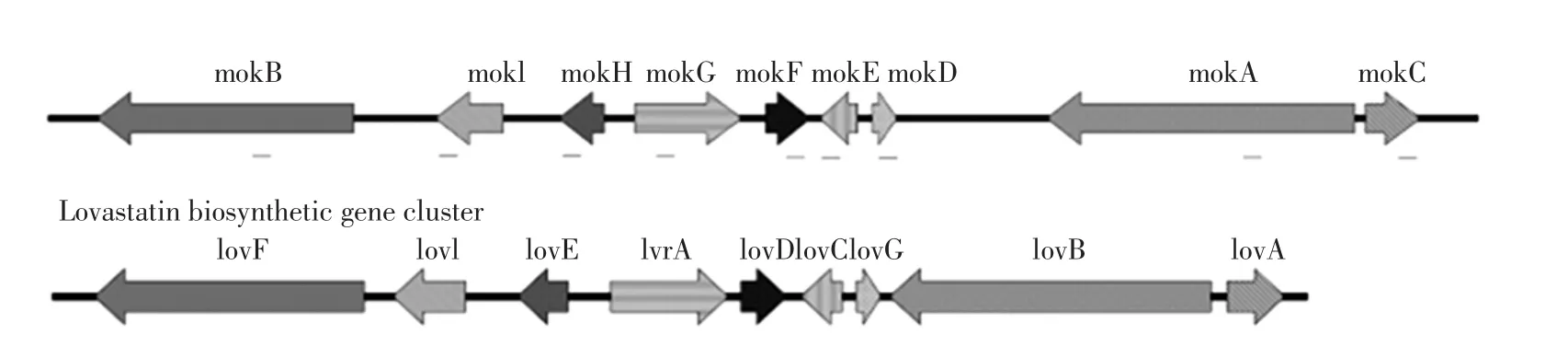
图4 Monacolin K的生物合成基因簇[13]Fig.4 Monacolin K biosynthetic gene cluster[13]
4 降脂红曲的发酵工艺质控点
红曲发酵是多因素共同作用的综合性发酵,其发酵合成MK受多种因素影响,如菌种、接种量、发酵培养基及其营养组成、发酵温度、发酵pH值等。固体发酵则更为复杂,除上述几种因素外,固态发酵基质、发酵基质初始含水量及翻曲均对红曲固体发酵合成MK有较大影响。
4.1 菌种筛选
目前,可采用紫红曲菌、橙色红曲菌、丛毛红曲菌、血红红曲菌[17]或两种红曲菌混合发酵[18]来促进MK的合成。但是,并非所有的红曲菌都具有MK合成能力,因此筛选一株具有MK产生能力的红曲菌株是发酵试验的关键。在自然分离筛得具有MK产生能力红曲菌株的基础上结合菌株改造是得到高产菌株的有效方法:如李桂航等[19]使用双灭活原生质体融合方法成功选育出红曲霉洛伐他汀高产菌株;此外,利用紫外、射线或化学诱变剂,均有可能获得高产红曲突变株。某些经过诱变的菌株在获得高产MK能力的同时,也可能丧失桔霉素产生能力[20],一举两得,可大大提高发酵物安全性。但由于霉菌菌丝体存在异核现象,诱变并非全部核发生变异,再次培养时,正突变结果难以保持,为试验重复性带来一定困难[21]。近年来,随着对洛伐他汀生物合成途径及其分子生物学认识的逐步深入,使用基因工程手段改造菌株,提高红曲洛伐他汀的产量成为可能[22]。
4.2 接种量的选择
接种量是指接入发酵培养基的种子培养物的体积:接种量过高,菌株生长迅速,营养利用较快,发酵可利用营养不足,导致发酵周期缩短,产量受限;接种量过低,菌株生长缓慢,发酵周期延长。另外,最适接种量会随培养基营养成分变化而变化[23]且对固体发酵而言,接种会引入发酵基质水分。因此,选择合适的接种量对红曲发酵产MK有较大影响,研究表明,接种量5%时能明显促进MK合成[24]。
4.3 发酵温度的选择
红曲菌能够在较大温度范围内(25℃~40℃)生长,但利于其发酵合成MK的温度却相对较为苛刻。研究表明[25],在30℃培养6天后,25℃培养15 d的变温培养条件下,其菌丝量低于30℃恒温培养组,但其MK产量比恒温条件高16倍。这是由于25℃的培养条件更利于MK合成基因簇的表达及与次级代谢有关蛋白的表达,抑制了菌丝生长蛋白的表达。Tao Huang等[26]则发现,高温条件更利于某些色素合成基因簇的表达,促进部分色素合成。
4.4 发酵pH值的选择
红曲菌嗜酸,其生长最适pH值范围为3.5~5。较低的pH值能够抑制杂菌生长,维持红曲菌优势生长环境,但同时可能造成红曲细胞数量过多增殖而导致桔霉素产量升高,如CHUN-LIN LEE等[27]研究发现,当pH值降至2.5时,红曲细胞量增加,其MK及桔霉素产量均升高;当pH值升至5.7时,其MK产量较对照组提高了47%,桔霉素产量降低了54%。BiyuKang等[28]则发现氮源直接影响发酵终点的pH值变化,而pH值变化又进一步影响红曲菌某些次级代谢产物的合成,因此通过调节培养基中的氮源添加比例来控制发酵pH值变化,可调控菌株的次级代谢进程。Bibhu Prasad Panda等[29]在进行发酵工艺参数优化时发现,发酵培养基的pH值对多种工艺参数均有促进作用。因此,加强对发酵pH值动态变化监测,探究其变化对红曲基因表达的影响,是调控红曲菌次级代谢的重要研究方向。
4.5 固体发酵初始含水量的选择
水是红曲菌菌丝生长、孢子形成及次级代谢产物合成必不可少的物质,选择适宜的初始含水量既有利于菌株生长代谢,又能避免由于发酵后期补水造成的染菌风险。含水量的选择对发酵状态影响较大:初始含水量过高,菌丝旺盛生长,基质结块难以疏散,不利于氧气传递、废气排出,阻碍菌株生长及MK合成;初始含水量过低,物料干硬,不利于菌株生长及酶系传递。Fusheng Chen等[30]研究发现,当初始含水量控制在55%~75%时,菌株发酵的MK产量相对较高。另外国药集团健康产业研究院有限公司实验室在红曲发酵过程中发现,菌株在生长代谢消耗基质中的营养,基质保水能力下降,在发酵中后期会产生游离水。发酵游离水的产生会使底部基质长期泡在液体中,溶氧极差且湿度过高粘于瓶壁不易翻曲,不利于菌株生长及发酵。因此,如何选择最优初始含水量,控制游离水产生,也是提高红曲固体发酵MK产量的关键因素。
4.6 发酵培养基的选择
现阶段的红曲发酵主要以固体发酵及液体发酵为主,两种发酵方式各有其特色。红曲固体发酵,主要指将红曲菌接种于不含或仅含有少量水的固态基质如大米、小米等,进行的一种发酵。研究表明[20],红曲固体发酵过程中,细胞生长、甘油消耗及MK的产生均比液体发酵快;固体发酵基质细胞膜流动性和渗透性比液体发酵好;且固体发酵基质构成了一个碳源浓度梯度微环境[31],可减少代谢阻遏,利于菌株生长及产物合成。但是固体发酵工艺复杂,为红曲工业化生产带来一定困难。红曲液体发酵周期短、污染率小、易控制,但MK产量普遍低且后处理成本高。
4.6.1 固体发酵底物及附加营养的选择
红曲固体发酵最常使用的发酵底物为大米,其较高的淀粉含量及较好的保湿性很适合红曲菌生长及代谢产物合成。另外,除使用单一大米作为发酵底物外,也可使用其他物质代替大米或复配大米作为发酵底物,提高MK的产量:Burcu Atll等[32]认为,使用粒度为1 mm~2 mm的大麦作为固体发酵基质,既能满足菌株生长代谢的营养需求,又能提高溶氧,经工艺优化后,MK 产量可达 139.47 mg/g;Patcharee Pattanagul等[33]选用具有多种药用价值的薏仁作为发酵基质,在筛得高产MK菌株的同时,该菌株发酵物中的桔霉素含量明显下降;N.Jaivel等[34]使用疏松且富含丰富矿物质及微量元素的麦麸作为发酵基质,能够获得比高粱基质、玉米基质、米糠基质更高产量的MK;Rashmi Dikshit等[16]也发现,使用麦麸作为发酵基质能够获得比多种水果种子基质及米糠基质更高产量的MK。除上述几种基质外,还可使用其他工业或农业废料[35]作为发酵基质,既能降低成本、提高利用价值,又可以保护环境,是红曲固体发酵的一个新研究方向。
营养成分影响菌丝生长、孢子萌发、细胞增殖及菌落形态变化。在选择合适发酵基质的基础上,附加一定量营养物质,是提高发酵MK产量的重要策略。Jirasatid等[36]使用响应面优化试验筛得一较优发酵工艺:在使用大米作为基础发酵基质的基础上,附加2%甘油、0.14%甲硫氨酸和0.01%硝酸钠,发酵MK产量可得5 900 mg/kg,且在此工艺下其黄色素产量也有较大提升,桔霉素产量下降;Fusheng Chen等[30]在使用大米混合少量麦麸发酵基质基础上,附加一定量营养肉汤培养基(葡萄糖、谷氨酸钠、蛋白胨、硝酸铵、磷酸二氢钾),对MK的合成有明显促进作用;Bo-BoZhang等[37]使用小粒径且低黏度的小米作为发酵基质,并在此基础上附加20%甘油及3.5%豆粕,其发酵MK产量最高可达19.81 mg/g。
4.6.2 液体发酵培养基的选择
红曲液体发酵是一个不断变化的发酵过程,随着菌株对营养物质的利用,发酵液中会发生一系列pH值[38]及氧化还原电位[39]的变化,这些变化会调控某些与红曲次级代谢有关的基因簇,影响代谢产物的合成。与固体发酵相比,对液体发酵进行营养组分优化更简便可行,选择合适的营养因子并加以优化,是提高红曲液体发酵MK产量的有效方法。
甘油是红曲发酵中常用的营养物质,其既可以作为碳源供菌株生长利用,又可以作为发酵前体因子,刺激菌株MK合成。添加适量甘油能够促进MK合成,但高浓度甘油会抑制某些MK合成相关基因的表达,不利于MK生产[40]。Subhagar Seraman等[41]通过响应面优化试验发现,葡萄糖、蛋白胨、硫酸锰、氯化钠、氯化铵均对MK合成有较大影响,经工艺优化后,发酵14 d时MK产量可达97.5 mg/L;Yaw-Nan Chang等[42]对米粉、葡萄糖、甘油、蛋白胨进行响应面优化试验,筛得一较优工艺,验证后其MK产量可达131.0 mg/L;Sadik Ali Sayyad等[43]对葡萄糖、氯化铵、磷酸二氢钾、硫酸镁、硫酸锰5个参数进行优化,优化后MK产量可达351mg/L;Chan Zhang等[44]研究发现谷氨酸可以上调部分MK合成基因表达,促进细胞中MK分泌,经工艺优化后,MK产量提高了3.5倍;Jun Zhang等[45]通过添加MK合成前体柠檬酸钠后,产量提高了52.6%;添加能够增强细胞膜通透性的表面活性剂Triton X-100后,产量较对照组提高了86.9%。
5 展望
随着对降脂红曲的深入探索,其未来的可研究热点包括:1)加强对菌株基因工程改造的研究,提高菌株MK产生能力;2)在提高红曲菌发酵MK产量的同时,提高其他活性代谢产物的产量并加强代谢产物安全性研究:如Jing Huang等[46]研究发现,亚油酸作为一种信号分子能够促进MK合成基因的表达,提高MK产量,与此同时,低浓度的亚油酸也有利于红曲色素的产生;Jyh-Jye Wang等[47]对发酵温度、水分及乙醇添加量进行工艺优化后,发酵的MK、γ-氨基丁酸产量均提升且桔霉素产量下降;Yuan-Chi Su等[48]在筛得高产MK菌株的基础上进行发酵组分营养优化,在优化后的工艺下,MK及γ-氨基丁酸产量均提高。因此,在进行红曲工艺优化的同时,提高其两种或多种次级代谢产物产量,控制桔霉素产生,能够大大提高试验效率及红曲产品安全性,是红曲发酵新的研究方向;3)在降脂红曲的基础上,研究红曲新的活性方向:如红曲除熟知的降压降脂等生物活性外,其还可作为一种自由基清除剂[49],发挥抗氧化活性;最新研究表明红曲还具有抗癌活性[50]:其可以阻滞肿瘤细胞的正常生长、抑制肿瘤细胞形成、促进肿瘤细胞凋亡从而发挥抗癌作用。但是关于其抗癌机制还待进一步深入研究。
