Artificial miRNA调控甘蓝型油菜芥酸的研究
2019-01-09王志伟张自阳林丽婷张金文刘明久
王志伟 张自阳 林丽婷 张金文 刘明久 乔 岩
(1河南科技学院/现代生物育种河南省协同创新中心,河南新乡 453003;2甘肃农业大学农学院,甘肃兰州 730070;3河南师大附中双语国际学校,河南新乡 453003)
芥酸(erucic acid,C22 ∶1Δ13)属超长链脂肪酸,是以光合产物蔗糖为主要碳源,通过碳链的延长和去饱和作用形成的[1]。芥酸是制备聚乙烯膜、山嵛醇、山嵛酸、尼龙、感光材料、乳化剂、香精、润滑油等的原材料,在机械、化工、冶金、油漆、纺织、橡胶、医药等行业被广泛应用,是一种重要的工业原料[2-3]。目前,工业芥酸主要来源于高芥酸甘蓝型油菜,因此提高油菜中芥酸的含量具有重要意义。同时,油菜也是植物油的重要来源,其菜籽油食用量占国内食用植物油的57.2%[4],且菜籽油中的芥酸含量对于人类的健康具有重要影响。研究表明,菜籽油中的芥酸可能影响菜籽油在人体内的消化,引起心肌损伤,使肾上腺组织的胆固醇水平上升,且容易使脂肪在心脏组织中积累,如果长期食用芥酸含量高的菜籽油,会增加食用者患心血管类疾病的几率,因此我国对用于食用油的菜籽中芥酸含量的要求是低于1%,而工业上对芥酸含量的要求是60%,甚至更高[5-6]。通过杂交选育等传统育种方法,我国先后育出了多个芥酸含量低于1%的食用油菜品种,而育出的高芥酸品种含油量仅40%左右,芥酸含量约为50%,但传统育种方法局限性较大,芥酸含油量很难再提高[7-8]。因此,利用生物技术的手段提高芥酸含量已成为油菜高芥酸育种的重要方向[9-10]。
油酸(oleic acid,C18∶1)作为超长链脂肪酸和多不饱和脂肪酸合成的底物,其代谢途径有2条,一是在原来碳链的基础上在脂肪酸延长酶1(fatty acid elongation 1,FAE1)作用下继续延长,继而合成C20∶1、C22∶1等超长链脂肪酸;二是在脂肪酸去饱和酶(fatty acid desaturase2,FAD2)作用下继续去饱和,从而合成C18∶2、C18∶3等多不饱和脂肪酸。因此提高芥酸的含量一方面可通过提高fae1基因的表达量,以合成更多的芥酸,另一方面可沉默fad2基因的表达,减少油酸的去饱和作用,为芥酸的合成提供更多的底物[11]。
人工miRNA(artificial miRNA,amiRNA)是以生物体内的miRNA为模板,设计一段miRNA及miRNA∗序列替换原来前体序列中的miRNA∶miRNA∗,从而使新生成的前体序列经过剪切作用能够有目的地对特定靶基因进行沉默。相比传统沉默基因方式,amiRNA具有高特异性、高效性、高遗传稳定性、高生物安全性等特点,已被广泛运用于植物的代谢功能、基因功能等相关研究[12-13]。
芥酸的调节研究多是利用传统的反义抑制、RNAi等手段沉默基因的表达[14],而amiRNA在甘蓝型油菜芥酸调控中的研究尚未见报道。本研究利用amiRNA技术,针对甘蓝型油菜fad2的基因序列设计特异的amiRNA,并利用特异性启动子Napin,研究amiRNA对油菜芥酸合成相关基因和芥酸含量的调控,以期为amiRNA在甘蓝型油菜中的应用和培育理想芥酸含量的油菜品种奠定一定的理论基础。
1 材料与方法
1.1 试验材料
遗传转化油菜品种是由甘肃农业大学农学院油菜育种实验室提供的高芥酸甘蓝型油菜品种MY15(油酸14.38%、亚油酸11.69%、芥酸47.26%)和低芥酸甘蓝型油菜品种 LEA01(油酸 67.36%、亚油酸18.04%、芥酸0.72%)。本试验所用菌株均由甘肃农业大学植物基因组学实验室保存,大肠杆菌(E.coli)DH5α、根癌农杆菌(Agrobacterium tumefaciens)菌株LBA4404、pCEPSPS[由pCAMBIA1300载体改造而来,载体内的潮霉素(Hyg)抗性被草甘膦(EPSPs)抗性替代]、pCENN(在pCEPSPS的多克隆位点利用EcoRⅠ和KpnⅠ酶切和T4连接酶添加Napin启动子,然后用SalⅠ和HindⅢ酶切连接Nos终止子得到),pRS300 amiRNA克隆载体。
DNA聚合酶(AP111-01)、克隆载体(CT101-01)、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(GF201-01)、氨苄青霉素(GG101-01)、异丙基-β-D-硫代半乳糖苷(GF101-01)、卡那霉素(Kanamycin,Kna,GG201-01)、T4 连接酶(FL101-01)、XbaⅠ(JX101-01)、EcoRI(JE201-01)、KpnⅠ(JE201-01)、HindⅢ(JH101-01)、普通琼脂糖凝胶 DNA回收试剂盒(TIANGEN,DP209),均购自北京自全式金公司。
1.2 试验方法
1.2.1 人工miRNA片段的克隆 将Bnfad2(AY577313)的序列提交至amiRNA设计网站WMD3,利用pRS300为模板设计针对BnFAD2的专用amiRNA引物(表1),利用设计出的引物进行重叠PCR克隆amiRNAD2,各轮反应的引物、模板以及产生的片段大小详见表2,最终获得的f片段即为目标片段。
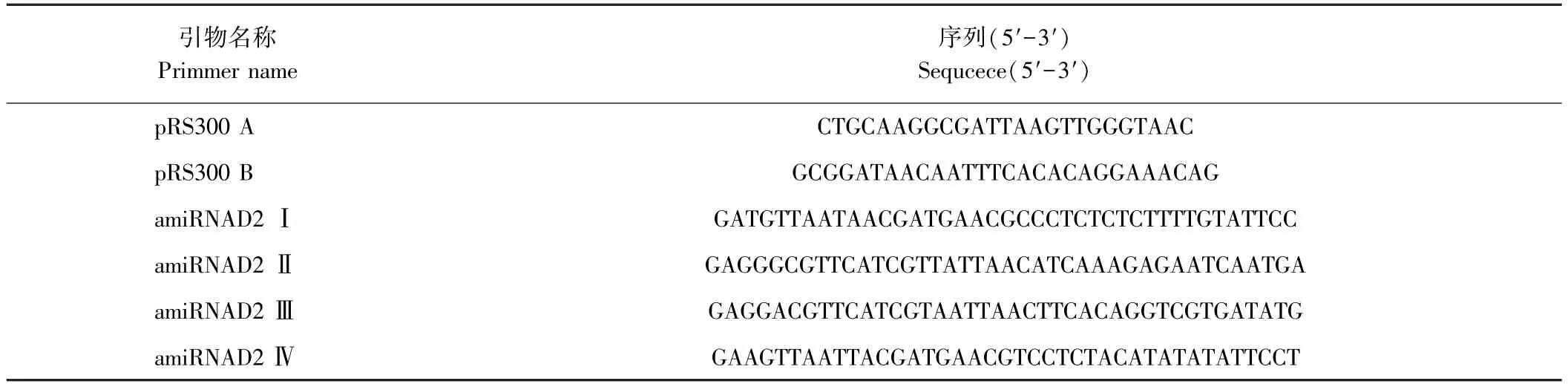
表1 FAD2的amiRNA引物Table1 The amiRNA primmers of FAD2
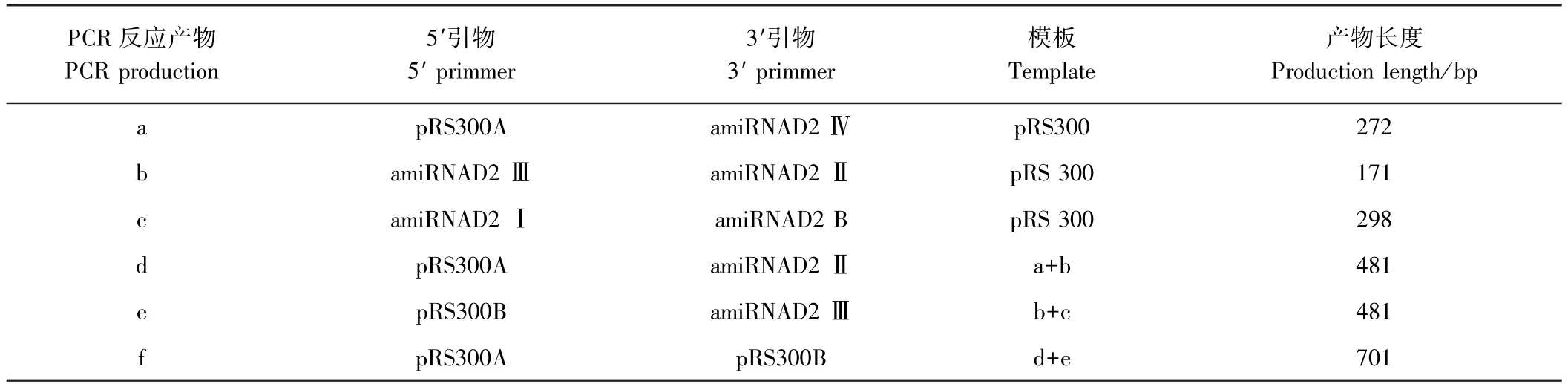
表2 重叠PCR各轮反应产物及其引物与模板Table2 The production of overlapping PCR and the primmer and template
1.2.2 表达载体pCENND的构建 将重叠PCR获得的目标片段经琼脂糖凝胶电泳回收后,连接到PMD-19T载体,利用片段内含的KpnⅠ和XbaⅠ的酶切位点进行酶切验证并回收,然后将回收目标片段利用T4连接酶连接到pCENN载体,组成表达载体pCENND2,表达载体经EcoRⅠ/KpnⅠ和XbaⅠ/HindⅢ酶切验证无误后,转入农杆菌进行转化。油菜的转化参照Kopertekh等[15]和邹智[16]的方法,并略作改进。
1.2.3 转化阳性株鉴定及种子脂肪酸含量分析 切取无菌培养的油菜幼苗上胚轴和下胚轴作为浸染的外植体,预培养2 d后进行农杆菌的浸染,经过愈伤诱导、发芽、植株发育和生根,从而发育成完整植物。在此过程中,在培养基中添加草甘膦,对愈伤组织的幼芽、幼芽发育植株及植株生根过程进行阳性植株的初步筛选。转化株经过草甘膦筛选后,取幼苗叶片提取转化苗叶片DNA作为模板,利用抗除草剂基因EPSPs设计特异性引物(表3),并进行定量PCR,然后进行阳性株的鉴定。

表3 转化阳性植株检测PCR引物Table3 The detect PCR primer for transgenic positive strain
将经过鉴定的阳性株移栽至花盆,开花后45 d,待种子接近成熟时取新鲜的油菜种子,提取种子总RNA,同时利用近红外光谱法[17]测定种子油酸、亚油酸、芥酸的含量。BnFAD2基因的定量分析,以BnEF1基因作为内参基因,以未转化的品种中fad2基因的表达为参照,进行相对定量分析。定量分析所用的引物详见表4。
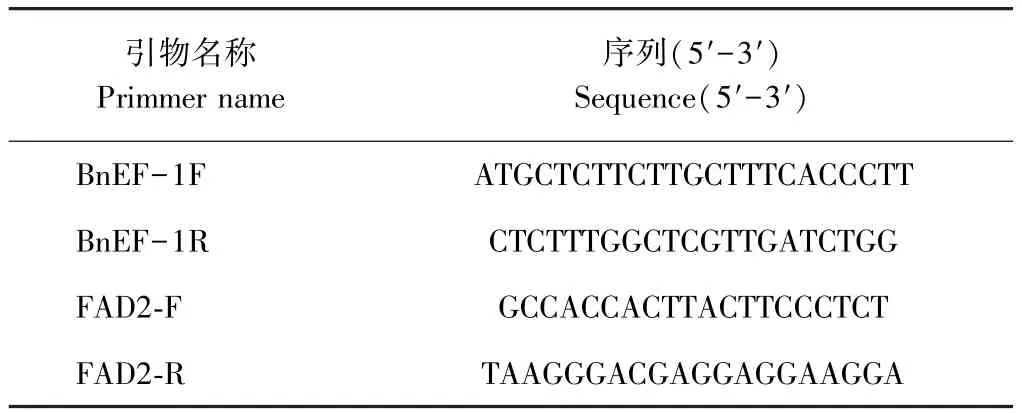
表4 甘蓝型油菜转化植株定量引物Table4 The quantification primmer for transgenic Brassica napus
1.3 数据分析
利用SPSS17.0软件对未转化植株和转化植株相关数据进行多重比较分析,检测差异显著性。
2 结果与分析
2.1 amiRNA片段的克隆
利用WMD3设计BnFAD2基因amiRNA的特异性引物,以pRS300为模板,经过3轮的重叠PCR,每轮利用琼脂糖凝胶电泳回收,最后可以克隆出amiRNAD2片段,即PCR中的片段f。由图1可知,片段a略大于250 bp,片段b介于150~200 bp之间,片段c接近300 bp,片段d和e为相同大小的片段,接近于500 bp,而片段f接近750 bp。以上结果与每个片段的理论长度基本相符,即片段a理论长度为272 bp,片段b理论长度为171 bp,片段c理论长度为298 bp,片段d理论长度为481 bp,片段e理论长度为481 bp,片段f理论长度为701 bp,说明克隆的片段是有效的。
2.2 表达载体的酶切验证
经KpnⅠ和XbaⅠ双酶切之后,2泳道产生1条略小于500 bp的片段,4泳道为EcoRⅠ和HindⅢ酶切后的电泳图,酶切后产生2条片段,1条约1 100 bp,另1条约750 bp,较大的条带为酶切后的Napin启动子,较小的片段为amiRNAD2+NOS片段(图2-A)。因为在amiRNAD2的 5′端和NOS的 3′端各存在一个HindⅢ的酶切位点(图2-B),所以在酶切时amiRNAE1+NOS片段作为一个整体片段被切下,因此其实际大小应该为2个片段之和,即732 bp。
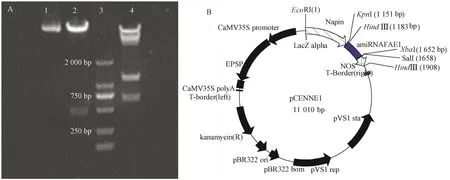
图2 pCENND双酶切验证Fig.2 The verify of pCENND by double digest
2.3 阳性植株的鉴定
以经过草甘膦筛选的阳性植株叶片DNA为模板,以EPSPs基因的特异性引物进行PCR扩增,由图3可知,阳性植株可扩增1条大小约200 bp的条带,而未经转化的植株则没有任何条带,说明表达载体成功转入阳性植株。
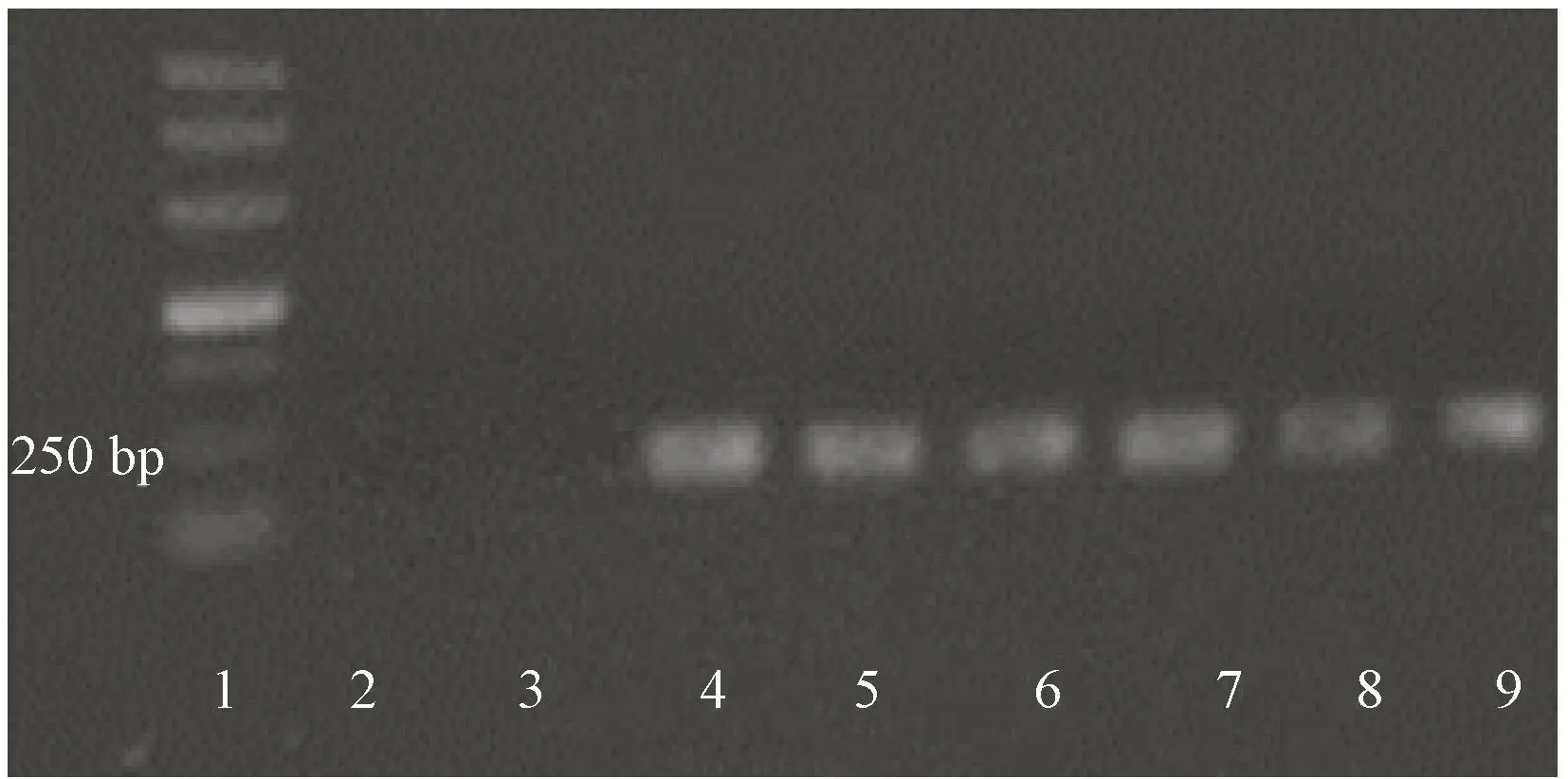
图3 转化油菜阳性株检测Fig.3 The detection of positive tranformed rapeseed
2.4 转化植株fad2基因表达和脂肪酸组成分析
pCENND2经过农杆菌浸染,分别转入了2个受体材料MY15和LEA01中,并获得了阳性株,共移栽8株转化株,成活6株,MY15和LEA01分别各成活3株,提取转化株的T0种子和未转化种子的总RNA,反转录后对FAD2基因的表达进行相对定量。结果表明,低芥酸品种LEA01转化株FAD2基因的表达量极显著低于未转化的植株,且转化株T0-2的fad2基因的表达量显著低于转化株T0-1和T0-3;高芥酸品种MY15的转化株种子fad2表达量相对于未转化的植株显著降低,且转化株T0-2的fad2基因的表达量显著低于转化株T0-1和T0-3(图4)。

图4 甘蓝型油菜转化植株种子fad2基因表达Fig.4 The fad2 gene expression in transgenic Brassica napus seeds
由表5可知,高芥酸品种 MY15和低芥酸品种LEA01转化株种子油酸含量均明显增加,其中MY15转化株油酸含量极显著高于CK,而LEA01转化株显著高于CK。与CK相比,高芥酸品种MY15和低芥酸品种LEA01转化株种子亚油酸含量均极显著降低,最大降幅约为17%。转化株芥酸含量均明显高于CK,高芥酸品种MY15转化株芥酸含量均极显著高于CK,最高可增加5.12%,最少也增加了3.11%;而低芥酸LEA01转化株芥酸增加的幅度较低,最高只增加了0.45%,最低仅增加了0.16%,且所有材料的芥酸含量均低于1%,仅转化株T0-1和T0-3显著高于CK。

表5 甘蓝型油菜转化植株种子脂肪酸含量分析Table5 Analysis of fatty acids content of transgenic Brassica napus seed /%
3 讨论
目前调控芥酸的合成主要通过以下3个途径:一是使芥酸合成的关键酶基因BnFAE1过表达,增加芥酸含量,或者沉默该基因表达,降低芥酸含量,如Katavic等[18]利用拟南芥的FAE1基因转化油菜,芥酸含量提高了8%~10%;淮东欣[19]通过在甘蓝型油菜中超表达BnFAE1基因,得到了芥酸含量高达63%的转化植株。二是在油菜中引入外源LPAAT基因,并且将该基因与BnFAE1结合,从而增加芥酸合成量及其与甘油sn-2位的结合以提高种子中的芥酸含量,如陈柳等[20]利用LPAAT和KCS基因共转化甘蓝型油菜,低芥酸油菜品种的芥酸含量提高到10.5%,高芥酸油菜品种芥酸含量提高了5%,达到62.8%;Kanras等[21]利用Ld-LPAAT+Bn-fae1转化甘蓝型油菜,得到了芥酸含量高达72%的转化植株,其后代的芥酸含量也稳定在54%左右。三是调控亚油酸合成的关键酶基因Bnfad2,沉默该基因可以为芥酸合成提供更多的底物,或者过表达该基因,调控脂肪酸的组成,本研究通过amiRNA沉默fad2基因的表达,使芥酸含量显著提高;Jadhav等[22]通过利用基因沉默技术RNAi的方式沉默fad2基因,成功地将甘蓝型油菜转化植株芥酸含量提高了5%~19%;Mietkiewska等[23]利用Hairpin-RNA技术沉默fad2基因,所获得的甘蓝型油菜转化植株后代种子中芥酸含量提高了16%;Loo[24]通过诱变的方式使fad2基因的表达受到抑制,也成功地提高了转化株种子芥酸含量。但是通过利用这种方式提高芥酸的含量有很大的限制性,其原因在于沉默fad2基因虽然能够为芥酸合成提供更多的底物,但FAE1基因的表达没有显著提高,造成芥酸的合成能力受到限制,因此高芥酸品种芥酸含量的提高明显高于低芥酸品种,其原因就是因为不同芥酸含量的油菜品种FAE1基因的表达不同。芥酸的调控是一个复杂的过程,需要各个方面的配合,按照作物生产上的“源·库·流”理论,油酸只是芥酸合成的“源”,要想芥酸含量达到预期目标,还需要“流”能够畅通,即合成芥酸的能力需提高,而甘油结合芥酸的能力为芥酸的“库”,既提高甘油结合芥酸的量,才能有效提高芥酸的含量[25]。研究表明,通过调节fad2基因的表达只能单方面提高芥酸含量,要想使芥酸含量达到80%以上的理想水平,还需要结合FAE1和LPAAT基因的过表达,共同组成多元表达载体[26]。
植物基因调控转化与外源基因的拷贝数目、基因整合的染色体位置、遗传稳定性等因素密切相关[6],但本研究利用amiRNA技术避免了以上几个因素的影响,amiRNA与传统的基因沉默方法相比,具有特异性高、沉默效果好、遗传稳定性较高等优点[6]。其原因在于,首先在amiRNA载体构建的过程中,整个premiRNA序列改变的只有大约21 nt的 miRNA和miRNA∗序列,其余的序列则相当于植物的内源序列,且在植物体内不编码蛋白,从而降低了转基因植物的生物安全性问题,其结构与植物内源的miRNA具有高度的相似性,该特性决定了amiRNA具有良好的遗传稳定性[27-29]。
与前人研究相比,本研究具有独特的优越性,同时由于miRNA和miRNA∗的设计只针对Bnfad2基因,既保证了沉默效果,又降低了脱靶的可能性。amiRNAD2沉默fad2基因的沉默效果及转化植株种子内脂肪酸含量的变化都说明了amiRNA技术能够有效沉默fad2基因的表达,从而减少油酸的继续去饱和生成多不饱和脂肪酸,从而使种子内积累更多的油酸,这也为油菜种子内脂肪酸成分的调节提供了一条有效的途径。在今后的研究中可以继续利用amiRNA技术对基因的沉默效果有针对性地改变种子脂肪酸合成过程中特定基因的表达,从而有效改变种子内脂肪酸的组成,改变其营养结构,提高营养价值,进一步提高油菜种子的附加值。
amiRNAD2对转化品种种子内fad2基因的沉默效果显著,但在不同芥酸含量的甘蓝型油菜品种转化株内,fad2基因的表达虽然都下降,但是不同芥酸含量的油菜品种内fad2基因下降的幅度是不同的。高芥酸品种降低的相对较小,而低芥酸品种的降低反而较大,这是因为高芥酸品种内fad2基因的表达量低于低芥酸品种,所以基因沉默的时候其相对变化反而小。同时,不同转化株内fad2基因的表达量是不同的,其表达差异甚至达到了显著水平,这种差异可能是因为在转化过程中,外源基因序列在转入受体材料过程中,插入基因位置的不同而造成。
4 结论
本研究结果表明,amiRNA技术能够很好地沉默fad2基因,使得fad2基因的表达量在高芥酸甘蓝型油菜品种中只有未转化之前表达量的6.67%~10.00%,其芥酸含量增加了2.11%~5.12%,在低芥酸甘蓝型油菜品种中fad2基因的表达量降低了30%~50%,芥酸含量增加了0.16%~0.45%;同时不论高芥酸品种还是低芥酸品种,脂肪酸的组成都发生了很大的变化,油酸增加 4.99%~10.17%,亚油酸降低 10.71%~16.88%,很好地调节了油菜种子内脂肪酸的组成。综上所述,利用amiRNA技术可有效调控甘蓝型油菜脂肪酸的组成,提高转化株种子芥酸和油酸的含量,降低亚油酸的含量,改善菜籽油的品质,提高菜籽的经济价值。
