根施5-氨基乙酰丙酸对亚适宜温光下黄瓜幼苗生长的影响
2019-01-09董荣荣邓娇燕于贤昌贺超兴李衍素
董荣荣 邓娇燕 郭 佳 于贤昌 贺超兴 李衍素
(中国农业科学院蔬菜花卉研究所,北京 100081)
近年来,我国设施蔬菜面积和产值不断扩大,2014年已达到386万hm2,约占蔬菜总产值的50%[1]。黄瓜(Cucumis sativusL.)是世界各地普遍栽培的蔬菜作物之一,也是我国北方设施栽培的主要蔬菜。然而,冬春季节设施内长期存在亚适宜温光环境(15~18℃/10~12℃,165~300 μmol·m-2·s-1)[2],严重影响了黄瓜的生长、产量和品质。研究表明,亚适宜温光可引起黄瓜幼苗生理代谢活动失调,降低活性氧清除系统的防御能力,诱导膜脂过氧化作用,使膜结构和功能受损[3]。同时,亚适宜温光会降低黄瓜幼苗的叶绿素含量、抑制碳同化相关酶活性,导致光合作用受阻,生长延缓,进而降低黄瓜产量和品质[4]。因此,如何缓解亚适宜温光环境对黄瓜生长、产量和品质产生的不利影响是研究者们亟待解决的难题。
5-氨基乙酰丙酸(5-aminolevulinic acid,ALA),又名δ-氨基酮戊酸,是一种广泛存在于动植物等机体活细胞中的非蛋白氨基酸,是生物体合成叶绿素、血红素和维生素B12等四吡咯环色素必不可少的物质,参与生物体中多种生物化学反应,具有植物生长调节剂的作用[5]。随着人类社会对生态和环境安全的日益关注,具有无毒、无公害、在环境中易降解无残留特点[6]的ALA备受国内外学者及产业界的重视。研究表明,外源ALA高浓度时可以作为光敏除草剂[7],低浓度时可以增强植物的耐盐[7-8]、弱光[9]、低温[10-11]、高温[12]、干旱[13]等抗逆性,具有促进种子萌发[14]、幼苗生长[11]、提高抗氧化酶活性、增强活性氧清除能力[15]、调节植物叶绿素合成、增强光合作用能力[16]、提高产量和改善果实品质[17]等生理作用。目前,对ALA的研究主要集中在通过叶面喷施ALA提高植物光合效率、促进植株生长发育和提高植物抗盐能力等方面。研究表明,无论是根施还是叶面喷施[7],ALA均能对植物产生生理效应,但叶面喷施会导致空气湿度加大,使植物更易感染病害。前人研究发现叶面喷施ALA预处理可通过提高抗氧化酶活性有效缓解高温等胁迫对黄瓜幼苗的生长抑制[12]。燕飞[18]研究发现喷施外源ALA可提高盐胁迫下黄瓜幼苗的叶片水势,缓解植物矿质元素吸收平衡的紊乱。与叶面喷施相比,根施ALA更符合现代设施农业生产省工省时的需求,且不需要考虑ALA见光易分解的特性。目前,关于根施ALA对亚适宜温光下黄瓜幼苗生长、抗氧化酶活性、矿质元素吸收和分配及叶绿素合成过程中相关基因表达影响的研究尚鲜见报道。因此,本研究以人工气候室模拟亚适宜温光环境,通过根区灌溉ALA处理,探究根施ALA能否缓解亚适宜温光对黄瓜幼苗生长产生的不利影响,并确定其最适施用浓度,以期为ALA缓解植物亚适宜温光伤害提供理论依据,并为ALA在设施农业上的应用提供技术支持。
1 材料与方法
1.1 试验材料
供试黄瓜品种为中农26号,由中国农业科学院蔬菜花卉研究所提供。供试药剂为5-氨基乙酰丙酸盐酸盐(ALA),由北京科创欣达科技有限公司提供。
1.2 试验设计
试验于2016年10月-2017年2月在中国农业科学院蔬菜花卉研究所人工气候室进行。选取饱满、大小一致的黄瓜种子,55℃温水浸种后,于30℃恒温箱中催芽至露白,播于32孔穴盘中,基质为“商道”育苗基质。一叶一心时,将穴盘剪开,然后挑选生长一致的幼苗移至人工气候室,进行根施不同浓度ALA(0、1、5、10 mg·L-1)和亚适宜温光(光周期为 12 h/12 h,相对湿度为80%,温度为18/12℃,光照强度为180±20 μmol·m-2·s-1)处理,以亚适宜温光下施清水处理为对照。试验共设4个处理,即亚适宜温光+清水(CK)、亚适宜温光+根施1 mg·L-1ALA(T1)、亚适宜温光+根施5 mg·L-1ALA(T3)和10(亚适宜温光+根施10 mg·L-1ALA)。将ALA溶于清水中得到不同浓度的ALA溶液,然后进行根区灌溉,每株浇50 mL溶液,每3 d处理一次,共6次,每处理设3次重复,每重复45株苗,18 d后测定各指标。
1.3 测定项目与方法
1.3.1 生长量指标的测定 每处理取20株幼苗,将植株分为地上和地下两部分,用去离子水冲洗干净后擦干,测量植株株高(茎基部到生长点的距离)、茎粗(地上部1 cm位置)和鲜重后,将样品于105℃杀青15 min,75℃烘干至恒重,用分析天平称其干物质量,按照公式计算壮苗指数:

1.3.2 叶面积、根系活力、叶绿素含量、气体交换参数和叶片ALA含量的测定 1)叶面积测定:将全株叶片剪下,平铺到光源板上,再用数码相机水平拍照,把照片传到电脑上,采用LA-S叶面积分析系统(杭州万深检测科技有限公司)对叶面积进行分析计算[3]。
2)根系活力测定[3]:称取0.5 g根系,剪成长约2 cm的片段,放入试管中,设置2个空白对照。对照先加入 2 mL 1 mol·L-1H2SO4,其余试管中加 10 mL 0.4%2,3,5-三苯基氯化四氮唑(2,3,5-triphenyte trazolium chloride,TTC)和 6.67 mol·L-1pH 值 7.0 磷酸缓冲液等量混合液,封口后放入37℃恒温箱中,4 h后取出,除对照外,其余试管加入 2 mL 1 mol·L-1H2SO4终止反应,放置15 min后,将根系取出并用滤纸吸干,放回原试管,各试管中加入95%乙醇10 mL,提取24 h至根变白,根据颜色稀释3~5倍后,利用UV-1800分光光度计(日本岛津公司)在波长485 nm下测定吸光值,按照公式计算根系活力:
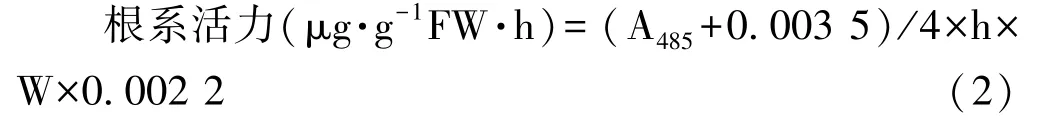
式中,h为时间(h=4);W为样品鲜重(W=0.5)。
3)叶绿素含量测定[3]:取新鲜植物叶片,擦净组织表面污物,去除中脉剪碎。称取剪碎叶片0.2 g于试管中,加入95%乙醇20 mL后封口,置于暗处24~36 h,至叶片发白,用分光光度计分别在波长665、649和470 nm下测定吸光值,以95%乙醇为空白,根据公式分别计算叶绿素 a(chlorophyll a,Chla)、叶绿素 b(chlorophyll b,Chla)、类胡萝卜素浓度及色素含量:

式中,Ⅴ为提取液体积(Ⅴ=0.02 L);n为稀释倍数(n=1);W为样品鲜重(W=0.2 g)。
4)气体交换参数的测定:利用Li-6400光合测定仪(美国基因有限公司)测定功能叶的净光合速率(net photosynthetic rate,Pn)、 气孔导度 (stomatal conductance,Gs)、蒸腾速率(transpiration rate,Tr)和胞间 CO2浓度(intercellular CO2concentration,Ci),测定时设定光量子通量密度(photon flux density,PFD)为400 μmol·m-2·s-1。 称取 5 g 新鲜叶片,加入 6 mL pH值4.6乙酸钠缓冲液冰浴研磨,于4℃下,12 000×g离心15 min,然后用4 mL提取液清洗沉淀2次,合并上清液,吸取1 mL提取液,加入4滴乙酰乙酸乙酯,沸水浴15 min,取出冷却后,加入等体积艾氏试剂,15 min后测定波长553 nm下的吸光值,根据标准曲线计算ALA 含量[7]。
1.3.3 抗氧化酶活性及丙二醛含量的测定 称取0.5 g鲜样,加入 4 mL 磷酸缓冲液(0.05 mol·L-1,pH值为7.8)冰浴研磨成匀浆,于4℃下,10 500 r·min-1离心20 min后冷藏保存[19],用于抗氧化酶活性测定。
1)超氧化物歧化酶(superoxide dismutase,SOD)活性测定[19]:向试管中加入上述酶液50 μL(2支对照试管各加同体积磷酸缓冲液),加入3 mL反应液(蒸馏水∶pH 值7.8 磷酸缓冲液∶130 mmol·L-1甲硫氨酸 ∶750 μmol·L-1氮蓝四唑 ∶100 μmol·L-1EDTA-Na2∶20 μmol·L-1核黄素=5∶30∶6∶6∶6 ∶6),其中 1 支对照试管置于暗处,其余各管于4 000 lx日光下反应20~30 min,反应结束后,以不照光的对照管作空白,利用分光光度计在波长560 nm下测定吸光值,以抑制氮蓝四唑(nitroblue tetrazolium,NBT)光化学还原50%所需酶量为一个酶活性单位(U)。
2)过氧化物酶(peroxidase,POD)活性测定[19]:取上述酶液20 μL于比色杯中(对照加20 μL磷酸缓冲液),加入3 mL反应液(0.1 mol·L-1pH值6.0磷酸缓冲液50 mL,加入愈创木酚28 μL,于磁力搅拌器上加热溶解,加入30%H2O219 μL保存于冰箱中),于波长470 nm下测定吸光值并计时,每隔1 min读取数据一次(分别读取 0、1、2、3 min吸光值),以每分钟内吸光值变化0.01为一个酶活性活力单位(U)。
3)过氧化氢酶(catalase,CAT)活性测定[19]:取上述酶液100 μL于比色杯中(对照加100 μL磷酸缓冲液),加入3 mL反应液(0.1 mol L-1pH值7.0磷酸缓冲液 20 mL,加入 0.1 mol·L-1H2O25 mL),于波长 240 nm下测定吸光值并计时,每隔1 min读取数据一次(分别读取0、1、2、3 min 的吸光值),以每分钟吸光值减少0.01为1个酶活性单位(U)。
4)丙二醛(malondialdehyde,MDA)含量测定[19]:取上述酶液1 mL(对照加1 mL蒸馏水),加入2 mL 0.67%TBA溶液,封口后沸水浴15 min,迅速冷却(用冷水冲泡),倒入指形管中,4 000 r·min-1离心20 min,取上清液分别于波长600、532、450 nm下测定吸光值,然后按照公式计算MDA含量:
MDA(μmol·g-1FW)=C×V/W=0.154 8(A532-A600)-0.013 44 A450
式中,V为提取液体积(Ⅴ=0.012 L);W为样品鲜重(W=0.5 g)。
1.3.4 矿质元素含量的测定 将新鲜的黄瓜幼苗根、茎、叶分别取样、洗净、烘干磨碎后保存。称取0.2 g植物干样于消化管中,加入10 mL浓硫酸,1 g硫酸亚铜和硫酸钾(质量比为1∶3)混合试剂,380℃消煮50 min,冷却后用hanon k9840凯氏定氮仪(济南海能仪器股份有限公司)测定黄瓜幼苗根、茎、叶中的含氮量[18]。取0.1 g干样于消化管中,加硝酸 5 mL,MARS240/50用微波消解仪(Milestone公司,德国)进行消煮至澄清,定容至15 mL,采用5300 DV电感耦合等离子发射光谱仪(PE公司,美国)测定磷、钾、钙、镁、铁等元素含量[20]。
1.3.5 叶绿素合成相关基因表达的测定 参照王平荣等[21]方法获取叶绿素合成相关基因的登录号和序列,在黄瓜基因组数据库中进行比对,用Primer 5软件设计引物(表1),总RNA提取和cDNA第一链合成分别采用多糖多酚植物总RNA快速提取试剂[天根生化科技(北京)有限公司]和Fast Quant cDNA第一链合成试剂盒[天根生化科技(北京)有限公司]。实时荧光定量 PCR采用 SYBR®Premix Ex TaqTM(Tli RNaseH Plus)试剂盒,利用MX3000P荧光定量PCR仪(Agilent Technologies Strata gene,德国) 进行,采用的内参为Actin。根据2-△△Ct法[22]计算目的基因的相对表达量。
1.4 数据处理
采用Microsoft Excel 2007和GraphPad Prism 6软件处理数据和作图;SAS 9.2软件对数据进行单因素方差分析,并运用Duncan检验法对显著性差异(P<0.05)进行多重比较。图表中数据均为平均值±SD(标准差)。
2 结果与分析
2.1 根施ALA对亚适宜温光下黄瓜幼苗生长指标的影响
由表2可知,根施ALA明显缓解了亚适宜温光处理对黄瓜幼苗生长的抑制。亚适宜温光下,根施不同浓度ALA不同程度的提高了黄瓜幼苗的茎粗、根冠比、全株干重和壮苗指数,其中以T2(5 mg·L-1ALA)的效果为最好。与CK相比,T2黄瓜幼苗全株干重和壮苗指数分别显著提高32.5%和47.1%。

表1 荧光定量PCR引物序列Table1 Gene-specific primers used for qPCR
2.2 根施ALA对亚适宜温光下黄瓜幼苗叶面积和根系活力的影响
由图1可知,亚适宜温光下,根施ALA可促进黄瓜幼苗叶片生长,其中以T2处理效果最佳,较CK显著提高23.7%,而T1、T3处理的效果稍差,但仍显著高于CK(图1-A)。根施不同浓度ALA均显著提高了黄瓜幼苗的根系活力,以T2效果最佳,较CK提高95.0%(图1-B)。结果表明,根施ALA可以显著缓解亚适宜温光对黄瓜幼苗叶片生长和根系活力产生的抑制作用。
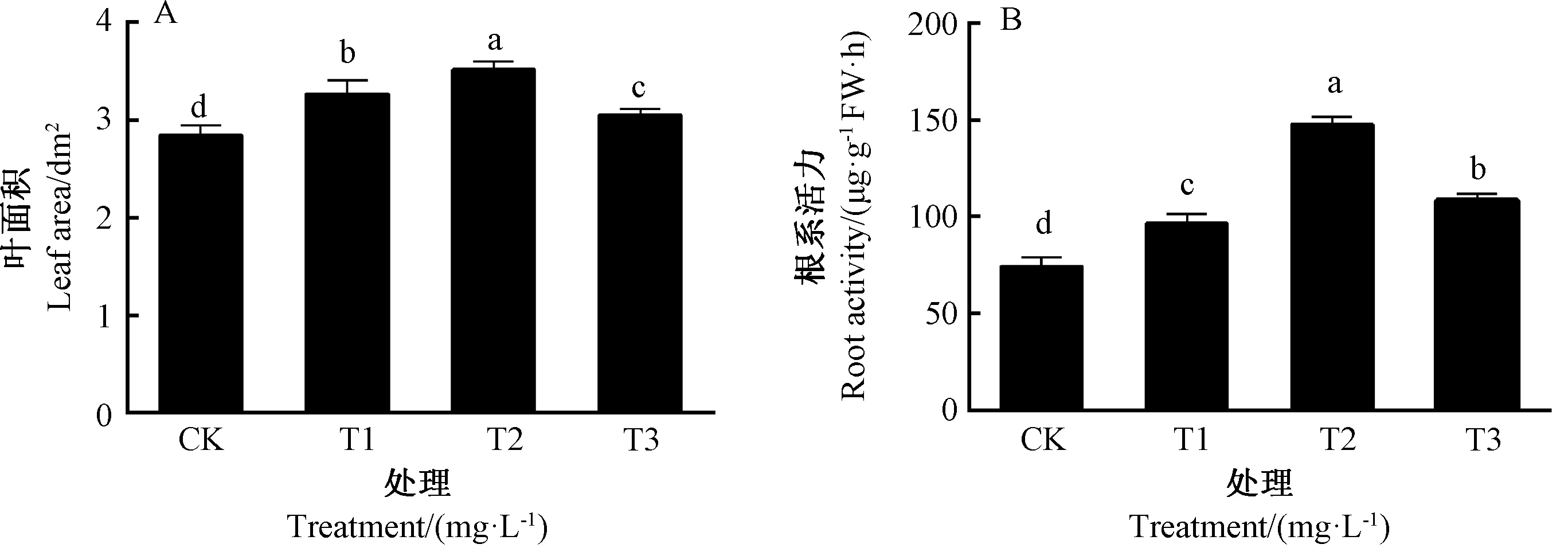
图1 根施ALA对亚适宜温光下黄瓜幼苗叶面积和根系活力的影响Fig.1 Effect of root application of ALA on leaf area and root activity of cucumber seedlings under suboptimal temperature and light intensity
2.3 根施ALA对亚适宜温光下黄瓜幼苗叶片叶绿素、类胡萝卜素和ALA含量的影响
由表3可知,亚适宜温光下根施不同浓度ALA不同程度地提高了黄瓜幼苗叶片的叶绿素、类胡萝卜素和ALA含量,且上述指标均呈先升高后降低的趋势;以T2效果最佳,与CK相比,其叶绿素a、叶绿素b、类胡萝卜素、总叶绿素和ALA含量分别显著提高了50.6%、63.3、41.6%、49.5%和 55.7%。亚适宜温光下,根施ALA可降低叶绿素a/b,表明根施ALA可以促进叶绿素a和叶绿素b的合成,还可以促进叶绿素a向叶绿素b的转化,有利于提高黄瓜幼苗叶片对弱光的耐受性。
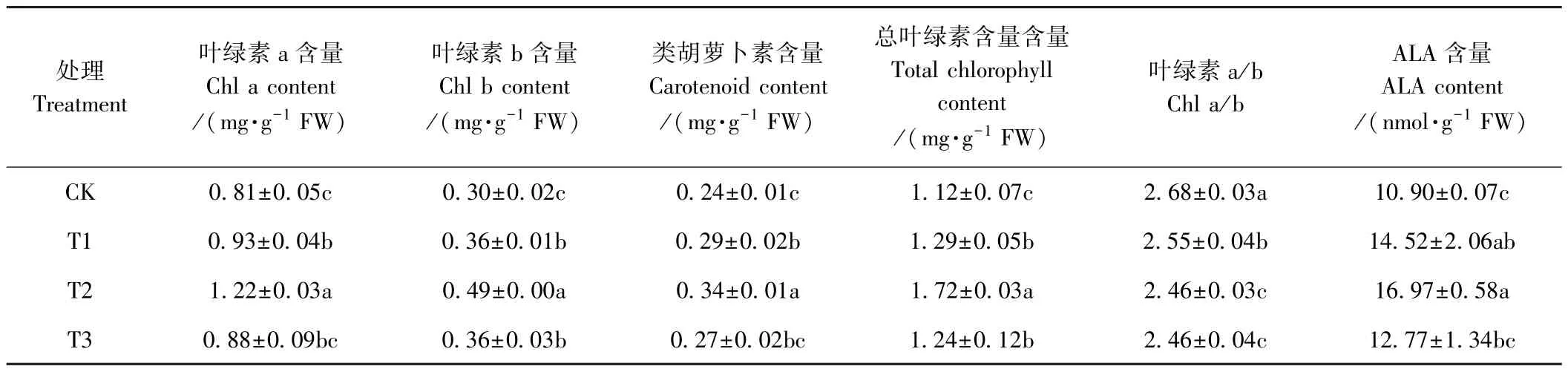
表3 ALA对亚适宜温光下黄瓜幼苗叶片叶绿素、类胡萝卜素和ALA含量的影响Table3 Effects of root application of ALA on chlorophyll,carotenoid and ALA content in leaves of cucumber seedlings under suboptimal temperature and light intensity
2.4 根施ALA对亚适宜温光下黄瓜幼苗气体交换参数的影响
由表4可知,亚适宜温光下根施不同浓度ALA不同程度地提高了黄瓜幼苗的净光合速率、气孔导度和蒸腾速率,其中以T2效果最好,与CK相比,T2分别显著提高了22.9%、42.2%和34.1%。表明根施ALA可缓解亚适宜温光对黄瓜幼苗光合作用的影响。

表4 ALA对亚适宜温光下黄瓜幼苗叶片气体交换参数的影响Table4 Effect of root application of ALA on the gas exchange parameters in leaves of cucumber seedlings under suboptimal temperature and light intensity
2.5 根施ALA对亚适宜温光下黄瓜幼苗抗氧化酶活性及丙二醛含量的影响
由表5可知,亚适宜温光下根施ALA可不同程度地提高黄瓜幼苗叶片和根系的抗氧化酶活性,以T2效果最佳。与CK相比,T2幼苗叶片中的SOD、POD和CAT活性分别提高了10.9%、19.2%和41.3%,根系中分别提高了261.5%、35.6%和29.7%。结果表明,亚适宜温光下,根施ALA可明显提高黄瓜幼苗的抗氧化酶活性,加速活性氧等物质的清除,提高其抗氧化能力,缓解亚适宜温光伤害。
亚适宜温光下根施ALA可显著降低黄瓜幼苗的MDA含量。与CK相比,T1、T2、T3的黄瓜幼苗叶片MDA含量分别降低了31.1%、35.3%和25.9%,根中分别降低16.4%、18.1%和13.9%。结果表明,根施ALA可显著降低黄瓜幼苗的膜脂过氧化程度,从而缓解亚适宜温光对黄瓜幼苗的生长抑制。
2.6 根施ALA对亚适宜温光下黄瓜幼苗矿质元素吸收和分配的影响
由表6可知,亚适宜温光下,ALA处理的黄瓜幼苗根、茎、叶中N、K和Mg含量明显提高,以T2效果最佳。与CK相比,T2处理N、K和Mg含量在黄瓜幼苗根系中分别显著提高了7.0%、36.3%和11.1%;茎中分别显著提高了9.2%、10.3%和9.8%;叶中分别显著提高了15.3%、18.5%和22.0%,说明亚适宜温光下根施ALA可促进黄瓜幼苗对N、K、Mg的吸收和运输。此外,根施5 mg·L-1ALA(T2)显著提高了黄瓜幼苗根系和叶片中P含量,与CK相比,分别提高了14.0%和19.3%;黄瓜幼苗茎和叶片中Fe含量分别较CK显著提高了7.7%和16.7%;显著提高了根系中Ca含量,但降低了茎和叶中Ca的含量,抑制了Ca向茎和叶运输。说明根施ALA促进亚适宜温光下黄瓜幼苗对N、P、K、Mg和Fe元素的吸收和运输,这与根施ALA可以提高黄瓜幼苗叶绿素含量、促进生长的结果相一致。
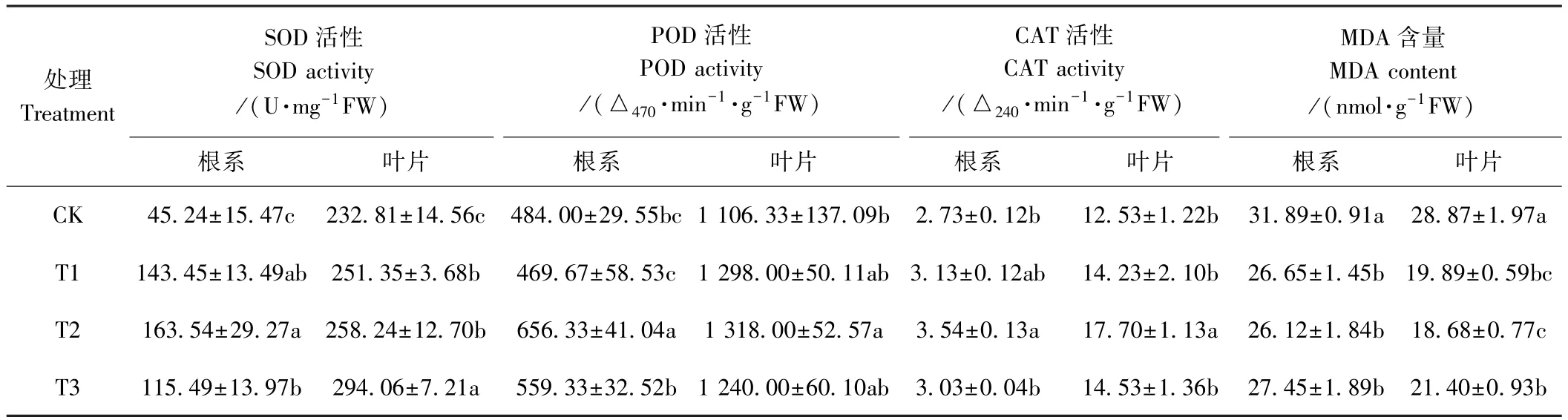
表5 ALA对亚适宜温光下黄瓜幼苗SOD、POD、CAT活性及MDA含量的影响Table5 Effect of root application of ALA on SOD,POD,CAT activities and MDA contents of cucumber seedlings under suboptimal temperature and light intensity
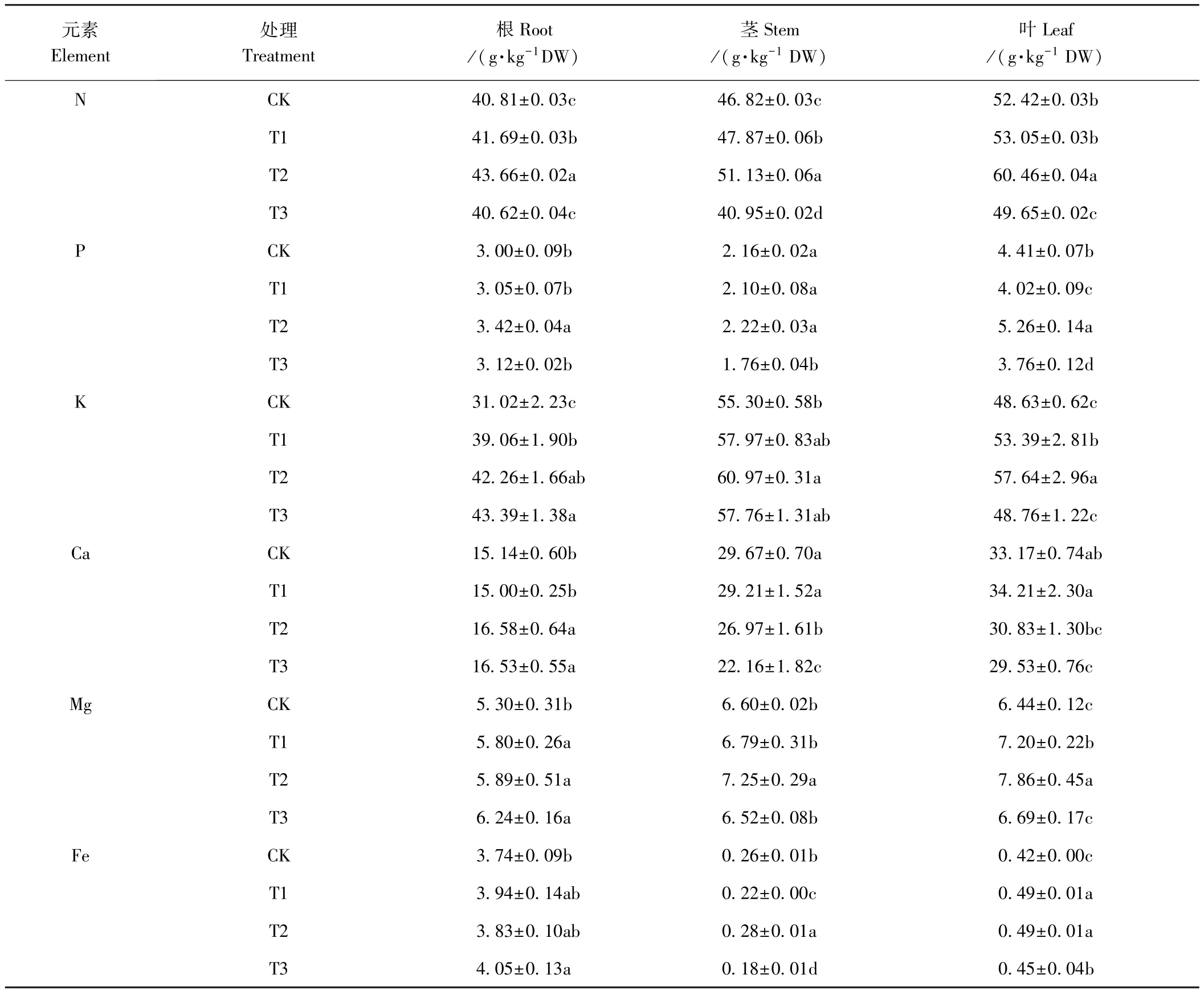
表6 ALA对亚适宜温光下黄瓜幼苗矿质元素吸收和分配的影响Table6 Effect of root application of ALA on absorption and partition of mineral element in cucumber seedlings under suboptimal temperature and light intensity
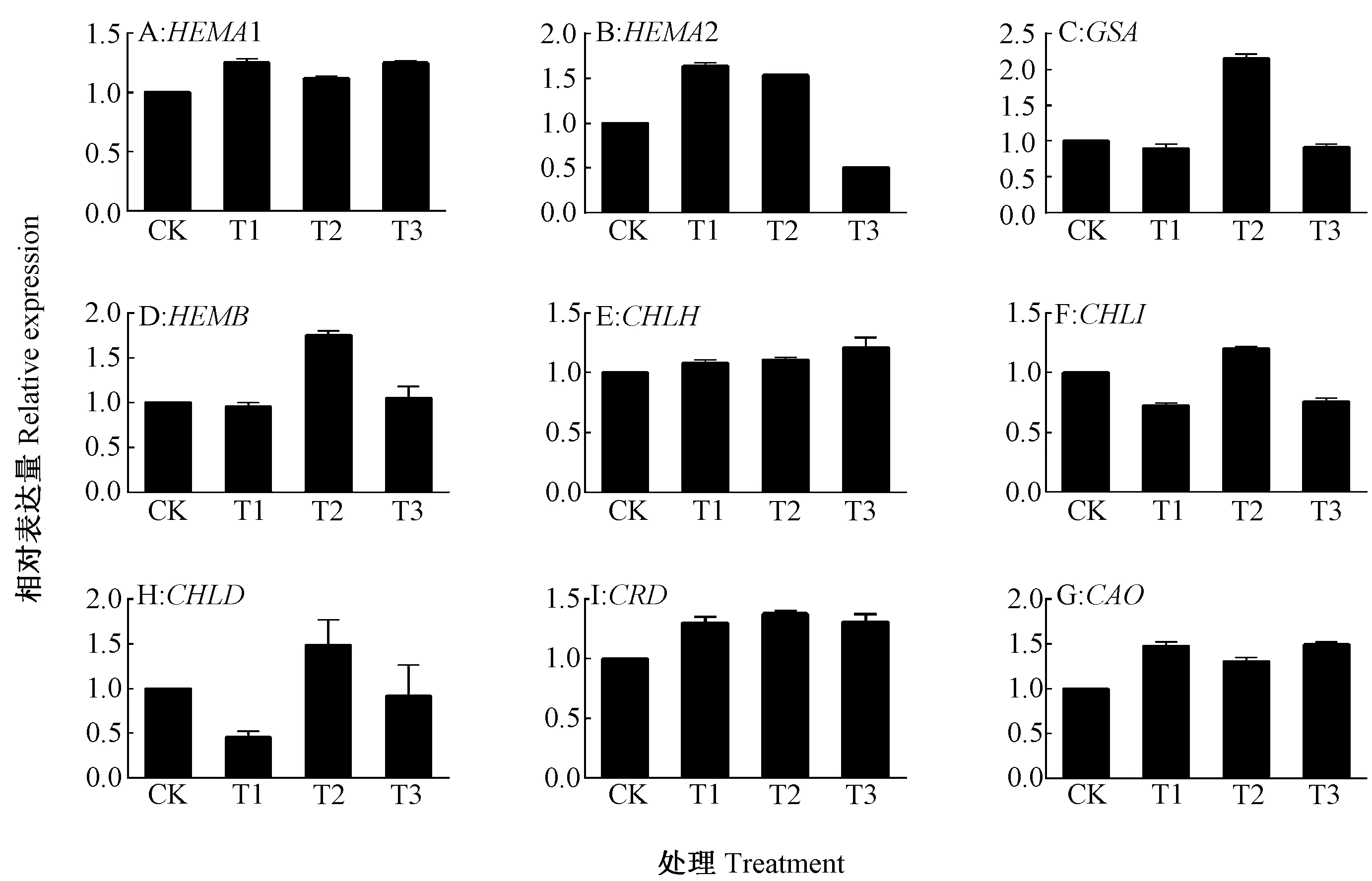
图2 根施ALA对亚适宜温光下黄瓜幼苗叶片叶绿素合成相关基因表达的影响Fig.2 Effect of root application of ALA on transcript level of genes in related to chlorophyll synthesis of cucumber seedlings under suboptimal temperature and light intensity
2.7 根施ALA对亚适宜温光下黄瓜幼苗叶片叶绿素合成相关基因表达的影响
ALA合成是叶绿素合成的第1个主要调控位点,高等植物体内的ALA合成主要由谷氨酰-tRNA还原酶和谷氨酸-1-半醛氨基转移酶催化,编码基因分别为HEMA和GSA。亚适宜温光下,根施ALA对HEMA的表达量有一定影响(图2-A、B),与CK相比,T2处理HEMA2和GSA的表达量分别提高了1.53倍(图2-B)和2.15倍(图2-C),这与根施ALA提高了黄瓜幼苗叶片中ALA含量的结果相一致。由HEMB编码的ALA脱水酶是ALA代谢的第1个酶,与CK相比,T2显著提高了HEMB的表达量,是CK的1.75倍(图2-D)。Mg离子螯合酶是叶绿素合成的另外一个主要调控位点,黄瓜中Mg离子螯合酶有3个亚基,分别为Mg离子螯合酶H亚基、Mg离子螯合酶Ⅰ亚基和D亚基Mg离子螯合酶,依次由CHLH、CHLI和CHLD编码(图2-E、F、H),亚适宜温光下,根施 5 mg·L-1ALA(T2)对CHLH、CHLI和CHLD的表达量无明显影响。CRD编码的Mg-原卟啉Ⅸ单甲基酯环化酶是叶绿素合成必不可少的酶,亚适宜温光下根施ALA其表达量略有提高(图2-Ⅰ)。CAO编码叶绿素酸酯a加氧酶,催化叶绿素a向叶绿素b的转化,与CK相比,亚适宜温光下根施ALA对CAO的表达量略有提高(图2-G),这与根施ALA降低了叶绿素a/b的结果相一致。综上,亚适宜温光下,根施ALA虽然对叶绿素合成相关基因的表达有一定的提高作用,但效果并不显著。
3 讨论
植物的生长发育与温度、光照等环境条件密切相关,亚适宜温光环境使黄瓜生理代谢活动失调,抑制其株高、茎粗和叶面积的增加,降低根系活力,生物量增加幅度显著降低[18]。徐晓洁[23]研究表明,喷施低浓度的ALA能有效缓解NaCl胁迫对番茄植株生长的抑制作用,表现为叶片受害程度降低,株高、茎粗、叶面积增大幅度提高,并显著提高番茄植株根系活力。柳翠霞等[24]认为叶面喷施低浓度ALA可明显增加茎粗,缓解弱光下黄瓜幼苗徒长的趋势。本研究表明,根区灌溉低浓度ALA可不同程度地增加黄瓜幼苗的茎粗、株高、根冠比、生物量、壮苗指数、叶面积、根系活力和叶片ALA含量,其中以5 mg·L-1ALA(T2)效果最好,高浓度ALA会抑制黄瓜幼苗的生长,这与前人研究[25]结果一致。表明根施适宜浓度的ALA可有效缓解亚适宜温光对黄瓜幼苗生长的抑制。
ALA是叶绿素生物合成的第1个关键前体,可以调节叶绿素的合成。本研究表明,亚适宜温光下,根区灌溉ALA可显著提高黄瓜幼苗叶片的叶绿素a、叶绿素b和总叶绿素含量,并降低叶绿素a/b比值,促进叶绿素a的合成,进而促进叶绿素a转化为叶绿素b,同时提高 Pn、Gs和 Tr,这与郭晓青[26]、杨蕊等[27]和刘卫琴等[28]的研究结果一致。Tanaka等[29]研究发现叶绿素b可与PSⅡ脱辅基蛋白结合,起到稳定蛋白结构的作用。叶绿素相对含量的增加可提高捕光色素复合体中天线色素的比例,更有效地捕获有限的光能,弥补光照不足对光合作用的影响,这与根施ALA提高亚适宜温光下黄瓜幼苗叶片光合效率的结果相一致。表明根施ALA不仅可以提高黄瓜幼苗叶片的耐弱光性,还能够提高其光合作用,以5 mg·L-1ALA的效果最好。叶绿素合成有ALA合成和Mg离子插入原卟啉Ⅸ2个主要的调控位点。本研究表明,根区灌溉不同浓度的ALA 对HEMA、HEMB、CHLH、CHLI、CHLD和CRD等基因的表达量均无显著提高或降低效果,表明亚适宜温光下,根区灌溉ALA处理对叶绿素合成过程中相关基因的表达并无明显的调控作用,这与前人[7,30]研究结果一致。表明亚适宜温光下,根区灌溉ALA可能通过提高ALA含量来增加叶绿素合成的底物量,从而提高了黄瓜幼苗叶片叶绿素含量,也有可能是由于根施ALA处理可以调节叶绿素合成过程中相关酶的活性,进而提高了黄瓜幼苗叶片叶绿素含量。外源ALA对叶绿素合成过程中相关酶活性的影响及其调控机制还有待进一步研究。
ALA是亚铁血红素合成的前体,外源ALA可增加亚铁血红素的含量[31]。而SOD、CAT和POD属于亚铁血红素蛋白酶类,是细胞内清除活性氧的主要酶促保护系统。Shen等[32]研究发现逆境条件下ALA提高抗氧化酶的活性是一种普遍效应。外源供给适宜浓度的ALA可提高抗氧化酶活性,加速活性氧物质的清除[33],这可能是ALA提高植物抗性的一种作用机制。本研究表明,亚适宜温光下,根区灌溉ALA可不同程度地提高黄瓜幼苗根系和叶片的SOD、POD和CAT活性,并降低MDA含量,这与前人研究[28,34]结果一致。表明亚适宜温光下根施ALA可通过提高SOD等抗氧化酶活性来提高黄瓜幼苗的抗氧化能力,降低活性氧自由基的生成速率,降低膜脂过氧化程度,维持膜系统的完整性,提高黄瓜幼苗的耐亚适宜温光能力,以5 mg·L-1ALA的效果最好。
低温弱光环境使植物吸收矿质元素的能力下降[2],严重影响黄瓜幼苗的生长发育。研究表明,外源ALA具有引导植物根系对土壤营养元素吸收运输和分配、提高肥料利用效率、减少施肥量的作用[35]。低浓度ALA可以减少作物根系对生长介质中Na+和K+的吸收,同时能促进作物对大量元素(N、P、Ca、Mg)及微量元素(Fe、Zn)的吸收[34]。盐胁迫处理条件下,外源ALA可降低黄瓜幼苗体内的Na+含量,提高K+、Ca2+和Mg2+含量,维持细胞膨压,提高黄瓜幼苗的耐盐性,保持其正常的生理代谢[21]。本研究表明,亚适宜温光下,根施ALA提高了黄瓜幼苗根系中 N、P、K、Ca、Mg和Fe含量,茎中N、K和Mg含量,叶片中N、K、Mg和Fe含量,这与前人研究[35]结果基本一致。表明亚适宜温光下,根施ALA可以促进黄瓜幼苗对部分大量元素和微量元素的吸收和运输,进而促进生长。
4 结论
本研究结果表明,根区灌溉5 mg·L-1ALA可以显著促进亚适宜温光下黄瓜幼苗生长,提高黄瓜幼苗干重和壮苗指数。但根施ALA对黄瓜幼苗叶绿素合成相关酶的活性及后期生长、产量和品质的影响还有待进一步研究。
