镉胁迫对草地早熟禾生长与生理代谢的影响
2019-01-10鲜靖苹柴澍杰牛奎举董文科马晖玲
鲜靖苹 柴澍杰 王 勇 牛奎举 董文科 马晖玲 张 然
(1甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃兰州 730070;2新乡学院生命科学技术学院,河南新乡 453000)
镉(Cd)是生物毒性最强的重金属元素之一,是仅次于汞的第二大环境污染源。Cd会对植物产生毒害,且极易被植物吸收,并通过食物链富集对人体产生慢性中毒[1]。近年来,由于工矿三废的排放、无机化肥的过量使用,导致有毒重金属在土壤中过量积累,严重污染环境,对人类健康造成巨大威胁[2]。因此,对重金属Cd的治理刻不容缓。与传统的化学、物理等重金属污染的治理方法相比,植物修复具有成本低、环境友好和清除彻底等明显优势,是一种有效清除重金属污染的新兴技术,也是极具潜力的重金属污染治理手段[3]。然而,现有Cd超富集植物的部分缺陷限制了其在Cd污染治理中的应用,如繁殖较差、生物量小等[4]。因此,筛选出具有较强抗Cd性、生物量大、适应性广,且能够多次刈割的植物材料对生态修复具有重要意义。
草坪草具有生命力旺盛、繁殖和再生能力强,以及分布范围广、多年生和抗逆性强等优点[5]。研究发现草坪草作为植物修复材料,在修复重金属污染土壤方面较其他植物具有显著的优越性:一方面,草坪草不会进入食物链对人类健康造成隐患;另一方面,草坪草可以多次刈割,能够较好地达到治理重金属污染的目的[6]。草地早熟禾(Poa pratensisL.)是多年生冷季型草坪草,具有耐修剪、耐践踏、综合抗病力强和较好的抗寒抗旱性等特点,被广泛用于城市园林绿化、高尔夫球场发球台、球道和其他运动场地建植[5-6],是常见的冷季型草坪草种之一。目前,前人研究主要集中在对草地早熟禾的耐盐碱性及水肥管理等方面[7],而关于草地早熟禾在重金属胁迫方面的生理响应和耐性方面的研究尚鲜见报道。本试验以国内广泛种植的草地早熟禾品种8份及2个采集于甘肃省境内的野生早熟禾为参试材料,研究Cd胁迫下草地早熟禾幼苗生长和生理响应,通过评价参试材料的Cd胁迫耐受性,筛选出耐Cd的草地早熟禾种质材料,以期为土壤Cd污染的治理及生态环境保护提供有效措施及理论依据。
1 材料与方法
1.1 试验材料及来源
供试10份早熟禾材料中,8份商用品种均购自北京克劳沃种子公司,2份野生材料于2015年分别采自甘肃省清水县和甘肃省秦州区(表1)。

表1 供试早熟禾材料及来源Table1 Kentucky bluegrass materials and their sources
1.2 试验设计
选择颗粒饱满,大小一致的种子,去掉其中杂质,用0.1%KMnO4溶液浸泡30 min,再用去离子水冲洗数次,晾干水分。将处理后的种子直接播入以蛭石为基床、直径10 cm育苗钵中,参照韩建国等[8]的方法进行萌发,期间用1/2 Hoagland营养液培育,每5 d更换一次。当草地早熟禾幼苗生长50 d后,共设置4个浓度梯度 Cd(CdCl2·2.5H2O)处理(0、200、400 和 600 μmol·L-1),以 0 μmol·L-1Cd 为对照(CK),每处理重复3次。7 d后分别称取各处理叶片5 g,蒸馏水洗净,迅速放入液氮中冷冻,-80℃保存用于相关指标的测定。
1.3 测定目标与方法
1.3.1 叶片相对含水量的测定 参照张志良等[9]的方法并稍加改进,剪下完全展开的叶片,擦干表面杂质,迅速称量鲜重(fresh weight,Wf);将叶片浸泡于去离子水中,遮光静置6~8 h,取出后滤纸吸干表面水分,迅速放入已知重量的铝盒称量叶片饱和重(saturated weight,Wt);105℃杀青 30 min,80℃烘干至恒重,称量干重(dry weight,Wd),按照公式计算叶片相对含水量(relative water content,RWC):
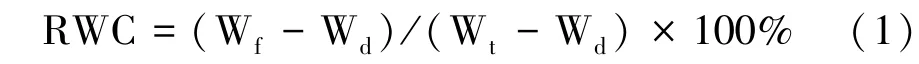
1.3.2 干物质含量的测定 将铝盒置于100~105℃烘箱中烘至恒重(2 h),称其重量(m0);随机选取早熟禾幼苗20株,用去离子水冲洗,剪碎、混匀后放入上述铝盒中称重(m1)。将装有幼苗样品的铝盒置于50~60℃烘箱(鼓风)中3~4 h,然后放入100~105℃烘箱(不鼓风)中3~4 h进一步恒重,重复3次,冷却后称重(m2),按照公式计算植物样品干物质含量:

1.3.3 光合色素含量的测定 参照张志良等[9]的方法并稍加改进。称取新鲜叶片0.2 g,剪碎后放入离心管中,用8 mL 95%乙醇浸提48 h,利用 MAPADAV-1800紫外分光光度计(上海美谱达仪器有限公司)分别于665、649和470 nm波长下测定吸光度值,按照公式分别计算叶绿素和类胡萝卜素含量:

式中,Ca:叶绿素 a浓度;Cb:叶绿素 b浓度;C叶绿素:叶绿素浓度;C类胡萝卜素:类胡萝卜素浓度;V:提取液体积(L);W:称取样品质量(g)。
1.3.4 镉含量的测定及转运系数的计算 测定地上部、地下部生物量后,取出部分烘干样品称重,置于LE4/11/R6马弗炉[纳傅热(上海)工业炉有限公司]中490℃灰化处理8 h,冷却后取出灰化的样品,用王水消煮至澄清,过滤、定容,利用AA-7000型火焰/石墨炉原子吸收分光光度计原子吸收分光光度计(北京东西分析仪器有限公司)采用火焰法测定溶液中的Cd浓度,地上部、地下部的Cd富集浓度以样品单位干重表示,并根据公式计算Cd的转运系数:

1.4 生理指标的测定
1.4.1 酶活性测定 1)超氧化物歧化酶(superoxide dismutase,SOD)活性:采用氮蓝四唑法(nitroblue tetrazolium,NBT)[9]进行测定。反应液总体积为4 mL,反应介质为50 mmol·L-1pH值7.8磷酸缓冲液,含0.2 mL 20 mg·mL-1L-甲硫氨酸、0.2 mL 1 mg·mL-1EDTANa2、0.2 mL 0.1 mg·mL-1核黄素、0.2 mL 1 mg·mL-1NBT、0.1 mL提取酶液(空白管加磷酸缓冲液0.1 mL),放入透明度好的离心管中,温度 25℃,置于4 000 lx光强下光照20 min(调零管用黑布罩上避光),然后于560 nm波长下进行比色,以抑制NBT光化还原50%的酶量为1个酶活单位。
2)过氧化物酶(peroxidase,POD)活性:采用愈创木酚法[9]进行测定。以每分钟内A470变化0.01为1个酶活性单位(U)。
3)过氧化氢酶(catalase,CAT)活性:采用紫外分光光度法[9]进行测定。以每克鲜重(FW)样品每分钟吸光度变化0.001为1个过氧化氢酶活性单位(V)。
1.4.2 脯氨酸含量测定 游离脯氨酸(proline,Pro)含量测定采用酸性茚三酮法[9]。称取叶片0.2 g,剪碎置于试管中,向试管中加入5 mL 3%磺基水杨酸,沸水浴中加热10 min(不断摇动),冷却后过滤至干净试管中(滤液为提取液)。吸取2 mL提取液、2 mL冰醋酸和2 mL酸性茚三酮于具塞玻璃试管中,沸水浴反应40 min,冷却后向试管中加入5 mL甲苯,充分振荡,静置分层后,在520 nm处比色(以甲苯为对照)。根据标准曲线,按照公式计算脯氨酸含量(μg·g-1FW):

式中,X为标准曲线中查得脯氨酸含量(μg)。
1.4.3 丙二醛含量测定 称取植物叶片1 g,加入2 mL 10%三氯乙酸(trichloroacetic acid,TCA)和少量石英砂,研磨至匀浆,然后加入8 mL 10%三氯乙酸进一步研磨,定容,4 000 r·min-1离心 10 min,吸取 2 mL 上清液于10 mL具塞玻璃试管中,加入2 mL 0.6%硫代巴比妥酸溶液,摇匀后沸水浴反应10 min,取出试管迅速冷却,4 000 r·min-1离心 10 min,取上清液,分别于532、450和600 nm波长下测定吸光度[9],按照公式计算丙二醛(malonaldehyde,MDA)含量(μmol·g-1FW):

1.5 数据处理
按照公式计算指标相对值、单项指标耐Cd系数(ω)[10]:

采用 SPSS 19.0软件进行方差分析;Microsoft Excel 2010绘制图表;综合评价方法采用标准差系数赋予权重法。
数据标准化:运用隶属函数平均值(D值)法[11],对各指标进行标准化处理,计算公式如下:
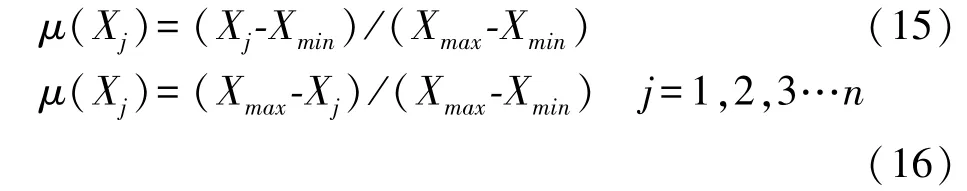
式中,Xj为指标测定值;Xmin和Xmax分别为所有参试材料某一指标的最小值和最大值;指标与耐Cd性呈正相关用公式(15),指标与耐Cd性呈负相关用公式(16)[11]。
综合评价值:按照公式计算各材料各性状隶属值的平均值(D值):
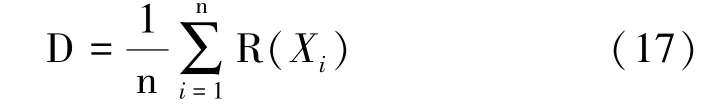
2 结果与分析
2.1 Cd胁迫对早熟禾相对干物质含量及叶片相对含水量的影响
由表2可知,同一Cd浓度处理下,10种早熟禾材料相对干物质含量存在显著差异。200 μmol·L-1Cd处理下,各参试材料的相对干物质含量为77.57%~98.40%,仅9号材料的相对干物质含量低于80%;1、2、7、8和10号材料的相对干物质含量均较高。Cd浓度为400和600 μmol·L-1时,对各早熟禾材料相对干物质含量变化范围分别为69.95%~91.80%和60.70%~86.04%。表明随着Cd处理浓度的增加,各参试材料相对干物质含量均呈明显的下降趋势,尤其是7号材料,由 97.50%下降至 72.01%,降幅为25.48%,而1、2、8和10号材料仍表现出较高的相对干物质含量。此外,不同Cd浓度处理下,9号材料的相对干物质含量均为最低。
植物叶片相对含水量是植物组织水分状况的重要指标,在对植物的抗性研究中发挥着重要的作用[12]。由表2 可知,200 μmol·L-1Cd 处理下,4、7 和 5 号材料叶片相对含水量均较高,2、3和 10号次之。400 μmol·L-1Cd处理下,各参试材料的叶片组织含水量均有所下降,但4、7和10号的相对含水量下降不明显。600 μmol·L-1Cd处理下,除10号材料外,其他参试材料均表现出明显的下降趋势。其中,8号材料降幅最为明显,下降34.1%,10号材料仅下降了1.8%,说明其具有较强的耐Cd性。结果表明,Cd浓度与叶片相对含水量呈显著负相关,在相对叶片含水量上耐Cd性最强的材料为10号,8号材料的耐Cd性最差。
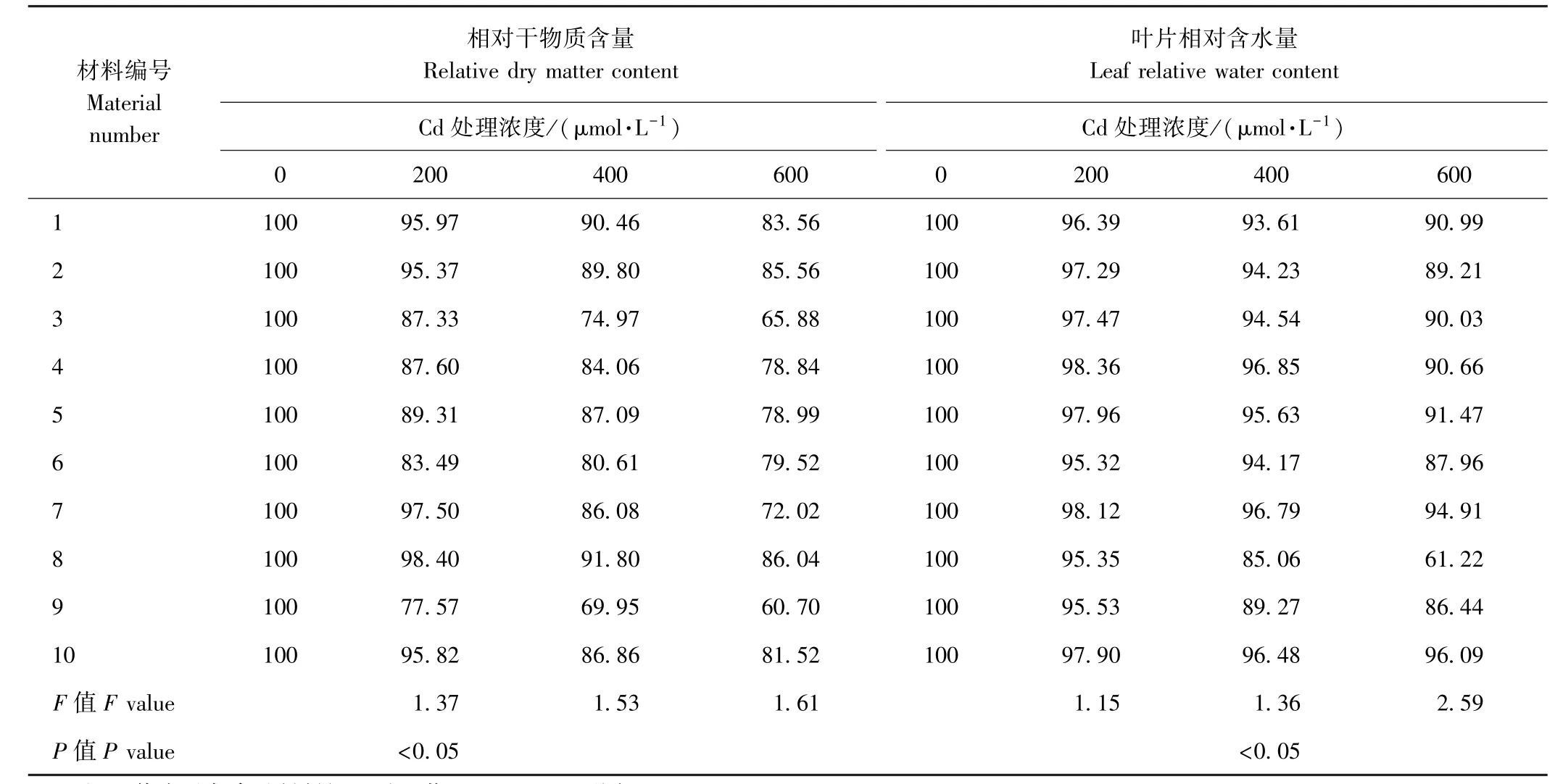
表2 Cd胁迫对早熟禾相对干物质含量和叶片相对含水量的影响Table2 Effect of different concentrations of Cd on dry matter content and leaf water content of Kentucky bluegrass/%
2.2 Cd胁迫下10个早熟禾材料光合色素差异
光合色素含量直接关系到作物的光合作用效率及产量,其中叶绿素和类胡萝卜素含量是反映光合色素的重要指标[13]。 由表3可知,200 μmol·L-1Cd处理下,相对叶绿素含量和相对类胡萝卜素含量均有所降低,降幅分别在75.98%~96.01%和85.31%~99.08%之间;1、5、6和10号参试材料的相对叶绿素含量均较高;1号和3号的相对类胡萝卜素含量值均较高,其中10号叶绿素含量和类胡萝卜素含量均较高。随着Cd处理浓度的升高,各早熟禾材料的相对叶绿素和类胡萝卜素含量均表现出较大幅度的下降,400 μmol·L-1Cd处理下,降幅分别在63.67%~87.53%和79.12%~96.41%之间;600 μmol·L-1Cd 处理下,叶绿素和类胡萝卜素含量降幅分别在42.54%~82.11%和47.43%~90.95%之间;400 和 600 μmol·L-1Cd 处理下,1、5 和10号材料的相对叶绿素和相对类胡萝卜素含量均较高。此外,8号材料的相对叶绿素和相对类胡萝卜素含量随着Cd处理浓度的增加均呈明显下降趋势,分别下降了49.41%和51.01%,说明其耐Cd性较差。
2.3 Cd胁迫下综合评价指标的耐Cd系数
由表4可知,由各参试材料干物质含量计算得到的耐Cd系数变幅在0.69~0.92之间,其中2号和8号材料的耐Cd系数较大,9号材料耐Cd系数最小;各参试材料叶片相对含水量计算得到的耐Cd系数变化幅度较小,在0.80~0.97之间,其中10号材料的耐Cd系数最大,8号材料的耐Cd系数最小;由各参试材料叶绿素含量计算得到的耐Cd系数中,1号材料最大,3号材料最小为0.77;由各参试材料类胡萝卜素含量计算得到的耐Cd系数中,1号和5号材料均达到0.95,8号材料最小,低于0.80。结果表明,不同材料相同指标下的耐Cd系数差异显著(P<0.05),相同材料在不同指标下的耐Cd系数也存在差异。利用单项指标方法反映不同材料的耐Cd性,结果不够准确,因此本研究采用隶属函数法[14],进一步对参试材料的多项指标进行综合评价。

表3 Cd胁迫对早熟禾叶绿素含量、类胡萝卜素含量的影响Table3 Effect of different concentrations of Cd on chlorophyll content and carotenoid content /%

表4 10份早熟禾材料在Cd胁迫下综合评价指标的耐Cd系数Table4 Cd-tolerance coefficient of comprehensive evaluation indexes of 10 Kentucky bluegrass materials
2.4 模糊隶属函数法对早熟禾耐Cd性综合评价
采用标准差系数赋予权重法,计算10份早熟禾材料苗期的综合评价D值。由表5可知,D值的变化范围为0.17~0.59,1、5、6和10号材料的D 值均在0.45以上,说明其综合评价最优,其中5号材料清水和10号材料午夜的耐 Cd性最强,D值分别为0.50和0.59;D 值在 0.40~0.45 之间的材料有 2、3、4、6 和 7号,属中等耐Cd性材料;D值在0.40以下的材料为8号和9号,分别是商用品种橄榄球2号和采自天水的野生材料秦州,属于耐Cd性较差的材料。
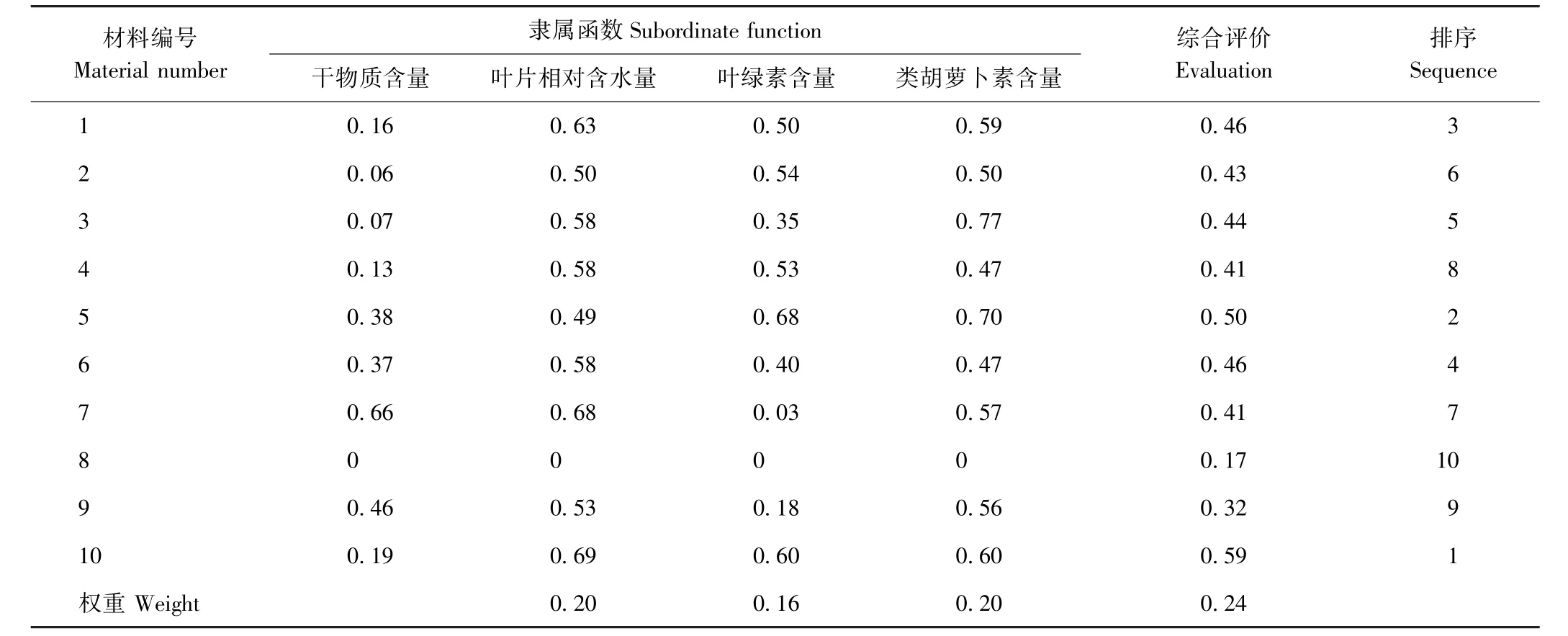
表5 10份早熟禾材料苗期耐Cd性综合评价Table5 Comprehensive evaluation of Cd tolerance of 10 Kentucky bluegrass materials at seedling stage
2.5 Cd在10份草地早熟禾材料体内分布和积累特性的研究
由表6可知,随着Cd浓度的增加,10份材料地上部和根系的Cd浓度和转运系数均随之增大,且地上部Cd浓度增加的幅度较根系大。相同Cd处理水平下,地上部Cd浓度最高的为10号材料,5号和7号次之,8号和9号地上部的Cd浓度较低;根系Cd浓度最高为10号材料,1号和5号次之,8号较低,9号最低。200 μmol·L-1Cd处理下,10份材料的地上部 Cd浓度较根系低,转运系数均小于 1;400 μmol·L-1和 600 μmol·L-1Cd处理下,10份材料中除8号材料外,转运系数均大于 1,即地上部 Cd浓度高于根系;400 μmol·L-1Cd处理下,5、7和10号材料的转运系数均达到1.50以上,1和9号材料转运系数均较低,且均小于 1.20,8 号材料的转运系数为 0.98;600 μmol·L-1Cd处理下,3、5和7号材料的转运系数均达到1.60以上,其中1号材料的转运系数最低,8和9号材料的转运系数也较低,分别为1.12和1.15。
2.6 Cd胁迫对早熟禾叶片中SOD、POD、CAT活性的影响
SOD是植物体内清除氧自由基的一种重要的保护酶[15]。由图1-A可知,Cd胁迫对草地早熟禾种质材料SOD活性影响显著。方差分析结果表明,10种早熟禾材料的SOD活性在不同浓度Cd胁迫下均呈显著下降趋势(P<0.05)。 200 μmol·L-1Cd 处理下,8 号和9号材料的降幅较大,分别为44.4%和30.3%,其他材料降幅均在25.5%以下。随着Cd处理浓度的升高,各参试材料SOD活性下降幅度在25.45%~63.62%之间,且均存在差异。 400和 600 μmol·L-1Cd处理下,8号材料的降幅分别为49.42%和53.99%;9号材料的降幅分别为51.06%和63.62%。结果表明,随着Cd胁迫浓度的升高,1、5、6和10号材料SOD活性的降幅均较小,说明上述4种材料的耐Cd性均较强;8号和9号材料降幅较大,说明其耐Cd性较差。
由图1-B可知,10种材料叶片的POD活性均随着Cd胁迫浓度的增加而降低,且差异较大。200 μmol·L-1Cd处理下,1号和6号材料的降幅均较大,分别为28.65%和37.48%,其他材料降幅在4.06%~25.6%之间;400 μmol·L-1Cd处理下,4号和 8号材料的降幅分别为50.65%和55.04%,其他材料的降幅均在50%以下;600 μmol·L-1Cd 处理下,8 号和 9 号材料的降幅均达到 83.6%,其他材料降幅在 21.9%~57.4%之间,结果表明,高浓度的Cd胁迫下,各参试材料的POD活性降幅均明显增加,其中耐Cd性强的材料降幅较小,而耐Cd性差的材料降幅较大。10号材料POD活性在400和600 μmol·L-1Cd胁迫下的降幅均最小,说明10号材料午夜表现出较强的耐Cd性。
由图1-C可知,随着Cd处理浓度的增加,5号和10号材料CAT活性的下降幅度均较小,降幅在3%以下;8号和9号材料的CAT活性均下降明显,且与其他材料差异显著。各供试材料的CAT活性和SOD活性的变化趋势相同,表明二者具有一定的协同作用。CAT和SOD清除氧自由基的反应机理上也证实了此结果,SOD消除氧负离子的反应最终生成H2O2,而CAT利用生成的H2O2反应生成H2O和O2,以达到清除活性氧的目的[16]。

表6 10种早熟禾材料地上部和根系的Cd浓度Table6 The concentration of Cd in 10 Kentucky bluegrass materials shoots and roots
2.7 Cd胁迫对早熟禾叶片中脯氨酸及MDA含量的影响
脯氨酸含量的变化是反映植物在逆境胁迫下生理适应的指标之一。研究发现植物体内氨基酸代谢与脯氨酸含量变化密切相关,因此脯氨酸含量还可作为反映氨基酸代谢是否发生障碍的指标[17]。由图2可知,与对照相比,10种早熟禾材料的脯氨酸含量均随着Cd处理浓度的增加而逐渐降低,说明Cd胁迫在一定程度上对植株幼苗产生了伤害。200 μmol·L-1Cd处理下,1、2、5和10号材料脯氨酸含量的降幅均较小(22%以下);Cd 处理浓度由 400 μmol·L-1增加到 600 μmol·L-1时,10号材料脯氨酸含量的下降趋势较平缓,但与其他材料差异显著,说明10号材料在脯氨酸含量上表现出较强的耐Cd性;而4、8和9号材料脯氨酸含量均下降明显,说明这3种材料抗性较差。
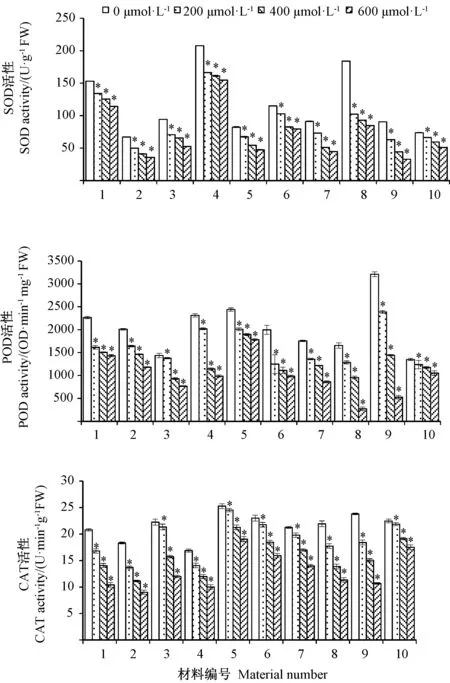
图1 Cd胁迫对早熟禾SOD、POD和CAT活性的影响Fig.1 Effect of different concentrations of Cd on the activities of SOD、POD and CAT of 10 Kentucky bluegrass materials
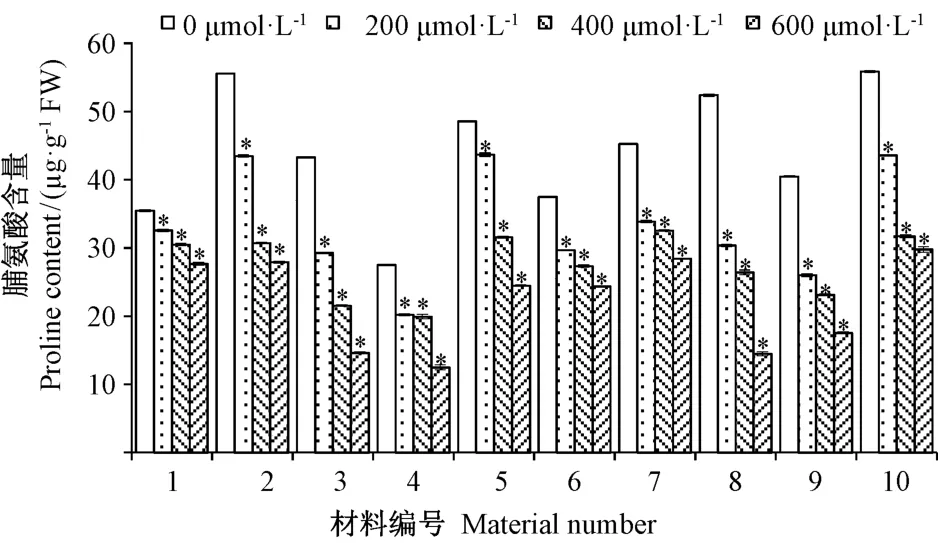
图2 Cd胁迫对早熟禾材料脯氨酸含量的影响Fig.2 Effect of different concentrations of Cd on the contents of proline of Kentucky bluegrass
MDA是反映植物在逆境胁迫下膜系统受害程度的重要指标之一[18]。由图3可知,Cd胁迫下,各参试品种的MDA含量均有不同程度的升高;各参试材料在相同浓度的Cd胁迫下,细胞膜受伤害程度不同,表明其对Cd胁迫的耐受能力存在材料间差异。200 μmol·L-1Cd处理下,1号超级哥来德和10号午夜的MDA含量虽然分别升高了5.38%和7.37%,但与其他材料相比变化较小,表现出较高的耐Cd性;而2号解放、3号巴润和8号秦州的MDA含量升高较明显,分别升高了32.8%,36.5%和50.1%。随着Cd处理浓度的增加,8号秦州的MDA含量升高最为明显,400和600 μmol·L-1Cd处理下分别达到 62.6%和 80.7%,始终表现出Cd敏感性;而1号超级哥来德和10号午夜在Cd处理浓度达到 600 μmol·L-1时,MDA 含量增幅仍低于24.0%,表现出较好的耐Cd性。
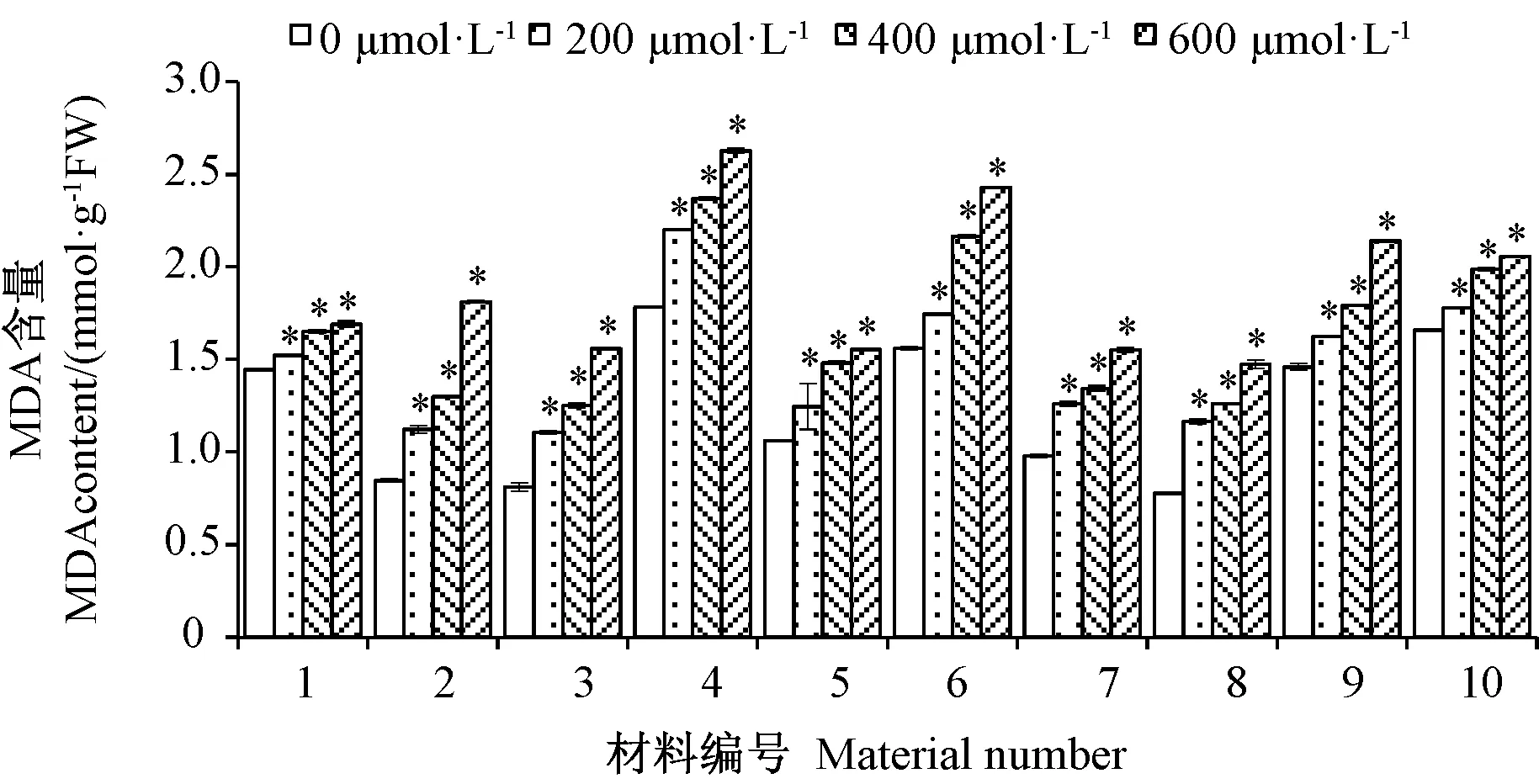
图3 Cd胁迫对早熟禾材料MDA含量的影响Fig.3 Effect of different concentrations of Cd on the contents of MDA of Kentucky bluegrass
3 讨论
3.1 Cd胁迫对早熟禾幼苗生长指标和光合色素的影响
研究表明,当Cd浓度超过植物的耐受水平时,植物生长会受到严重抑制,表现出植株矮小、叶片失绿、根系死亡、地上地下生物量减小等症状,直观反映出植物受到Cd胁迫后的毒害程度[19-20]。杨丽等[14]研究表明,高浓度的Cd对披碱草的地上生物量、叶片相对含水量等指标有显著的抑制作用,这与本研究结果一致。高浓度的重金属胁迫会抑制细胞叶绿素合成酶的活性,同时通过增加叶绿素酶的活性,加速植物体内叶绿素的分解,导致叶绿素含量降低[21]。刘大林等[22]研究发现高浓度的Cd、铅胁迫均会导致草地早熟禾叶绿素含量降低,这与本研究结果相同。
研究发现过量的重金属Cd会抑制草地早熟禾的生长和发育、干扰细胞的正常代谢过程,并引起一系列的生理变化[21]。本研究利用与逆境胁迫相关的干物质含量、叶片相对含水量、叶绿素含量和类胡萝卜素含量4项指标的变化来分析Cd胁迫下草地早熟禾的生长状况。通过计算不同指标与CK相比得到的指标相对值,再根据函数方程计算出耐Cd系数,同时为消除单个指标判断的片面性,运用模糊隶属函数平均(D值)法进行抗Cd性的综合评价,使各参试材料的耐Cd性差异更具可比性,初步筛选出10号材料午夜为耐Cd品种,8号材料橄榄球2号为Cd敏感材料。
3.2 Cd胁迫早熟禾幼苗质膜过氧化和细胞渗透调节物质的影响
植物器官在逆境条件下会发生脂膜过氧化作用。MDA是脂膜过氧化作用的最终产物,是反映植物在逆境胁迫下膜系统受害的重要指标,其含量越高说明细胞膜受到的伤害程度越严重[23]。本研究中,10号材料MDA含量的升高并不显著,600 μmol·L-1Cd处理下,MDA含量的增幅仍在24.0%以下;不同浓度Cd胁迫下,8号材料MDA含量均呈明显的上升趋势,400和600 μmol·L-1Cd处理下分别达到62.6%和80.7%,且与其他材料差异显著。表明10号材料表现出较好的抗Cd性,而8号材料对Cd则比较敏感。
植物体内有多种渗透调节类物质,如脯氨酸、可溶性糖、甜菜碱等,这些细胞渗透调节物质对维持细胞平衡起着非常重要的作用[24]。脯氨酸是植物蛋白质的组分之一,以游离状态广泛存在于植物体中,在逆境条件下,植物体内脯氨酸含量会显著增加,当伤害达到一定程度时,可能导致植株脯氨酸含量下降或植株死亡,因此脯氨酸含量的变化可反映植物的抗逆性[25]。本研究结果表明,Cd胁迫下,各参试材料的脯氨酸含量与CK相比均呈下降趋势,且材料间差异显著,这可能是由于试验设计的最低Cd浓度已经超出植物承受范围所造成的。其中,10号材料的脯氨酸含量下降趋势平缓,与其他材料相比表现出较好的适应性;而8号材料在不同Cd浓度处理下的脯氨酸含量均有所下降,且降幅较大,说明其细胞膜受伤害程度较其他材料严重,对Cd抗性较差。
3.3 Cd胁迫对早熟禾幼苗抗氧化酶活性的影响
逆境胁迫下,植物体内会诱导产生活性氧(reactive oxygen species,ROS)造成不同程度的植物氧化伤害[26-27]。SOD、CAT、POD是植物清除体内过量的超氧阴离子自由基和过氧化氢的重要酶类,也是植物适应逆境胁迫的植物保护酶系统[28-29]。研究发现随着Cd浓度的增加,植物体内的SOD、POD和CAT活性会明显增加。吴旭红等[30]研究苜蓿(Medicago sativaL.)幼苗耐Cd性,发现随着Cd浓度的增加和处理时间的延长,SOD和POD活性均呈先升高后降低的趋势。陈宏等[31]研究小麦(Triticum aestivumL.)幼苗时发现,高浓度的Cd胁迫下,植株体内SOD和POD活性均呈下降趋势,这与本研究结果一致。说明植物对Cd的毒性效应调控存在一定浓度阈值[32-33],调控能力随着Cd浓度的升高而减弱,低浓度的Cd刺激草地早熟禾的抗氧化酶活性增强,这可能与植物自我保护机制[34]有关。本研究中,在一定浓度的Cd处理下,草地早熟禾能够更好地调节体内抗氧化酶活性来抵御Cd伤害,而当浓度超过植物自身调控阈值,酶活性就会表现出下降趋势。
3.4 早熟禾材料对Cd的积累能力
本研究发现10种草地早熟禾的地上部和根系积累了大量Cd。研究表明,200 mg·kg-1Cd处理下,超积累植物龙葵(Solanum nigrum)地上部分和根系的Cd浓度分别达到57.2和41.9 mg·kg-1DW[35];Cd积累植物锦葵(Malva sinensis)地上部和根系的Cd浓度分别达到154.3和92.2 mg·kg-1DW[36];Cd积累植物蒲公英(Taraxacum mongolicum)在 100 mg·kg-1Cd处理下其根系和地上部Cd浓度分别达到157.4和167.2 mg·kg-1DW[37]。本研究中,10份草地早熟禾材料地上部分和根系Cd浓度随着处理浓度的增加而增加,在相同Cd浓度处理下,地上部Cd浓度最高的是10号材料,5号和7号次之,8号和9号较低。根系Cd浓度最高是10号材料。 400 μmol·L-1Cd 处理下,10 号、5号和7号材料的地上部和根系Cd浓度分别达到2 115.6 和1 399.2、1 992.7 和1 300.8、1 570.9和998.7 μmol·L-1。表明10份早熟禾材料中10号、5号和7号材料地上部和根系对Cd有较强的积累能力。
4 结论
随着Cd处理浓度的升高,10份参试材料苗期干物质含量、叶片相对含水量和叶绿素含量等指标与对照相比均呈显著下降趋势;综合评价筛选出耐Cd材料为10号午夜,Cd胁迫下10号材料的抗氧化酶活性和脯氨酸含量均高于其他材料,而MDA含量均低于其他材料,表现出较高的耐Cd性;相同Cd浓度处理下,10号材料地上部和根系Cd浓度最高,表现出较高的Cd积累能力。本研究结果为草地早熟禾在重金属植物修复方面的应用提供了理论依据。
