荆芥幼苗对盐胁迫的生理响应
2019-01-09赵永娟黄丽瑾唐楠煜唐晓清王康才
周 莹 赵永娟 黄丽瑾 唐楠煜 唐晓清 王康才
(南京农业大学园艺学院,江苏南京 210095)
土壤盐渍化是严重制约全球农业生产的非生物胁迫因素之一[1]。据联合国粮食和农业组织(the United Nations Food and Agriculture Organization,FAO)统计,全球有超过8亿hm2土地不同程度的受到盐渍化的危害[2]。我国有超过3 000万hm2土地属于盐碱地[3]。此外,不合理的轮作、施肥和灌溉等加剧了土壤的次生盐渍化。由于Na+和Cl-是土壤中所占比例较高的2种主要盐分,因此植物耐盐研究也主要集中在抗Na+和Cl-方面。盐胁迫下,植物首先受到的直接危害是渗透胁迫,且持续存在,表现为高浓度的Na+引起的土壤水势下降,导致植物吸水困难,甚至还会引起植物组织内的水分外渗而发生脱水,导致植物生理干旱,抑制植物的生长。其次是离子失调导致的毒害和营养元素的亏缺,即大量的Na+竞争取代植物生长所必需的K+、破坏细胞内 Ca2+平衡,抑制植物对养分的吸收。最后,植物受到氧化胁迫即细胞膜透性发生改变,生理生化代谢出现紊乱和有毒物质积累,最终导致植物的生长发育被抑制甚至伤害致死[4]。
荆芥(Schizonepeta tenuifolia Briq.)为唇形科裂叶荆芥属植物,以全草或花穗入药,是传统中药材,可用于治疗感冒、头痛、麻疹等[5],在中国、日本、韩国等国家被广泛使用,也是多种中成药的重要原料。此外,荆芥还可食用、驱蚊[6]、杀虫[7]等,具有重要的药用和经济价值。目前,临床上应用的荆芥多来源于人工栽培,在我国大部分地区均有种植。然而,作为荆芥主产区的东北和华北地区,土壤盐渍化问题较为突出。因此开展荆芥的盐胁迫相关研究,对药用植物荆芥的规范化栽培和抗逆驯化研究具有重要意义。本研究采用盆栽砂培试验,研究不同浓度NaCl胁迫下荆芥幼苗生长、质膜稳定性、渗透调节物质含量和离子吸收与分配,明确荆芥对盐胁迫的生理响应特征,以期为深入探讨盐胁迫对荆芥的影响奠定理论基础。
1 材料与方法
1.1 试验材料
供试种子购自河北安国鑫诚中药材种业,经南京农业大学园艺学院王康才教授鉴定为唇形科荆芥(Schizonepeta tenuifolia.Briq)的种子。
1.2 试验方法
1.2.1 植物材料的培养 选取籽粒饱满、大小均匀的荆芥种子,播于装有栽培基质∶蛭石∶珍珠岩1∶2∶1(v∶v∶v)的盆钵中,置于日光温室内发芽,浇蒸馏水保持湿润。出苗后用1/4 Hoagland营养液浇灌培养。出苗37 d后,选取长势一致(高约15 cm)的幼苗,转入装有石英砂的小盆(上口径9.0 cm,下口径6.0 cm,高7.5 cm)中,每盆定苗2株,每个处理35盆。每盆隔2 d浇灌一次1/2 Hoagland营养液,每次200 mL,浇灌3次后进行胁迫处理。
1.2.2 NaCl胁迫处理 分别用含有 0(CK)、25、50、75和100 mmol·L-1NaCl的1/2 Hoagland营养液每天浇灌1次,浇灌量是石英砂基本持水量的4倍,以将前期的积余盐冲洗干净,保持NaCl浓度稳定。为避免盐冲击效应,采用渐进式进行NaCl处理,除对照组(CK)外,NaCl浓度每隔2 d以25 mmol·L-1递增,在同一时间达到不同处理浓度。胁迫处理12 d后进行各项指标分析测定。荆芥整个培养过程均在日光温室内进行,温度15~30℃,空气相对湿度60%~80%。
1.3 测定指标与方法
1.3.1 盐害指数的计算 观察各处理植株的生长情况,按照盐害分级标准进行分级,盐害分级标准为0级:叶片伸展,生长正常;1级:少量叶片边缘干枯或黄化;2级:50%叶片及少量茎段干枯或黄化;3级:80%以上叶片黄化,50%以上茎段干枯;4级:完全死亡。然后参照秦红艳等[8]的方法略作修改,计算盐害指数:

1.3.2 生长指标的测定 各处理随机选取15株荆芥幼苗,分别测定其处理前后的株高,按照公式计算株高增加速率(cm·d-1):

测量株高后将植株洗净,50℃烘干至恒重,然后分别测定地上部和根的干重。随机选取各处理平整舒展且完整的荆芥叶片,利用 Image J软件(National Institutes of Health,美国)测量叶片单面面积,每个处理重复5次,按照公式计算比叶面积(specific leaf area,SLA):
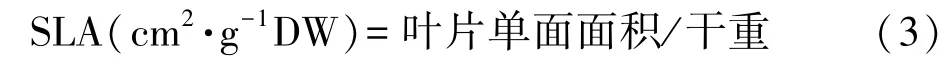
1.3.3 叶绿素含量的测定 用95%乙醇于黑暗环境中冷浸提取叶绿素,采用分光光度法测定叶绿素含量,各处理每次随机称取5株中部的叶片0.2 g,每个处理重复5次[9]。
1.3.4 可溶性糖、脯氨酸和可溶性蛋白含量的测定 参照王学奎[9]的方法,称取荆芥幼苗相同部位的叶片0.1 g,采用蒽酮比色法分别测定可溶性糖和脯氨酸含量;称取叶片0.5 g,分别采用磺基水杨酸法和考马斯亮蓝G-250法测定可溶性蛋白含量。试验均重复3次。
1.3.5 Na+、K+和 Ca2+含量的测定 植株根、茎、叶样品(50℃)烘干粉碎研磨后,过0.59 mm筛。准确称取样品粉末0.100 0 g置于内插管,加入2 mL硝酸,轻摇使混合均匀,盖好内插管盖放入微波消解炉中消解30 min,冷却后开罐,用去离子水将消解液定容至25 mL,混匀后备用。利用Optimal 2100DV电感耦合等离子体发射光谱仪(美国PerKinElmer公司)测定荆芥不同部位 Na+、K+和 Ca2+的含量,测定条件为射频功率1 300 W,辅助气流量0.2 L·min-1,等离子体气流量15 L·min-1,积分时间90 s。试验重复3次。
1.3.6 丙二醛和电解质渗透率的测定 称取荆芥幼苗相同部位叶片 0.5 g,采用硫代巴比妥酸(thiobarbituric acid,TBA)法[10]测定丙二醛(malondialdehyde,MDA)含量。同上,称取叶片 0.1 g,参照 Tuna等[11]的方法测定电解质渗漏率(electrolyte leakage percentage,ELP)。试验均重复3次。
1.3.7 保护酶活性的测定 称取荆芥幼苗相同部位的叶片0.5 g,利用相应的试剂盒(南京建成生物工程研究所)分别测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)的活性。试验均重复3次。
1.4 数据处理及分析
利用SPSS 19.0软件进行数据处理及分析;Origin 9.0软件作图;采用Duncan法进行处理间的差异显著性比较。
2 结果与分析
2.1 盐胁迫下荆芥幼苗的盐害指数
由图1可知,0、25 mmol·L-1NaCl处理下,荆芥幼苗均没有受到盐害胁迫,50~100 mmol·L-1NaCl处理下,荆芥幼苗受盐胁迫影响明显,其中100 mmol·L-1NaCl处理下荆芥幼苗盐害指数最高,为69.27%。试验中可观察到0、25 mmol·L-1NaCl处理下荆芥幼苗叶片伸展,生长正常;50 mmol·L-1NaCl处理下荆芥幼苗少量叶片边缘干枯或黄化;75 mmol·L-1NaCl处理下荆芥幼苗大量叶片及部分茎段干枯或黄化;100 mmol·L-1NaCl处理下荆芥幼苗大量叶片及茎段干枯,甚至有些植株完全死亡。结果表明,荆芥幼苗能在短时间内耐受低浓度的NaCl胁迫,但随着NaCl浓度的升高,盐害逐渐加重。
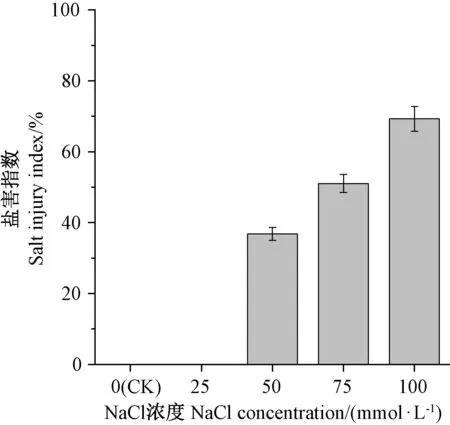
图1 盐胁迫下荆芥幼苗的盐害指数Fig.1 Salt injury index of S.tenuifolia seedlings under salt stress
2.2 盐胁迫对荆芥幼苗株高增加速率、单株干重和比叶面积的影响
由表1可知,随着NaCl处理浓度的增加,荆芥幼苗的株高增加速率均呈显著下降趋势(P<0.05),分别是 CK的 67.31%、62.50%、40.38%和 27.88%。25 mmol·L-1NaCl处理下,单株地上部干重与CK间差异不显著(P>0.05),而其单株根干重较CK显著增加。50~100 mmol·L-1NaCl处理下,单株地上部干重和根干重均显著下降。随着NaCl胁迫程度的增加,荆芥幼苗比叶面积呈下降趋势,但25、50 mmol·L-1NaCl处理下,比叶面积与CK相比差异均不显著(P>0.05);而75、100 mmol·L-1NaCl处理下,比叶面积均显著减少,分别是CK的69.52%和51.28%。
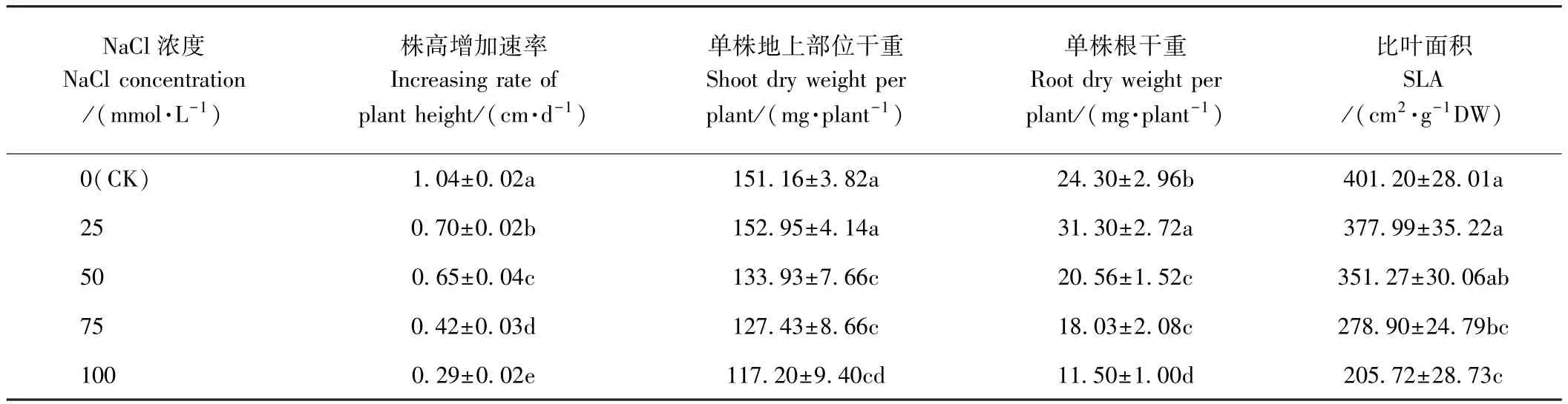
表1 盐胁迫对荆芥幼苗株高增加速率、单株干重和比叶面积的影响Table1 Effect of salt stress on the increasing rate of plant height,dry weight and SLA of S.tenuifolia seedlings
2.3 盐胁迫对荆芥叶片中叶绿素含量的影响
由表2可知,随着NaCl浓度的增大,荆芥叶片中叶绿素a、叶绿素b含量均呈先增加后降低的趋势,且均在25 mmol·L-1NaCl处理下达到最大,分别是 CK的1.23倍和1.33倍。50 mmol·L-1NaCl处理组荆芥叶片中的叶绿素a和叶绿素b含量与CK相比,均差异不显著。而75和100 mmol·L-1NaCl处理下,荆芥叶片中叶绿素a、叶绿素b含量均显著低于CK(P<0.05),分别是CK的0.83倍、0.62倍和0.90倍、0.74倍。总叶绿素含量变化趋势与叶绿素a和叶绿素b相同。
2.4 盐胁迫对荆芥幼苗叶片MDA含量和电解质渗漏率的影响
由图2-A可知,随着NaCl浓度的增加,荆芥幼苗叶片中MDA含量显著增加,分别是CK的1.97、4.42、5.89、7.38倍。由图2-B可知,与 CK相比,25~75 mmol·L-1NaCl处理下的叶片电解质渗漏率均显著升高,且在75 mmol·L-1NaCl处理下达到最大,是CK的8.17倍;100 mmol·L-1NaCl处理下的叶片电解质渗漏率与75 mmol·L-1NaCl处理组相比,虽略有下降,但差异不显著。
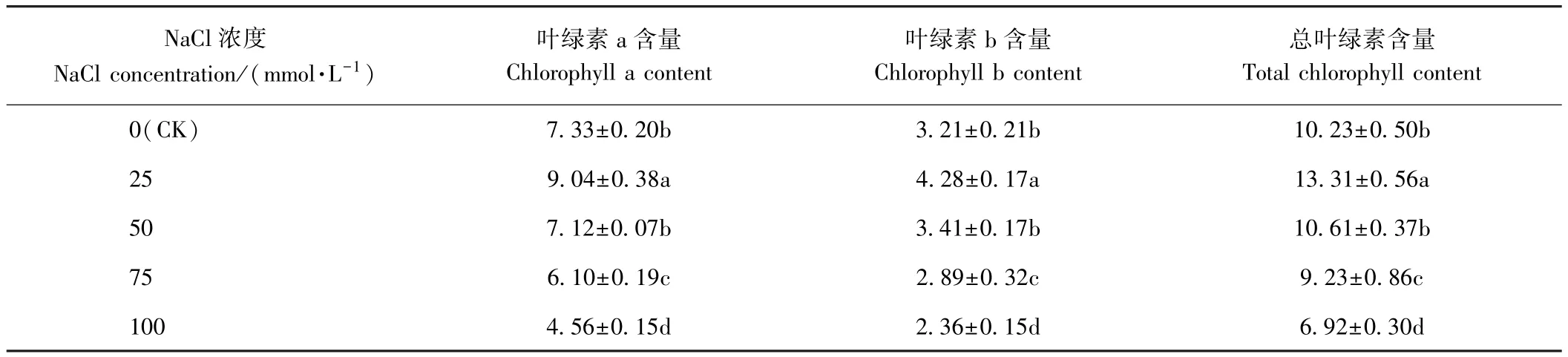
表2 盐胁迫对荆芥叶片中叶绿素含量的影响Table2 Effect of salt stress on the chlorophyll content of S.tenuifolia leaves /(mg·mg-1)
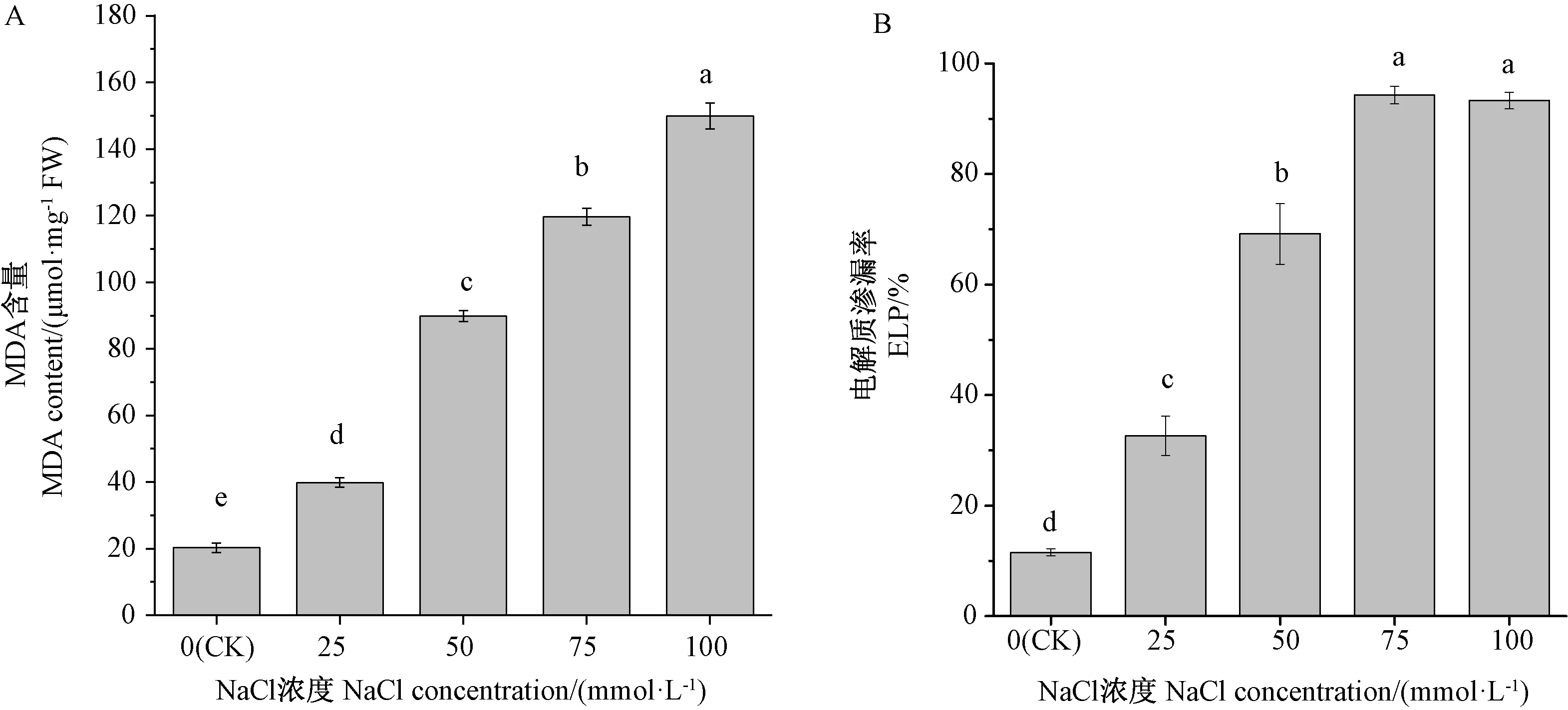
图2 盐胁迫对荆芥幼苗叶片MDA含量和电解质渗漏率的影响Fig.2 Effect of salt stress on MDA content and ELP of S.tenuifolia leaves
2.5 盐胁迫对荆芥幼苗叶片中渗透调节物质含量的影响
由表3可知,荆芥幼苗叶片中可溶性糖含量随着NaCl浓度的增加而增加,其中25 mmol·L-1NaCl处理下叶片中可溶性糖含量与CK相比差异不显著;50~100 mmol·L-1NaCl处理下,荆芥幼苗叶片中可溶性糖含量均显著增加(P<0.05),分别是CK的1.08、1.60、1.79倍。25 mmol·L-1NaCl处理下,荆芥幼苗叶片中脯氨酸含量与CK相比略有下降,但差异不显著(P>0.05);50~100 mmol·L-1NaCl处理下,叶片中脯氨酸含量均呈先增加后降低的趋势,分别是CK的1.76、4.93、4.12倍。荆芥幼苗叶片中可溶性蛋白含量在0~100 mmol·L-1NaCl处理下呈先增加后降低的趋势。在50 mmol·L-1NaCl处理下达到最大,是CK的2.23倍;75和100 mmol·L-1NaCl处理下的叶片可溶性蛋白含量与50 mmol·L-1NaCl处理相比,均显著降低,分别是其 0.75、0.40 倍,其中 100 mmol·L-1NaCl处理与CK相比无显著性差异(P>0.05)。

表3 盐胁迫对荆芥叶片中渗透调节物质含量的影响Table3 Effects of salt stress on the content of osmoregulation substances in S.tenuifolia leaves/(mg·mg-1)
2.6 盐胁迫对荆芥叶片中抗氧化酶活性的影响
由图3可知,随着NaCl浓度的增加,荆芥叶片中SOD、CAT活性均呈先上升后下降的趋势,POD活性则呈逐渐下降趋势。SOD和 CAT活性均在25 mmol·L-1NaCl处理下达到最高,分别是CK的1.95和2.69倍。50 mmol·L-1NaCl处理下的SOD活性与CK 差异不显著,75、100 mmol·L-1NaCl处理组SOD 活性相比CK分别下降了32.96%和62.69%。50和75 mmol·L-1NaCl处理组间的CAT活性差异不显著,但75和100 mmol·L-1NaCl处理组间的CAT活性差异显著。 25~100 mmol·L-1NaCl处理下,POD 活性呈显著降低趋势,与 CK相比分别降低 15.18%、54.25%、69.32%、88.19%。

图3 盐胁迫对荆芥叶片中抗氧化酶活性的影响Fig.3 Effect of salt stress on the activity of antioxidant enzymes in S.tenuifolia leaves
2.7 盐胁迫对荆芥植株离子吸收与分配的影响
由表4可知,NaCl胁迫促进了荆芥植株内Na+的积累。NaCl胁迫处理下,根和叶中Na+含量均随着胁迫程度的增加而显著增加,100 mmol·L-1NaCl处理下二者的 Na+含量分别是CK的8.3和13.0倍,茎中Na+含量在 NaCl胁迫下也显著增加,其中 100 mmol·L-1NaCl处理组与 75 mmol·L-1NaCl处理组间差异不显著,分别为CK的8.5倍和9.0倍。
NaCl胁迫下,荆芥的根、茎中K+含量均呈降低趋势。不同浓度NaCl处理下(除75 mmol·L-1NaCl处理组外),叶中K+含量均呈下降趋势。各NaCl处理下,根中K+含量均较CK显著减少,其中75 mmol·L-1NaCl处理组与50 mmol·L-1NaCl处理组间差异不显著,100 mmol·L-1NaCl处理组较 75 mmol·L-1NaCl处理组显著降低35.00%。 茎中K+含量在25、50 mmol·L-1NaCl处理下均降低但差异不显著,但在75、100 mmol·L-1NaCl处理下均显著降低,较CK分别降低13.95%、23.26%。叶中K+含量在各NaCl处理下均显著降低,其中75 mmol·L-1NaCl处理下,叶中 K+含量有增加的趋势,较50 mmol·L-1NaCl处理组增加 10.34%,100 mmol·L-1NaCl处理下,叶中 K+含量再次减少,较 75 mmol·L-1NaCl处理组显著降低13.79%。
NaCl胁迫下,荆芥植株各部位Ca2+含量变化趋势与 K+基本一致。 根中 Ca2+含量在 25、50 mmol·L-1NaCl处理下与 CK 差异均不显著,75、100 mmol·L-1NaCl处理组较CK分别显著降低25.00%和33.33%,但二者间差异不显著。各NaCl处理下,茎中Ca2+含量均较 CK显著降低,分别降低 12.50%、12.50%、25.00%和 33.33%。25 mmol·L-1NaCl处理组除与100 mmol·L-1处理间的叶片 Ca2+含量差异显著,与其他处理间差异均不显著,且100 mmol·L-1NaCl处理组较CK显著降低29.27%。结果表明,盐胁迫下Na+与K+主要集中在地上部分;Ca2+在根和茎中含量相近且略低于叶。
2.8 盐胁迫对荆芥植株 K+/Na+和 Ca2+/Na+的影响
由表5可知,随着NaCl浓度的增加,荆芥植株根、茎、叶中的 K+/Na+均呈显著下降趋势。 100 mmol·L-1NaCl处理下,荆芥植株根、茎、叶中的K+/Na+值均为最低,分别较CK下降97.06%、89.85%和93.74%,但根和叶中与50、75 mmol·L-1NaCl处理组差异均不显著。
与 K+/Na+变化趋势相似,根、茎、叶的 Ca2+/Na+值也随着NaCl浓度的增加均呈下降趋势。25 mmol·L-1NaCl处理下,根、茎、叶的Ca2+/Na+值较CK 显著降低,分别为CK的15.16%、42.39%和25.05%。50 mmol·L-1NaCl处理组与25 mmol·L-1NaCl处理组相比,根中 Ca2+/Na+值差异不显著,茎、叶中 Ca2+/Na+值分别显著降低64.09%、47.76%。 75 mmol·L-1NaCl处理组与 50mmol·L-1NaCl处理组相比,根、茎中 Ca2+/Na+值分别显著降低38.00%和34.18%,叶中Ca2+/Na+值则差异不显著。100 mmol·L-1NaCl处理组与75 mmol·L-1NaCl处理组相比,根、茎、叶中 Ca2+/Na+值均差异不显著。 100 mmol·L-1NaCl处理下,K+/Na+值在根中最小,茎中最大;Ca2+/Na+值则在根中最大,茎中最小。
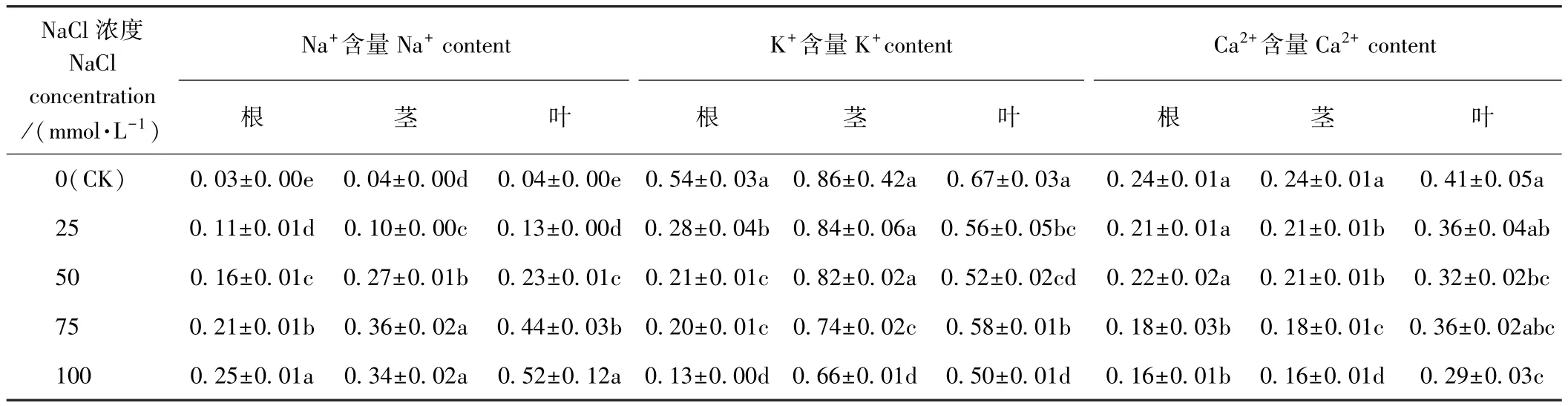
表4 盐胁迫对荆芥植株离子吸收与分配的影响Table4 Effect of salt stress on ion uptake and distribution in S.tenuifolia /(mmol·g-1DW)
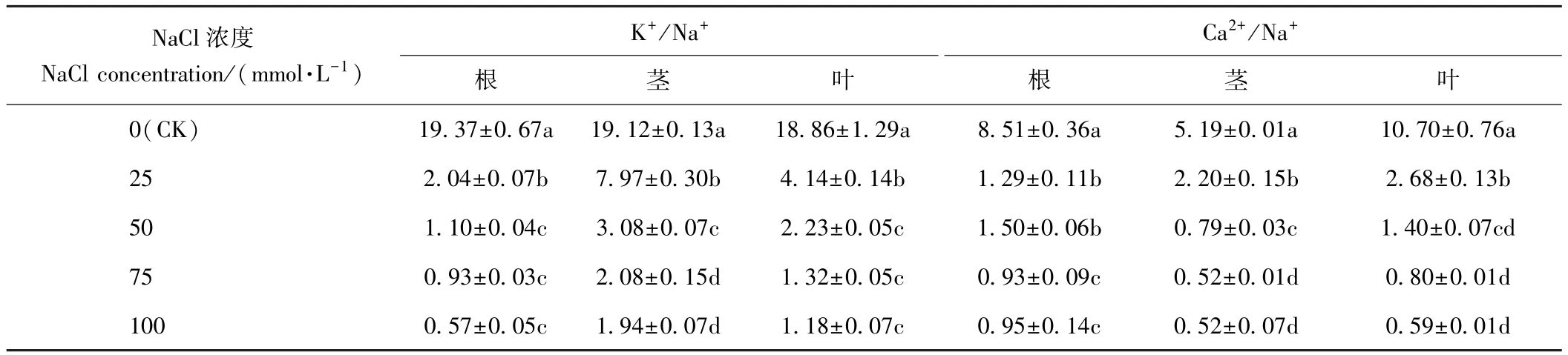
表5 盐胁迫对荆芥植株 K+/Na+和 Ca2+/Na+的影响Table5 Effect of salt stress on K+/Na+and Ca2+/Na+of S.tenuifolia
3 讨论
3.1 盐胁迫对荆芥生长的影响
本研究表明,随着盐胁迫程度的加剧,荆芥幼苗株高增加速率持续降低。盐处理浓度≥50 mmol·L-1时,植株干重明显减少。盐处理浓度为25 mmol·L-1时,植株干重尤其是根干重显著增加,说明荆芥幼苗根系对低盐胁迫具有一定的耐受性,其通过扩大生长量以平衡盐胁迫对根系吸收功能的损伤,维持地上部的正常生长[12]。SLA表示植物单位叶干质量的光截获面积,可以反映植物对资源获取和利用情况[13]。SLA减小表明植物的生产力下降,但在逆境中的适应性更强[14]。本研究中,随着盐胁迫程度的加深,荆芥幼苗SLA逐渐减小,说明荆芥叶片变厚,叶片内部水分传导距离增加,降低了植物体内水分的散失,使得蒸腾速率降低,水分利用效率上升[15]。进一步分析发现,SLA的降低导致植株获取光能的能力减弱,使得碳同化物减少,进而反馈抑制荆芥叶片的生长[16]。本研究中,轻度盐胁迫(25 mmol·L-1NaCl)处理下荆芥幼苗的叶绿素含量显著增加,随着盐浓度的增加,叶绿素含量呈下降趋势。研究表明,低浓度NaCl可以使叶绿素的含量增加[17-18]。而高浓度NaCl胁迫下,荆芥叶片的叶绿素含量降低,推测可能是叶片中的离子含量升高,导致色素与色素蛋白之间的结合能力降低,类囊体膜超微结构被破坏,使叶绿体解体,叶绿素降解[19]。
3.2 盐胁迫对荆芥质膜稳定性的影响
本研究中,荆芥幼苗叶片中MDA与电解质渗漏率均随着NaCl浓度的升高而显著增加。研究表明,膜系统,尤其是细胞膜,是盐胁迫对植物伤害的最敏感部位和原初位点[20]。植物在盐胁迫下产生的大量活性氧自由基会引起植物的膜脂过氧化,表现为膜脂过氧化产物MDA含量增加[21]和质膜通透性增强,即胞内电解质外渗[22],质膜稳定性下降。这与本研究结果基本相同。本研究结果表明,高浓度NaCl胁迫严重损害了荆芥幼苗的质膜,导致其代谢发生紊乱,发生叶片、茎干枯甚至植株的死亡。
3.3 盐胁迫对荆芥渗透调节的影响
渗透调节是植物在逆境胁迫下的一种自我调整与适应。盐胁迫下,由于外界渗透势较低,植物细胞发生水分亏缺现象。因此植物会积累一些可溶性的渗透调节物质在细胞内部以降低胞内渗透势,使其在盐逆境下仍能吸收水分[23]。脯氨酸、可溶性蛋白和可溶性糖是植物体内重要的渗透调节物质。本研究结果表明,随着盐胁迫程度的加深,荆芥幼苗叶片中的可溶性蛋白和脯氨酸含量均呈先增加后降低的趋势,分别在50 mmol·L-1和 75 mmol·L-1NaCl处理下达到最高,这是由于盐胁迫下荆芥通过刺激体内脯氨酸的积累,并诱导产生大量蛋白质以提高自身抵抗盐胁迫的能力,然而高浓度的盐胁迫超过了荆芥自身的耐受极限,导致可溶性蛋白和脯氨酸的合成受阻,含量下降。这与王雨等[24]的研究结果类似。不同的是,随着盐胁迫的加深,荆芥幼苗叶片中可溶性糖的含量呈不断上升趋势,且在100 mmol·L-1NaCl处理组达到最高,这是由于在高盐胁迫下,当可溶性蛋白和脯氨酸合成受阻时,可溶性糖起主要的渗透调节作用。
3.4 盐胁迫对荆芥抗氧化酶系统的影响
盐胁迫会导致植物细胞中线粒体和叶绿体电子传递的泄漏加剧[25],引起活性氧(reactive oxygen species,ROS)的大量积累,对脂质、蛋白质、核酸造成氧化损伤[26]。由SOD、CAT、POD等构成的抗氧化酶系统是植物遭受环境胁迫时重要的防御体系,在ROS清除过程中发挥重要作用[27]。荆芥幼苗叶片中SOD、CAT活性均随着NaCl浓度的升高呈先增加后降低的趋势,在25 mmol·L-1NaCl时二者活性皆达到最大值。这是由于低盐浓度可诱导SOD、CAT活性增强,能有效清除植株体内的ROS,减少氧化伤害,从而维持荆芥的生长;而当NaCl处理浓度高于50 mmol·L-1时,活性氧自由基积累过多,膜脂过氧化作用加剧,细胞膜的稳定性被破坏,SOD、CAT活性受到抑制[28]。本研究中,POD活性呈逐渐下降趋势,这与盐胁迫下红麻[29]、沙冬青[30]和沙棘幼苗[31]叶片中POD活性的变化趋势均不同,说明POD在荆芥体内对盐胁迫极为敏感,耐受阈值低[32]。由此推测,荆芥幼苗抗盐胁迫的酶促机制可能是SOD和CAT起主要作用,也可能是由于SOD、POD、CAT三者不能协调一致完成活性氧的清除,导致荆芥幼苗抗氧化能力减弱,从而引发一系列活性氧损伤[33]。
3.5 盐胁迫对荆芥离子吸收和分配的影响
随着盐胁迫程度的加深,Na+在荆芥植株各部位不断积累,最终Na+含量表现为叶>茎>根。地上部分Na+含量高于根部,说明根系吸收Na+后没有被截留,而是较多地运往地上部积累于茎和叶,尤其是叶中,这样可以降低叶片渗透势,促进水分向地上部位运输,从而缓解盐胁迫造成的生理干旱[34-35]。但Na+在叶片中的过量积累会抑制荆芥植株的生长发育,造成离子毒害[36],这也是高盐胁迫下荆芥叶片和茎干枯,甚至植株死亡的原因。
K+作为高等植物体内质量分数最高的阳离子,在调控离子平衡、细胞膨压、渗透调节、光合作用和蛋白质合成等方面发挥着重要作用[37]。Na+与K+有相似的离子半径和水合能,二者存在明显的拮抗效应[38]。因此荆芥植株对Na+的大量吸收会抑制其对K+的吸收,导致各部位K+和K+/Na+随着盐胁迫的增强而显著降低,以根部的下降幅度最大,这与宁建凤等[39]的研究结果一致。研究表明,盐胁迫下维持植株体内合理的K+/Na+是植物耐盐的重要原因,也是衡量植物耐盐性的重要指标[40],其比值越低,表明K+受Na+的抑制越明显,植株受盐害越严重[41],荆芥盐害指数的上升也验证了这一点。
Ca2+是植物生长所必需的营养元素,也是偶联胞外信号与胞内生理反应的第二信使,能维持细胞壁、细胞膜以及膜蛋白的稳定,对植物适应逆境条件起着重要作用[42]。盐胁迫下,植物积累Ca2+有助于细胞维持较低的渗透势,促进根系对水分的吸收[43],尽量降低盐胁迫对植株的伤害。而在本研究中,随着盐浓度的增加,荆芥Ca2+含量呈降低趋势,说明荆芥在NaCl胁迫下不能通过协调Ca2+的吸收转运来缓解盐害,可以推测荆芥Ca2+/Na+的减少可能和Na+的大量积累导致离子含量失衡有关[44];也可能是由于质膜上的Ca2+被高活性的Na+取代[45],导致细胞膜稳定性的降低,大量Na+进入细胞。
前期研究表明,盐胁迫对荆芥幼苗的次生代谢过程也有显著影响[46],其叶片腺毛分泌物中组分的种类以及相对含量在盐胁迫下发生明显变化,主要表现在以胡薄荷酮为主的单萜类物质的减少、酯类物质的增加。轻度盐胁迫(25 mmol·L-1NaCl)下,黄酮和总酚含量均明显增加,与本研究中SOD和CAT变化趋势类似,起协同抗氧化作用。因受自然条件及气候差异的影响,我国北方盐渍化土壤类型较为复杂,除NaCl外,还含有其他氯化物、硫酸盐、碳酸盐等,同时还伴随着土壤的碱化。因此,与25 mmol·L-1NaCl相比,实际生产中的土壤盐渍化问题更为复杂,盐渍土上种植荆芥还有待进一步研究和验证。
4 结论
本研究结果表明,轻度盐胁迫(25 mmol·L-1NaCl)下,荆芥幼苗干物质量和绿素含量增加,叶片内SOD、CAT清除活性氧活力增强,可以抵御盐胁迫造成的伤害,维持植株的正常生长;但随着盐胁迫强度的增加,虽然叶片内渗透调节物质合成被激发,但质膜损害严重,稳定性下降,抗氧化酶活性受到抑制,离子稳态干扰加剧,荆芥生长受到抑制,甚至在高盐(75和100 mmol·L-1NaCl)胁迫下出现植株枯萎死亡。综上,荆芥对盐胁迫极为敏感,但对低浓度的盐胁迫具有一定的耐受性。
