切花菊苗期抗寒性评价及相关的分子标记挖掘
2019-01-09徐婷婷迟天华管志勇房伟民陈发棣
徐婷婷 马 杰 迟天华 叶 丹 管志勇 房伟民 陈发棣 张 飞
(南京农业大学园艺学院,江苏南京 210095)
低温是影响植物地理分布和生长发育的重要环境限制因子之一。对观赏植物而言,低温不仅会影响其生长发育,严重时还会引发冻害,影响花型、花色等观赏性状表达,降低观赏品质和经济效益[1]。菊花(Chrysanthemum morifolium)为菊科菊属多年生宿根花卉,是我国十大传统名花和世界四大切花之一,观赏和经济价值较高,在花卉生产中占有重要的地位。冬季长期低温使菊花品种开花延迟[2],影响成花品质,特别是在切花菊周年生产中,冬季加温增加生产成本、污染环境。因此,迫切需要挖掘利用抗寒基因资源、培育抗寒新品种以解决切花菊冬季高效生产,实现节本增效。
目前,关于菊花抗寒性的研究主要集中在评价体系[3-4]、生理机制[5-7]、优异基因挖掘[8-11]和种质创新[12-15]等方面,而对菊花抗寒性分子标记的相关研究尚鲜见报道。为明确切花菊抗寒性的遗传变异,挖掘优异抗寒基因资源,本研究利用电导率结合Logistic方程评价了83个切花菊品种苗期叶片的低温半致死温度(semi-lethal temperature,LT50),并结合前期报道的分子标记数据[16]通过关联分析挖掘与抗寒性相关的优异等位变异位点,并筛选抗性品种资源,以期为菊花抗寒性的遗传改良提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为83个切花菊品种(表1),均由南京农业大学中国菊花种质资源保存中心提供。于2017年8月初采取插穗进行扦插,8月下旬定植于南京农业大学花卉基地湖熟现代农业示范园,进行常规管理。
1.2 低温处理与相对电导率的测定
参照郭海林等[17]的方法并略加改进,于苗期采集83个切花菊品种的叶片,每个品种15片,采集叶片的位置和大小基本相同,去离子水漂洗3次,再用去离子水浸润的纱布包裹叶片后置于试管内,4℃冷藏过夜[18]。次日利用9610型低温循环仪(Polyscience公司,美国)进行低温处理。低温循环温度梯度分别设置为 3、0、-3、-6 和-9℃,处理时间均为 1 h,匀速降温30 min,每个低温处理结束后,取出试管于4℃冰箱内解冻,低温处理结束后将每个低温处理的叶片分装于试管,加入25 mL去离子水浸泡15 h,利用DDS-307型电导率测定仪(上海雷磁仪器有限公司)测定叶片煮沸前电导率,沸水浴15 min后冷却至室温并测定电导率,按照公式计算各处理的相对电导率(relative electric conductivity,REC):

每处理3次重复,取平均值。
1.3 低温半致死温度
利用相对电导率拟合Logistic回归方程计算低温半致死温度LT50(℃)。回归方程为:
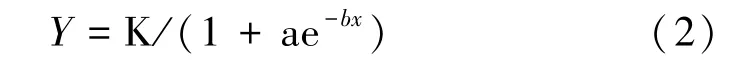
式中,Y:细胞伤害率;x:低温处理温度;K:细胞伤害率的饱和容量;a、b:均为方程参数。将方程进行线性化处理以此确定a,b值,ln[(K-y)/y]=ln(a-bx),令y=ln[(K-y)/y],则转化为细胞伤害率(y)与处理温度(x)的直线方程。参照许瑛等[4]的方法,通过线性化处理和直线回归的方法求出 a、b值及拟合度(R2),半致死温度 LT50=In[(1/a)]/b。采用 SPSS v20软件进行LT50的描述性统计分析和聚类分析。
1.4 切花菊耐寒性与分子标记关联分析
基于Li等[16]报道的707个 SRAP、SSR、SCoT等分子标记数据,利用STRCTURE v2.3.3软件评价83个切花品种进行群体结构(K=2)及各品种的Q值;利用SPAGeDi v1.4软件进行亲缘关系分析,得到亲缘关系系数Kinship矩阵(86.9%品种间亲缘关系系数小于0.1)。在此基础上,利用TASSLE v5.0软件中的混合线性模型(mixed linear model,MLM)进行抗寒性(LT50)与分子标记的关联分析,同时将群体结构分析中得到的各品种的Q值和亲缘关系分析中得到的Kinship矩阵作为协变量计入模型中,若P<0.01则认为标记位点与目标性状有显著关联。基于关联分析得到的显著位点,计算出每个位点等位基因缺失和等位基因存在的LT50均值,用等位基因存在的LT50均值减去等位基因缺失的LT50均值,从而得到每个位点的表型效应值[19-20]。LT50越小,抗寒性越强,并据此判断表型效应值为负值的位点为有利等位变异位点。
2 结果与分析
2.1 Logistic回归模型的建立及LT50的确定
根据供试材料在不同低温处理下的相对电导率得到Logistic曲线、Logistic方程及其拟合度和半致死温度。电解质漏渗率测定结果以切花菊品种Qx151为例(图1),5 个点对应的温度分别为 3、0、-3、-6 和-9℃,REC随着温度的下降而逐渐上升,其中3~-3℃时,随着温度的降低电解质渗出率较快;-3~-6℃时电解质渗出率上升比较缓慢;-6~-9℃时电解质渗出率基本趋于稳定,随着温度的降低,相对电导率的变化呈明显的S型曲线,拐点温度即为半致死温度。由表1可知,所有供试材料模拟Logistic方程的拟合度均达到显著水平,LT50的变化范围为-10.99(Qx-097)~1.86℃(Qx-007)。
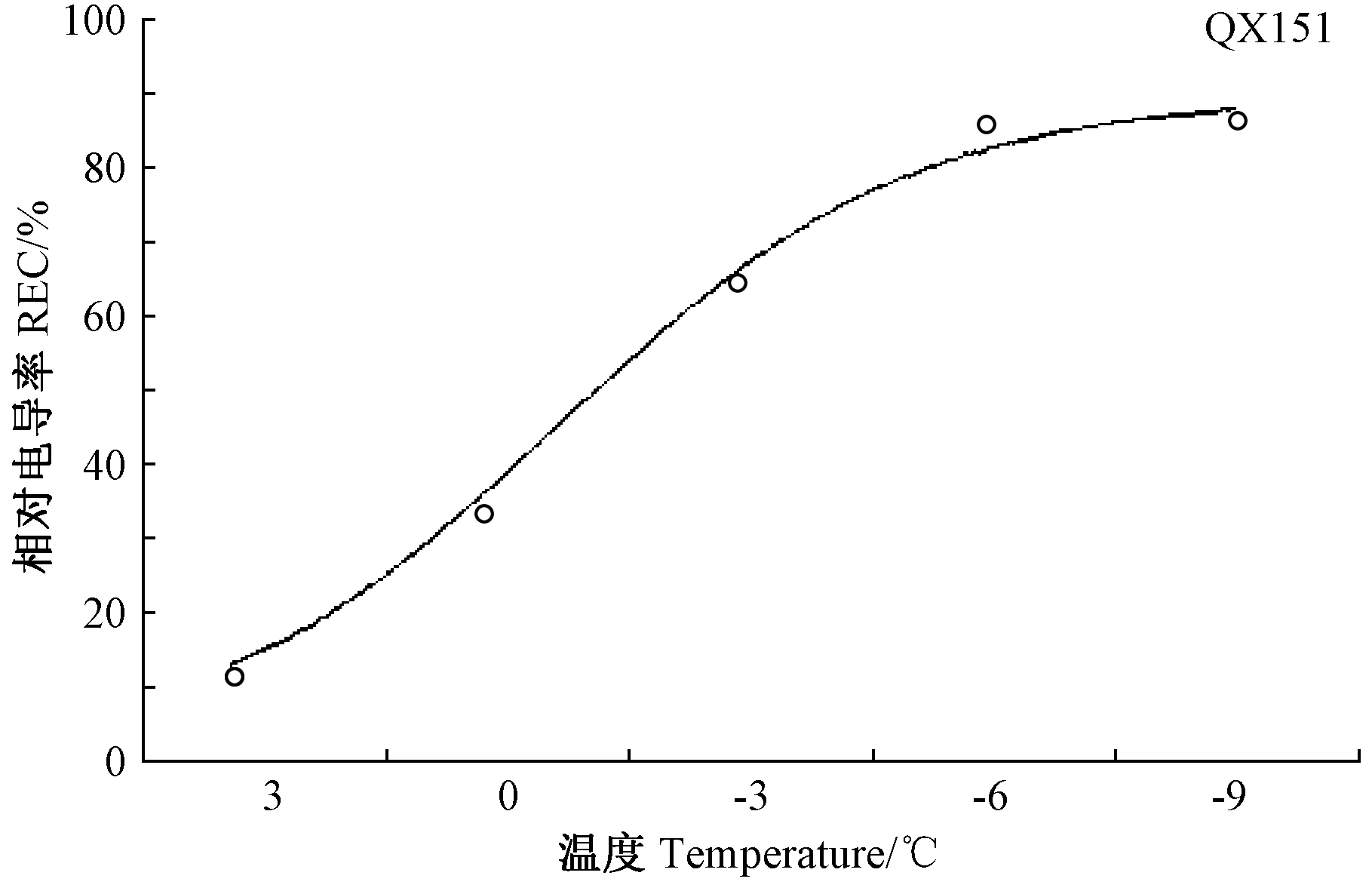
图1 不同低温处理后切花菊Qx151离体叶片电导率拟合Logistic方程曲线Fig.1 Logistic equation based on REC from detached leaves of QX151 after different low temperature treatments

表1 83个切花菊的相对电导率回归方程及低温半致死温度(LT50)Table1 REC logistic equation and LT50of the 83 cut chrysanthemum cultivars
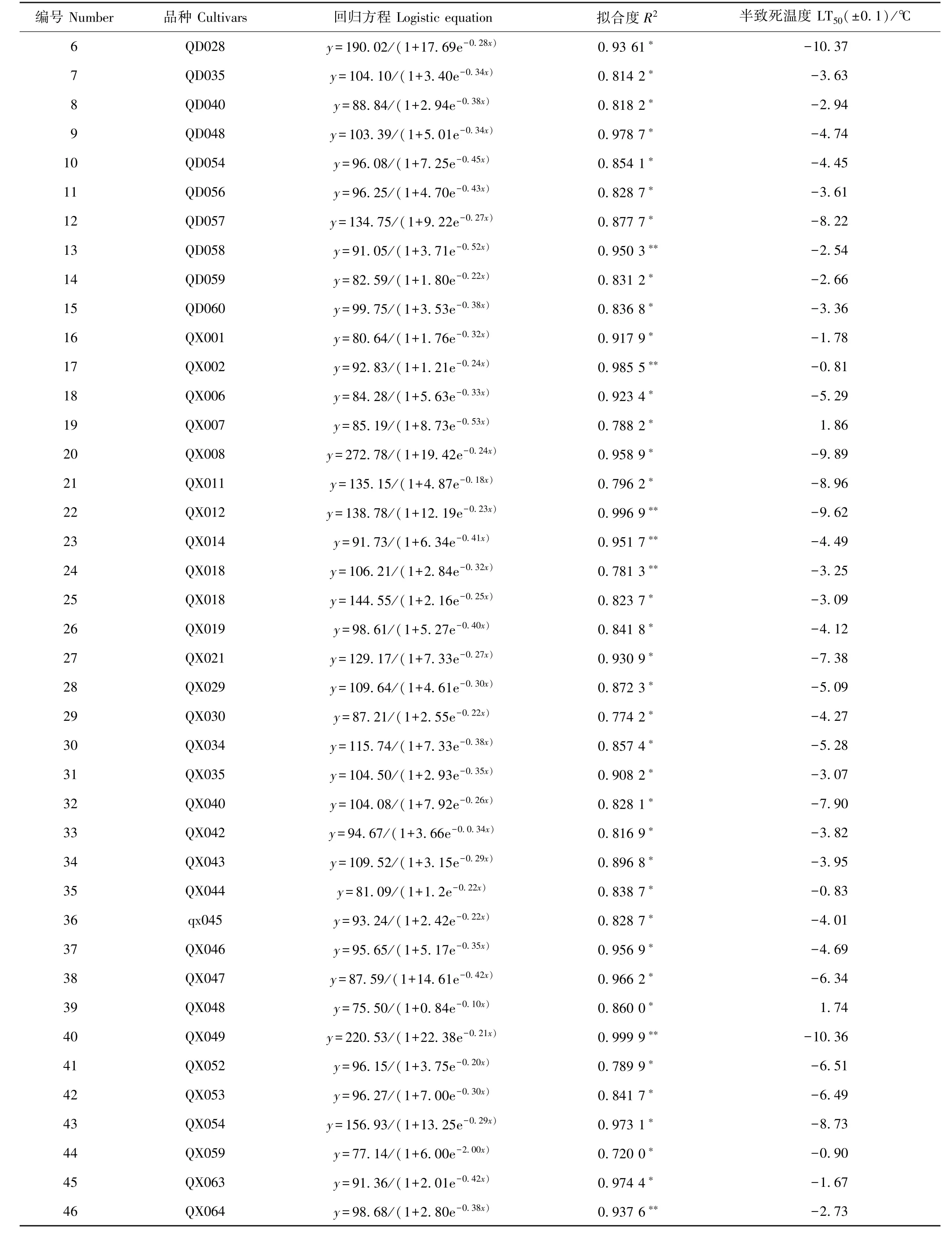
表1(续)

表1(续)
2.2 菊花苗期耐寒性的表型数据
由表2可知,切花菊的 LT50介于-10.99~1.86℃之间,平均值为-4.31℃,变异系数为79.81%,离散程度较大,说明切花菊品种的耐寒性差异较大。LT50在供试材料中的偏度和峰度分别为-0.68和0.91,绝对值均小于1,表明切花菊苗期耐寒性属于多基因控制的数量性状。

表2 83个菊花品种苗期耐寒性(低温半致死温度)的描述性数据Table2 Descriptive statistics for cold tolerance(LT50)of 83 cut chrysanthemum cultivars at seedling stage
2.3 LT50的聚类分析
依据LT50对83个切花菊品种进行聚类分析,由表3可知,83个切花菊品种的抗寒能力分为四类:第一类抗寒型,LT50低于-7.38℃,包括 Ox-011、Ox-114、Ox-054等18个品种,占供试材料的21.67%;第二类中抗寒型,LT50为-6.51~ -4.45℃,包括 Qx-006、Qx-034、QD-005等19个品种,占供试材料的22.89%;第三类低抗寒型,LT50为-4.27~-2.17℃,包括 Ox-030、南农紫唇、Ox-146等27个品种,占供试材料的32.53%;第四类不抗寒型,LT50为-1.78~1.86℃,包括 QD007、南农红霞、南农玉珠等 19个品种,占供试材料的22.89%。

表3 83个切花菊品种的LT50聚类分析结果及抗寒能力Table3 Clustering result of LT50and cold resistance for 83 cut chrysanthemum cultivars
2.4 抗寒性相关的分子标记
基于MLM方法的关联分析共计检测到11个标记位点与品种的耐寒性显著关联(P<0.01),单个关联位点的表型效应值为-3.51~0.83,表型变异解释率为11.37%~18.83%(表4)。 其中,E2M16-1、E2M16-4和E2M16-8的效应值为正,为抗寒性不利位点;其余8个关联位点的效应值为负,为抗寒性有利位点。由8个增效位点的箱线图(图2)可知,仅位点E7M12-13在P<0.01水平显著。结合LT50表型数据,携带该位点且抗寒性较好的品种有南农金柠檬、Qx097、QD028、Qx049、Qx153 和 Qx008。
3 讨论
抗寒性是菊花重要育种目标性状之一,抗寒基因资源的挖掘和利用是开展抗寒育种的重要前提。Dexfer等[21]首次釆用电导法进行植物抗寒性评价,发现植物组织受寒害程度越高电导率越大。由于不同物种之间电解质丰度不同,相对电导率比电导率更能准确的表达组织受伤害的程度[22-23]。细胞电解质渗出率为50%时的温度则为该材料的低温半致死温度,将相对电导率结合Logistic方程回归分析计算LT50已成为评价植物抗寒性的常用方法[24-28]。Kim等[3]通过测定LT50和脚芽生长量鉴定了菊花的抗寒性;许瑛等[4]通过菊花脚芽叶片相对电导率结合LT50评价了菊花在秋冬季不同降温时期的抗寒性;王翠丽等[29]发现菊花叶片亚麻酸/(亚油酸和油酸)比值可作为评价秋菊抗寒性的有效指标,且认为不饱和脂肪酸含量结合LT50可快速鉴定抗寒菊花品种。上述研究表明,LT50是菊花抗寒性鉴定评价的重要参考依据之一。本研究通过LT50评价了83个切花菊品种的抗寒性,发现LT50离散程度较大(变异系数为79.81%),并筛选到部分抗寒品种资源,为后续抗寒育种利用提供了重要亲本材料。
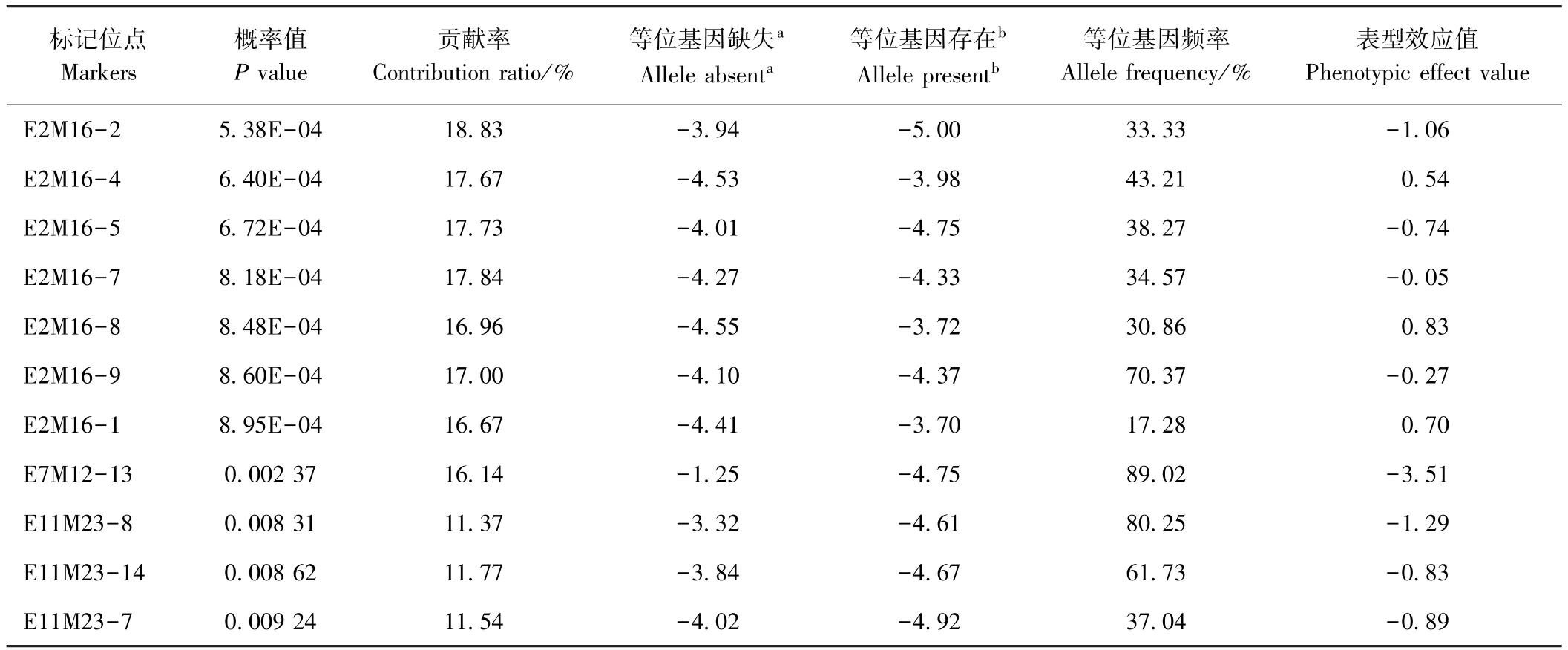
表4 在P<0.01水平下与抗寒性显著相关的标记Table4 Markers significantly associated with cold tolerance at P<0.01 level
关联分析是开展数量性状遗传研究的重要手段之一[30-32],已成功用于挖掘植物抗寒优异基因资源或等位变异。Huang等[33]利用关联分析在玉米发芽期和苗期检测到40个SNP与10个抗寒性状相关;Visioni等[34]通过关联分析挖掘到2个大麦抗寒相关SNP与已知QTL位点重叠。近年来,关联分析在菊花耐涝性[20]、抗蚜性[35]和其他园艺性状[18,36]优异等位变异挖掘中均有相关报道。本研究基于前期报道的707个分子标记[18],利用MLM法挖掘到8个抗寒相关有利位点,其中有1个分子标记位点(E7M12-13)的表型效应值达到显著水平(P<0.01)。结合LT50表型数据,发现携带E7M12-13位点且抗寒性较好的品种有南农金柠檬、Qx097、QD028、Qx049、Qx153 和 Qx008,均可作为重要的亲本材料加以利用。此外,通过与 Li等[16]研究比较,发现本研究中有3个抗寒性相关标记位点(E2M16-2、E2M16-1和 E11M23-14)分别与花期、花颈长度和叶缘锯齿相关。鉴于抗寒性与这些园艺性状是不同类型的性状,推测可能是由于连锁引起的。这为今后通过间接筛选耐寒品种提供了初步证据,同时也为改良菊花耐寒性和其他园艺性状提供了理论依据。本研究利用了707个SRAP、SCoT等多态性分子标记位点,但检测到的抗寒性相关等位变异位点主要集中在 E2M16、E7M12和 E11M23等 3对SRAP引物组合扩增出的多态性位点中,说明这些显性标记位点在抗寒性关联分析中有其局限性。因此,在今后研究中应进一步利用基于高通量测序的SNP等分子标记开展相关研究,为高效挖掘菊花耐寒优异等位变异及其相关的候选基因奠定重要基础。
4 结论
本研究明确了83个切花菊品种的低温半致死温度(LT50)介于-10.99~1.86℃之间,变异系数达79.81%,通过聚类分析将其分为抗寒、中抗寒、低抗寒和不抗寒4种类型;检测到8个抗寒有利位点,其中E7M12-13的表型效应值达到显著水平(P<0.01),并筛选到携带该有利位点的6个抗寒品种。本研究结果为切花菊抗寒性的遗传改良和分子标记辅助选择育种提供了理论依据。
