从基础知识上入手 在解题应用中提高
2019-01-08罗功举


摘 要:本文以酸碱中和滴定曲线问题为话题,从高考复习备考角度,对酸碱中和滴定曲线基本图示、指示剂的选择、滴定曲线类型及规律、滴定曲线的分析方法等基础知识进行了归纳总结,并对一些典型、易错问题举例分析.
关键词:酸碱中和滴定;滴定曲线;复习备考
作者简介:罗功举(1966-),男,湖北仙桃人,本科,中学高级教师,研究方向:高中化学教学与课题研究.
酸碱中和滴定曲线一直是历年高考考查的热点题型,它也是沉淀滴定曲线、分布系数图(描述pH与体系中组分的平衡浓度占总浓度的分数的关系图)等问题分析的原型知识,是备考复习中的重点内容.
1 酸碱中和滴定曲线
1.1 常温下(下同),以0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸为例,其滴定曲线如图.
备考启示:
(1)未滴加碱时,曲线在纵坐标上的起点对应的pH即反映盐酸中的c(H+)大小.图中pH=1.
(2)当接近滴定终点时,若少滴一滴NaOH溶液(一滴溶液的体积约为0.04 mL),至此滴入NaOH溶液19.96 mL,即盐酸过量0.04 mL,则溶液中c(H+)=0.1000 mol·L-1×0.04 mL/ 39.96 mL≈1.0×10-4 mol·L-1,pH=4,即突变范围的起始点;若多滴一滴NaOH溶液,至此滴入NaOH溶液20.04 mL,即NaOH过量0.04 mL,则溶液中c(OH-)=0.1000 mol·L-1×0.04 mL/40.04 mL≈1.0×10-4 mol·L-1,pOH=4,pH=10,即突变范围的终点.也就是说,接近滴定终点时,前后滴入NaOH溶液的体积差量不到0.1 mL,溶液就由pH=4变到了pH=10.
(3)甲基橙变色范围的pH为3.1~4.4,刚好跨过突变范围的起始点(pH=4),所以,滴定终点时的溶液呈中性或酸性时,可以选择甲基橙作指示剂.如用盐酸滴定NaHCO3溶液时,可选用甲基橙作指示剂.
酚酞变色范围的pH为8.2~10.0,刚好跨过突变范围的终点(pH=10),所以,滴定终点时的溶液呈中性或碱性时,可以选择酚酞作指示剂.如用NaOH溶液滴定CH3COOH溶液时,可选用酚酞作指示剂.
而石蕊变色范围的pH为5.0~8.0,一是其变色范围介于突变范围4.0~10.0之间,与滴定终点溶液的酸碱性不一致;二是其变色范围较大(相差3个单位),变色不灵敏,而甲基橙和酚酞的变色范围较小,均相差不到2个单位,故可选用甲基橙和酚酞作指示剂,不用石蕊作指示剂.
(4)开始时,加入的碱对pH的影响较小;接近滴定终点时,曲线发生“突变”;终点后,加入的碱对pH的影响较小.
1.2 强酸(碱)滴定弱碱(酸)pH曲线比较 如表1.
备考启示:
(1)纵坐标上曲线的起点位置反映被滴定溶液的酸碱性及c(H+)、c(OH-)的大小.起点pH<7时,被滴定溶液是酸,位置越低(pH越小),酸性越强;起点pH>7时,被滴定溶液是碱,位置越高(pH越大),碱性越强.
(2)强酸强碱互滴,滴定终点时是发生“突变”(曲线较为陡直);强碱滴定弱酸、强酸滴定弱碱,滴定终点时是发生“渐变”(曲线较为平坦).
(3)以0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸为例,其滴定曲线如图2.
a点,醋酸反应一半,溶液中的溶质为CH3COONa和CH3COOH(理论上,其浓度比为1∶1),各粒子浓度为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)(CH3COOH的电离程度大于CH3COO-的水解程度);溶液呈酸性,对水的电离起抑制作用,即水电离出来的c(H+)<10-7 mol/L.
b点,反应中性点,溶液中的溶质為CH3COONa和CH3COOH(前者多,后者少),溶液呈中性,各粒子浓度为c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
c点,二者恰好反应完全,溶液中的溶质为CH3COONa(理论上),各粒子浓度为c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)(CH3COO-的水解程度大于H2O的电离程度);溶液呈碱性,对水的电离起促进作用,即水电离出来的c(H+)>10-7 mol/L.
d点,NaOH溶液过量一倍,溶液中的溶质为CH3COONa和NaOH(理论上,其浓度比为1∶1),各粒子浓度为c(Na+)>c(OH-)>c(CH3COO-)>c(H+)>c(CH3COOH);溶液呈碱性,对水的电离起抑制作用,即水电离出来的c(H+)<10-7 mol/L.
(4)若有二元弱酸参与反应时,滴定终点会有两个,第一个是生成产物为酸式盐时,第二个是生成产物为正盐时.分析时,要逐段判断.
(5)恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性.
(6)弱碱滴定等浓度等体积的强酸、弱酸的滴定曲线及弱酸滴定等浓度等体积的强碱、弱碱的滴定曲线如何表示呢?与上述图像有关联吗?
1.3 滴定曲线分析的方法
(1)分析步骤:①看纵坐标或横坐标表示的量,搞清楚是酸加入碱中,还是碱加入酸中;②看起点,通过起点可以看出被滴定物质的酸性或碱性的强弱,这在判断滴定终点时至关重要;③找滴定终点(恰好完全反应点,通过横坐标上的体积量判断)和pH=7的中性点(通过纵坐标判断),判断滴定终点时溶液呈现的酸碱性,然后确定中性点(pH=7)的位置;④分析其它的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况,并确定对应点的溶质,进而判断溶液的性质、离子浓度大小等.
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系,可能是特殊的倍数关系.
2 典例分析
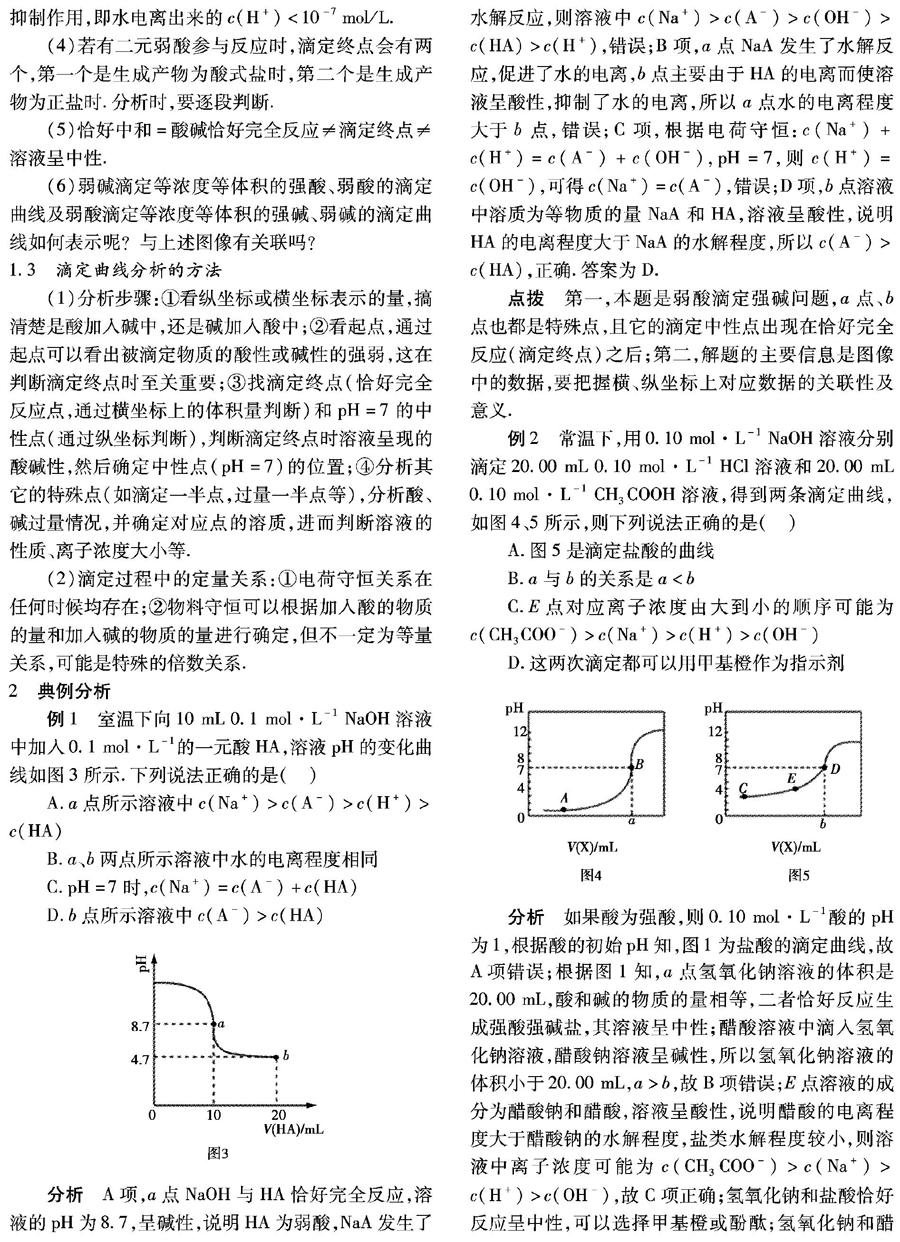
例1 室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图3所示.下列说法正确的是( )
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
分析 A项,a点NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生了水解反应,则溶液中c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),错误;B项,a点NaA发生了水解反应,促进了水的电离,b点主要由于HA的电离而使溶液呈酸性,抑制了水的电离,所以a点水的电离程度大于b点,错误;C项,根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),pH=7,则c(H+)=c(OH-),可得c(Na+)=c(A-),错误;D项,b点溶液中溶质为等物质的量NaA和HA,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),正确.答案为D.
点拨 第一,本题是弱酸滴定强碱问题,a点、b点也都是特殊点,且它的滴定中性点出现在恰好完全反应(滴定终点)之后;第二,解题的主要信息是图像中的数据,要把握横、纵坐标上对应数据的关联性及意义.
例2 常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到两条滴定曲线,如图4、5所示,则下列说法正确的是( )
A.图5是滴定盐酸的曲线
B.a与b的关系是a
C.E点对应离子浓度由大到小的顺序可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
分析 如果酸为强酸,则0.10 mol·L-1酸的pH为1,根据酸的初始pH知,图1为盐酸的滴定曲线,故A项错误;根据图1知,a点氢氧化钠溶液的体积是20.00 mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入氫氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00 mL,a>b,故B项错误;E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C项正确;氢氧化钠和盐酸恰好反应呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D项错误.答案为C.
点拨 本题的图像是分开呈现的,比在同一个图像中出现时分析难度要大,但只要遵循基本分析方法还是容易判断的,即将曲线延长与纵坐标相交,看交点对应的pH大小,就可以确定酸的强弱;再根据滴定曲线中特殊点的规律,可确定a与b的大小.
例3 298 K时,向20.0 mL 0.10 mol·L-1 H2A溶液中滴加0.10 mol·L-1 NaOH溶液,滴定曲线如图6所示.下列说法正确的是( )
A.该滴定过程应该选择石蕊溶液作指示剂
B.W点到X点发生的主要反应的离子方程式为H2A+2OH-=A2-+2H2O
C.Y点对应的溶液中c(Na+)+c(H+)=c(OH-)+2c(A2-)
D.反应H2A+A2-2HA-的平衡常数K=1.0×107.4
分析 石蕊不能用作酸碱中和滴定的指示剂,根据图示滴定终点的pH,可知第二反应终点应用酚酞作指示剂,A项错误;X点对应的溶液中溶质主要是NaHA,W点到X点发生的主要反应的离子方程式为H2A+OH-=HA-+H2O,B项错误;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),因为Y点对应的溶液中c(HA-)=c(A2-),所以c(Na+)+c(H+)=c(OH-)+3c(A2-),C项错误;H2AHA-+H+,Ka1= c(H+)·c(HA-)/c(H2A),由于W点c(HA-)=c(H2A),故Ka1=c(H+)=1.0×10-2.3;HA-A2-+H+,Ka2=c(H+)·c(A2-)/c(HA-),由于Y点对应的溶液中c(HA-)=c(A2-),故Ka2=c(H+)=1.0×10-9.7;H2AHA-+H+与HA-A2-+H+相减即得H2A+A2-2HA-,此时的平衡常数K=Ka1/Ka2=1.0×10-2.3/(1.0×10-9.7)=1.0×107.4,D项正确.答案为D.
