高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化
2019-01-07伍亚龙邓维琴张其圣
李 恒,陈 功,伍亚龙,邓维琴,张 伟,朱 翔,王 勇,张其圣,*
(1.四川东坡中国泡菜产业技术研究院,四川 眉山 620030;2.四川省食品发酵工业研究设计院,四川 成都 611130)
泡菜是一种具有独特风味和口感的传统发酵蔬菜制品,历史悠久,源远流长,距今已有三千多年的历史。我国泡菜工艺多样,产品种类极为丰富,其中尤以四川泡菜最为出名。传统四川泡菜是以新鲜蔬菜为原料,经乳酸菌为主导的微生物发酵而成,因富含活性乳酸菌、发酵副产物等健康元素,越来越得到消费者的青睐[1-4]。“母水发酵”是传统四川泡菜最具特色的制备工艺之一。泡菜母水即传统四川泡菜泡渍发酵时的盐水,经过不断取出和投加蔬菜及辅料进行泡制。泡菜母水中存在大量的乳酸菌、酵母菌、醋酸菌等活性微生物,同时,蔬菜的发酵也赋予了泡菜母水丰富的有机酸、游离氨基酸、醛类、酮类、酯类等风味物质[5-9]。
国内外学者研究发现泡菜中乳酸菌和酵母菌是优势菌群,乳酸菌在发酵过程中起主导作用。泡菜发酵过程中优势乳酸菌有粪肠球菌(Enterococcus faecalis)、乳酸球菌(Lactococcus lactis subsp.)、明串珠菌(Leuconostoc mesenteroides subsp.)、Mesenteroides、植物乳杆菌(Lactobacillus plantarum)、干酪乳杆菌(Lactobacillus casei)和玉米乳杆菌(Lactobacillus zeae)等[6-7,10]。家庭制作泡菜中酵母菌有热带假丝酵母(Candida tropicalis)、汉森德比利酵母、Kazachstania unispora等[11]。泡菜中的微生物种类和数量极多,但其种群与构成并不是一成不变的,在不同的发酵时期微生物种群和构成有一定的差异。传统四川泡菜采用“母水发酵”工艺,母水的形成与泡菜体系中微生物及其代谢产物有密切的关系[12-13]。目前已有报道多是针对泡菜本身或者泡菜母水中微生物含量[2,14-16]的研究,而针对不同发酵代数泡菜母水中微生物种类及动态变化的研究还鲜见报道。研究传统四川泡菜母水中微生物随不同发酵代数泡菜的动态变化对研究四川泡菜的安全性、风味物质、营养物质的形成具有重要意义,可作为促进四川传统泡菜工业化生产的重要依据。
可培养方法是传统发酵食品体系中微生物最常见的研究方法,但采用可培养方法得到的微生物信息非常有限,对微生物世界的认识存在片面性,存在较大的局限性。近年来,高通量测序技术的快速发展为解析复杂的微生物体系提供了一种有效、便捷的方法。其通量高、准确率高、可同时获得微生物群落中的全部微生物定性及相对定量的遗传信息等特点,被广泛用于传统发酵食品微生物体系的研究[17-18]。目前高通量测序已被广泛用于奶酪、白酒、泡菜等发酵食品中微生物多样性的研究[19-22]。本研究采用高通量测序技术对传统四川泡菜母水(20 代泡菜)中细菌和真菌群落的动态变化进行研究,解析不同代数发酵泡菜母水中的主要微生物群落构成,揭示泡菜母水在不同蔬菜发酵代数的微生物群落动态变化规律及其稳态结构的形成,为传统四川泡菜的多次数发酵泡菜风味及品质评价提供数据参考。
1 材料与方法
1.1 材料与试剂
莲花白、白萝卜、胡萝卜、生姜、辣椒、花椒眉山当地菜市场;无碘食用盐 四川省盐业公司;陶制泡菜坛 眉山当地市场。
无水乙醇(96%~100%) 成都市科龙化工有限公司;细菌基因组DNA提取试剂盒、DNA回收试剂盒天根生化科技(北京)有限公司;OMEGA真菌DNA提取试剂盒 美国BioTek公司;MRS培养基、孟加拉红培养基、PDA培养基 北京陆桥技术有限公司;琼脂糖北京索莱宝科技有限公司。
1.2 仪器与设备
DW-86W100超低温冰箱 青岛海尔股份有限公司;L6S紫外分光光度计、雷磁pHS-3C pH计 上海仪电科学仪器股份有限公司;T2002型电子天平 常熟市天量仪器有限责任公司;SHZ-D(III)循环式真空泵 巩义市予华仪器有限责任公司;DZKW-4电子恒温水浴锅 北京中兴伟业仪器有限公司;YM75Z75L不锈钢立式压力蒸汽灭菌器 上海博讯实业有限公司;QL-901旋涡混合器 海门市其林贝尔仪器制造有限公司;SW-CJ-IFD超净工作台江苏苏净集团有限公司;纯水机 四川优普超纯科技有限公司。
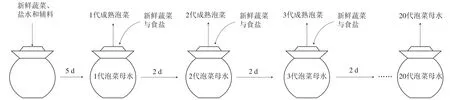
图1 泡菜母水制备示意图Fig. 1 Schematic representation of pickle brine preparation
1.3 方法
1.3.1 泡菜母水制备
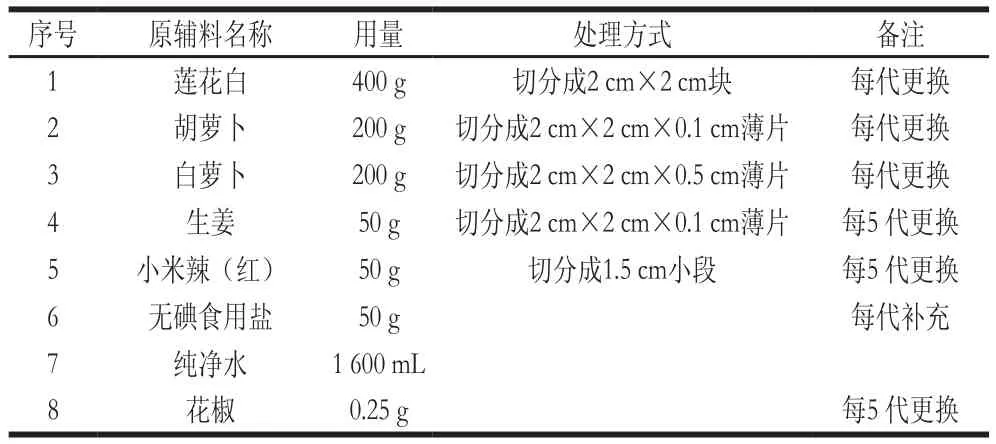
表1 泡菜制备原辅料配比Table 1 Ingredients used for Paocai preparation
泡菜母水的制备方法如图1所示,原辅料配比如表1所示。泡菜母水的制备步骤为:1)将新鲜莲花白、白萝卜、胡萝卜、生姜、小米辣用清水冲洗干净,并按照要求进行切分;2)先将处理后的原辅料投入到2.5 L的陶制泡菜坛中,再将食盐加入到纯净水中溶解并加入到坛内;3)密封后的泡菜坛置于23 ℃条件下进行密封发酵,并及时取样检测;4)新鲜疏菜密封发酵5 d后,揭开坛盖用干净的玻璃棒轻微搅拌坛内泡菜,再静置10 min后,于液面下10 cm处四周及中间共5 点取泡菜及母水样品10 mL混合后待测,此为1代泡菜母水;再向坛内加入新鲜的莲花白、白萝卜、胡萝卜,同时向坛内加入新鲜蔬菜总质量2%的食盐16 g,密封后置于23 ℃恒温条件下发酵2 d,继续取样,此为2代泡菜;此后每隔2 d取出成熟泡菜与泡菜水,并加入新鲜蔬菜进行下一代泡制,如此不断重复,连续泡菜20 代;5)泡菜坛内生姜与辣椒在泡渍发酵5 代后更换相同质量的新鲜生姜、辣椒和花椒,即在第5、10、15、20代时将坛内的泡生姜、泡辣椒和花椒取出,加入相同质量的新鲜生姜、辣椒和花椒,同时加入新鲜生姜和辣椒总质量2%的食盐。
1.3.2 DNA提取和聚合酶链式反应(polymerase chain reaction,PCR)扩增
分别取第1、2、3、5、7、10、12、15、18、20代的泡菜母水,采用细菌基因组DNA提取试剂盒和真菌DNA提取试剂盒分别提取细菌和真菌基因组DNA,采用核酸蛋白微量检测仪检测DNA的浓度和纯度,置于-20 ℃备用。
采用338 F-806 R为引物扩增细菌16S DNA V3-V4区序列,采用ITS1 F-2043 R为引物扩增真菌ITS区序列。采用天根琼脂糖DNA回收试剂盒对PCR扩增产物进行切胶回收,然后按照PCR产物的检测方法检测。
1.3.3 高通量测序
将PCR扩增产物送至上海美吉生物医药科技有限公司进行MiSeq测序,按照97%相似性对非重复序列(不含单序列)进行操作分类单元(operational taxonomic units,OTU)聚类,得到OTU的代表序列,将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,最后采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各个水平统计每个样品的群落组成。16S细菌使用Silva数据库,ITS真菌使用Unite的真菌数据库进行比对。
2 结果与分析
2.1 泡菜母水中的细菌多样性结果分析
利用MiSeq测序方法对第1、2、3、5、7、10、12、15、18、20代泡菜母水的10 个样品进行分析,共得到961 752 条序列,平均序列长度449.34 bp。其中421~440 bp的序列占2.84%;441~460 bp的序列占97.16%。本次测序的目标序列是V3-V4,说明测序长度正确。
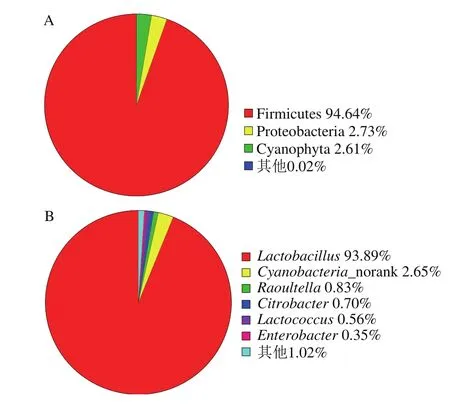
图2 泡菜母水细菌在门(A)和属(B)水平上的相对含量Fig. 2 Relative abundance of bacteria in Paocai brine at the phylum (A) and genus (B) levels
对优化序列提取非重复序列,按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。961 752 条序列经过上述处理,共划分得到81个OTU分类。
泡菜母水中细菌在门和属水平上的相对含量分布结果如图2所示,其细菌分属7个门,分别为Firmicutes、Proteobacteria、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、梭菌门(Fusobacteria)、绿弯菌门(Chloroflexi)和蓝藻门(Cyanophyta)。Firmicutes是泡菜中最常见的细菌类群,含有19 个OTU,占OTU总数量的23.46%;包含有效序列896 313 条,占总有效序列的94.64%。Proteobacteria在泡菜菌群中占46个OTU,占OTU总数量的56.79%;包含有效序列25 787条,占总有效序列的2.73%。其他5个菌门的序列占细菌总有效序列的比例均很低,分别为Bacteroidetes 0.025%、Actinobacteria 0.001 4%、Fusobacteria 0.002 3%、Chloroflexi 0.001 2%、Cyanophyta 2.61%。与Liang Huipeng等[5]以聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCRDGGE)结合荧光定量核酸(real-time quantitative PCR,qPCR)扩增检测系统为手段分析的泡菜微生物菌群结构(仅发现Firmicutes和Proteobacteria 2 个门的细菌)相比,本研究结果准确、全面地揭示了四川泡菜中的细菌菌群结构,进一步表明高通量测序手段在微生物群落结构分析方面的优势[23]。
从属水平来看,泡菜母水中含量在0.1%以上的细菌属有7 个,包括乳杆菌属(Lactobacillus)、拉乌尔菌属(Raoultella)、柠檬酸杆菌属(Citrobacter)、乳球菌属(Lactococcus)、蓝藻细菌属(Cyanobacteria_norank)、肠杆菌属(Enterobacter)和未鉴定到属(Enterobacteriaceae_unclassifi)。其中Lactobacillus是泡菜母水中的主要细菌属,包含3 个OTU,占OTU总数的3.70%,但包含有效序列904 029 条,占总有效序列的93.89%;Cyanobacteria_norank包含1 个OTU,占OTU总数的1.23%,包含有效序列255 210 条,占总有效序列的2.65%;Raoultella包含1 个OTU,占OTU总数的1.23%,包含有效序列8 022 条,占总有效序列的0.83%;Citrobacter包含1 个OTU,占OTU总数的1.23%,包含有效序列6 785 条,占总有效序列的0.70%;Lactococcus包含2 个OTU,占OTU总数的2.46%,包含有效序列5 399 条,占总有效序列的0.56%。除此之外,还包括Enterobacter、Enterobacteriaceae_unclassifi、Pseudomonas、Leuconostoc、Enterococcus、Acinetobacter等菌属,但相对含量均不足0.1%。Lactobacillus在整个泡菜发酵过程中均为优势菌,这种细菌因其益生作用被广泛用作各类食品的发酵剂[5,24-26];最近有报道显示,Raoultella在广元酸菜中也有检出[27];Citrobacter和Lactococcus细菌在发酵蔬菜研究中常被检出,Lactococcus对发酵乳的酸化及风味的产生贡献较大,其对于泡菜的风味形成亦起重要作用[5,28]。
2.2 泡菜母水中的真菌多样性结果分析
利用Illumina高通量测序平台对第1、2、3、5、7、10、12、15、18、20代泡菜母水的20个样品进行分析,共得到514 126 条真菌序列,平均序列长度318.25 bp。其中221~240 bp的序列占2.79%,241~260 bp的序列占1.45%,241~260 bp的序列占95.03%,可以覆盖目标测序长度。
对优化序列提取非重复序列,按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。514 126 条真菌序列经过上述处理,共划分得到90 个OTU分类。
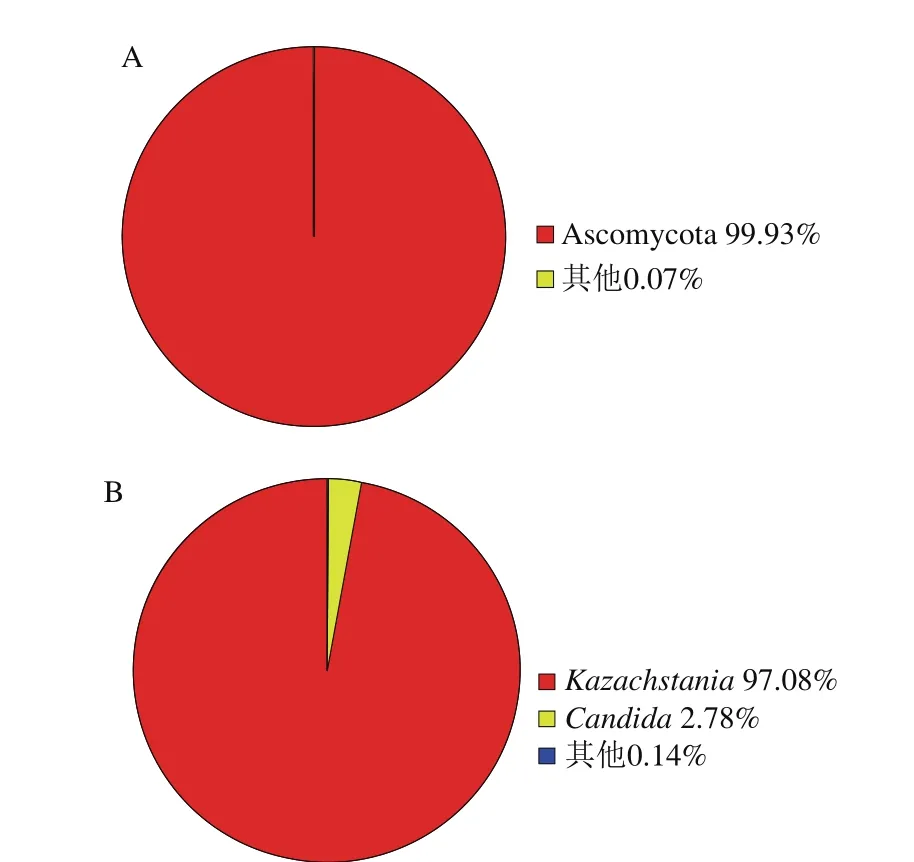
图3 泡菜母水真菌在门(A)和属(B)水平上的相对含量Fig. 3 Relative abundance of fungi in Paocai brine at the phylum (A) and genus (B) level
图3 是真菌属水平和种水平相对含量分布图,10 个泡菜母水样本的真菌有效序列被划分为90 个OTU,包含子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)3 个门和一个未分类的种群。从含量来看,Ascomycota是泡菜母水中的主要真菌类群,含有62 个OTU,占OTU总数的68.89%;包含有效序列512 784 条,占总有效序列的99.93%。Basidiomycota含有18 个OTU,占OTU总数的20%;包含有效序列226条,占总有效序列的比例不足1%。Zygomycota含有OTU 3条,占OTU总数的3.33%,有效序列12 条,占总有效序列的比例不足1%。一个未分类种群含有7 个OTU,占OTU总数的7.78%,含有效序列134 条,占总有效序列的比例不足1%。Liang Huipeng等[5]的研究所检测出的真菌均属于Ascomycota,在门水平多样性其多样性远远小于本研究结果,这可能也是菌群分析方法不同所致,该研究采用的是PCR-DGGE和qPCR的方法,说明本研究采用的高通量测序分析方法更加全面。
从属水平来看,泡菜母水中的真菌属主要是Kazachstania和假丝酵母属(Candida)。其中Kazachstania包含1 个OTU,占OTU总数的1.11%,但包含了498 172 条有效序列,占总有效序列的97.08%;Candida包含7 个OTU,占OTU总数的7.78%,包含14 251 条有效序列,占总有效序列的2.78%。Liang Huipeng等[5]分析的泡菜中毕赤酵母属(Pichia)和地丝酵母属(Geotrichum)为主要真菌属,与本研究结果不同,可能是由于地域、蔬菜原辅料及加工工艺等的差异所致。
2.3 泡菜母水中细菌群落结构的动态变化
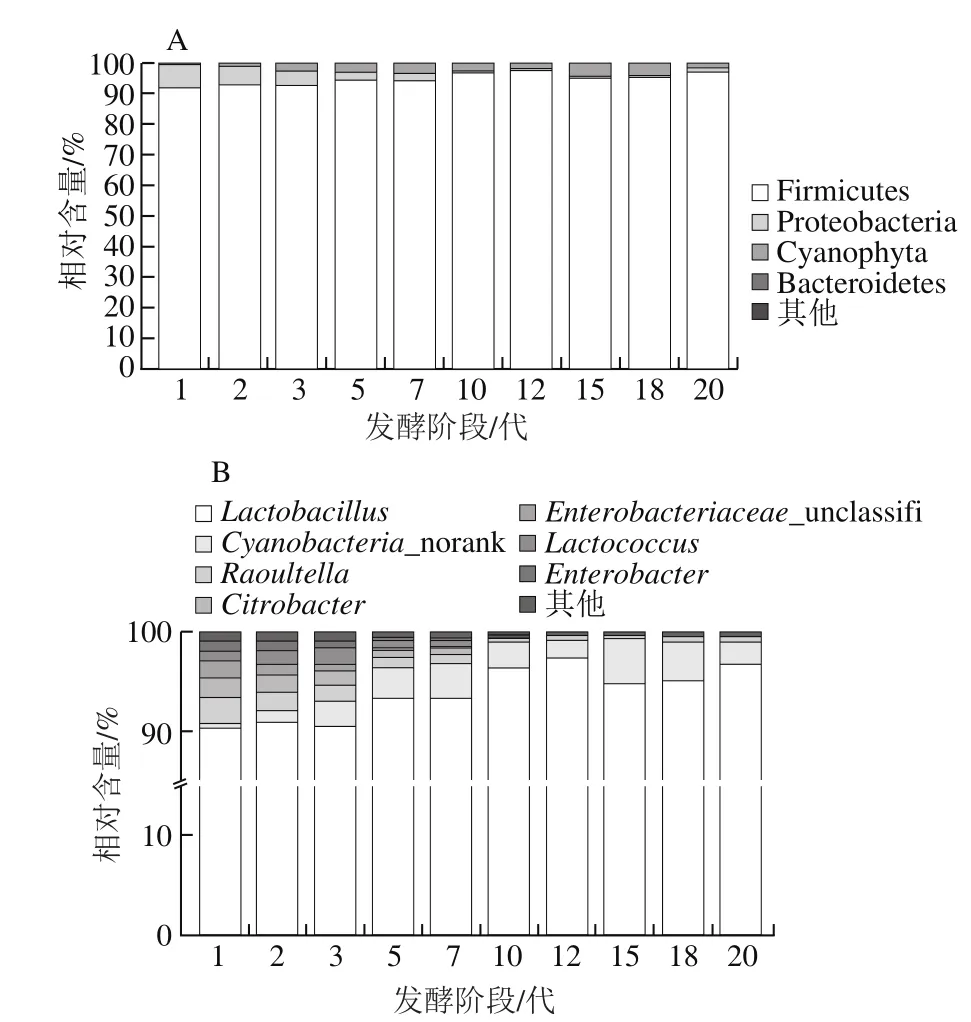
图4 泡菜母水发酵过程中门水平(A)和属水平(B)细菌群落结构动态变化Fig. 4 Dynamic changes of bacteria community in Paocai brine during fermentation
泡菜母水中的细菌群落包括7 个门,其中Firmicutes和Proteobacteria为优势菌门。在泡菜母水进化过程中,细菌群落结构在门水平上的动态变化规律如图4A所示,Firmicutes自始至终都占绝对优势,而且所占比例呈现缓慢上升趋势:在1代泡菜母水中Firmicutes所占比例为91.86%,20代时上升至97.05%;Proteobacteria在泡菜母水发酵前期所占比例较高,为7.62%,但随着泡菜母水的进化其所占比例逐渐减少,直至20代时其含量为1.24%。
在属水平上,传统四川泡菜发酵过程中的细菌多样性呈下降趋势,各细菌数表现出不同的变化规律(图4B)。发酵前期泡菜母水中Lactobacillus、Raoultella、Citrobacter、Lactococcus、Cyanobacteria_norank是泡菜母水中的主要细菌属,Lactobacillus是其中的优势菌属,随着泡菜母水的持续发酵,其含量总体呈现增长趋势,始终是泡菜母水中的优势菌属,在1代泡菜母水中Lactobacillus的比例为90.30%,10代和12代泡菜母水中,其占比上升至96.36%和97.34%,此后略有波动。到20代时其相对含量达到95%以上。此外,Cyanobacteria_norank属细菌所占比例也逐渐上升,所占比例由0.4%上升到3%。而Raoultella、Citrobacter、Lactococcus、Enterobacteriaceae_unclassifi和Enterobacter等菌属的占比逐渐下降,最终其总含量不足2%。Raoultella所占比例随泡菜母水的进化呈逐渐减少趋势,1代时为2.55%,20代时仅为0.17%。Lactococcus在1~7代时相对含量达到0.5%~1.7%,此后迅速下降至0.1%以下;Enterobacter在1~7代时的相对含量达到0.35%~1%,此后迅速降低至0.06%~0.1%;Enterobacteriaceae_unclassifi在1~7代时的相对含量达到0.1%~1.6%,此后迅速降低至0.1%以下。
2.4 泡菜母水中真菌群落结构的动态变化
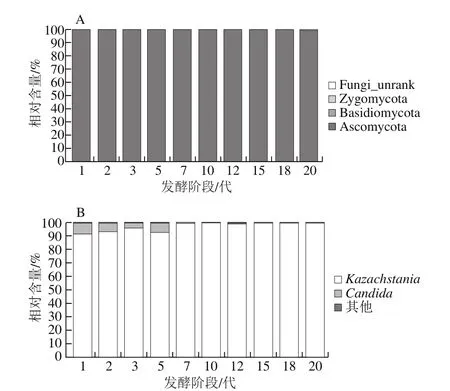
图5 泡菜母水发酵过程中门水平(A)和属水平(B)真菌群落结构动态变化Fig. 5 Dynamic changes of fungal community in Paocai brine during fermentation at the phylum (A) and genus (B) level
泡菜母水发酵生态系统中的真菌群落结构随着泡菜母水代数的增加,其多样性逐渐降低,群落结构也发生改变。泡菜不断发酵过程中泡菜母水中真菌群落结构的动态变化如图5所示。从门水平(图5A)看,Ascomycota从始至终都占据绝对优势,所占比例达到99%以上,是泡菜母水中的主要真菌群类;此外,还有威克汉姆酵母(Wickerhamomyces)、季也蒙酵母(Meyerozyma)、镰刀菌属(Fusarium)、赤霉菌属(Gibberella)、红酵母属(Rhodotorula)、耐冷酵母(Guehomyces)、被孢霉属(Mortierella)、Basidiomycota、Zygomycota和其他一些未鉴定到门的真菌界微生物,它们所占比例不足1%,不是泡菜发酵过程中的主要真菌群落,相对含量在泡菜母水进化过程中亦没有明显的变化规律。从属水平上看(图5B),泡菜母水发酵系统中的真菌群落结构随着泡菜母水代数的增加,其多样性逐渐降低,群落结构也发生改变。发酵前期的泡菜母水中的真菌以Kazachstania和Candida为主,Kazachstania的比例随着泡菜发酵代数的增加逐渐升高,1~5代泡菜母水中其所占比例在91%~95%,7代及7代以后的泡菜母水中其所占比例上升至98%~99%;而Candida的比例随着泡菜发酵代数的增加逐渐降低,1~5代泡菜母水中其所占比例在4%~9%,7代及7代之后的泡菜母水中其所占比例已经低于1%。Liang Huipeng等[5]报道的传统泡菜发酵1~31 d过程中Pichia始终为优势真菌属,而本研究显示Kazachstania是泡菜母水发酵系统中的优势真菌。Kazachstania在酸奶[29]、韩国泡菜[30]、日本泡萝卜[31]等发酵食品中已有报道,本研究首次发现Kazachstania在四川泡菜中作为主要真菌属,其在泡菜发酵过程中的作用特性有待进一步探索。
发酵前期泡菜母水中微生物多样性高,细菌和真菌种类较多,发酵后期体系中微生物多样性降低,但优势菌群始终不变,且在12代以后泡菜母水中微生物基本保持稳定。整个泡菜体系中优势菌群主要是Lactobacillus、Cyanobacteria_norank和Kazachstania,说明在不同代数发酵泡菜中起主要作用的微生物是一致的。发酵过程中细菌Raoultella、Enterobacteriaceae_unclassifi、Lactococcus和Enterobacter等菌属所占比例逐渐降低,最终所占比例不足2%。Cyanobacteria_norank属细菌所占比例也逐渐上升,所占比例由0.4%上升到3%。真菌体系中Kazachstania最初所占比例为91%,到12代时基本保持稳定,约为99%;而Candida的比例随着泡菜发酵代数的增加逐渐降低,1~5代泡菜母水中其所占比例在4%~9%,7代及7代之后的泡菜母水中其所占比例已经低于1%,到12代时含量极低。说明泡菜发酵前期微生物多样性更丰富,随着发酵代数增多,发酵体系中代谢产物增多,微生物之间竞争可能也更激烈,一些在泡菜体系中适应能力相对较弱的微生物逐渐被淘汰。而适应能力强的主要微生物则在后期发挥主要作用。
2.5 不同发酵阶段泡菜母水的微生物群落结构的对比
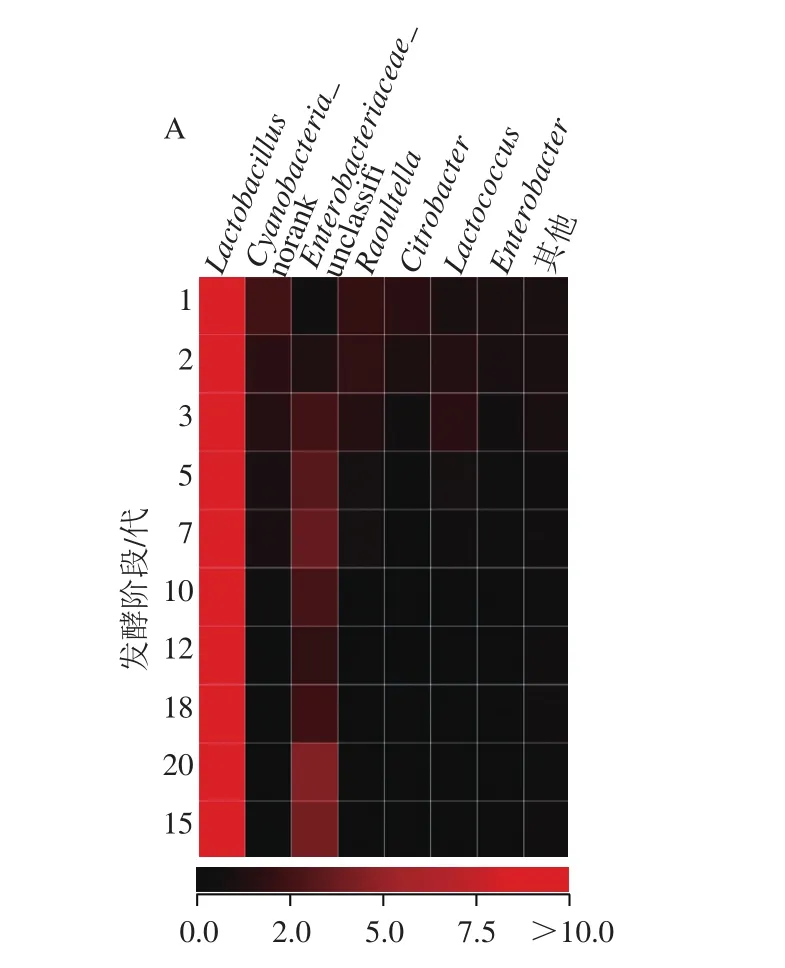
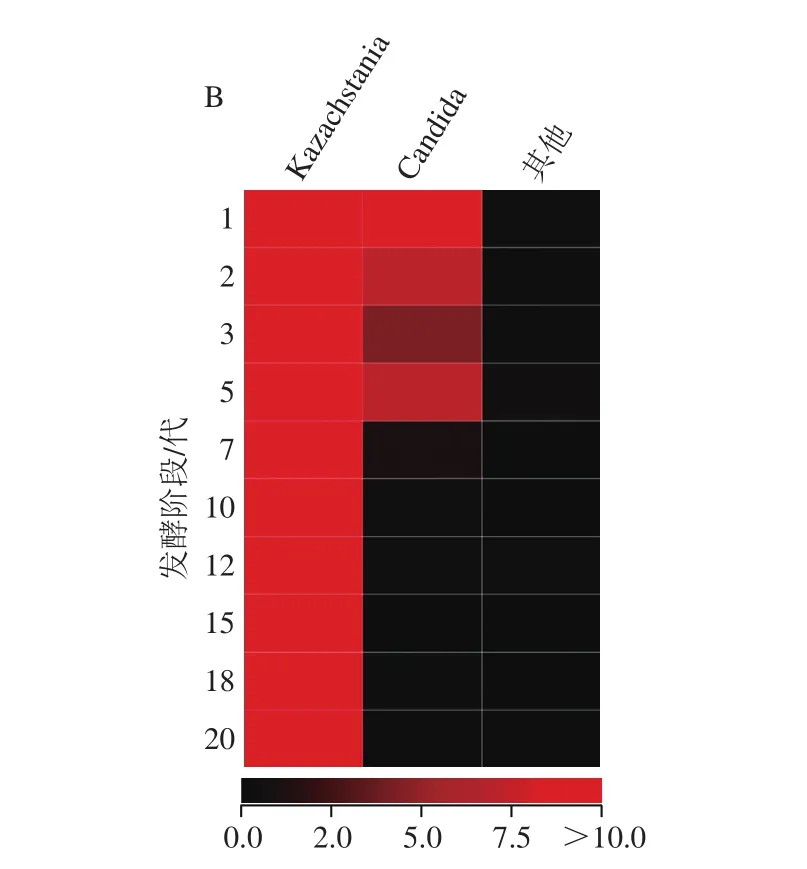
图6 基于属水平的泡菜母水细菌(A)和真菌(B)Heatmap图Fig. 6 Heatmap analysis of microbiological diversity in Paocai brine
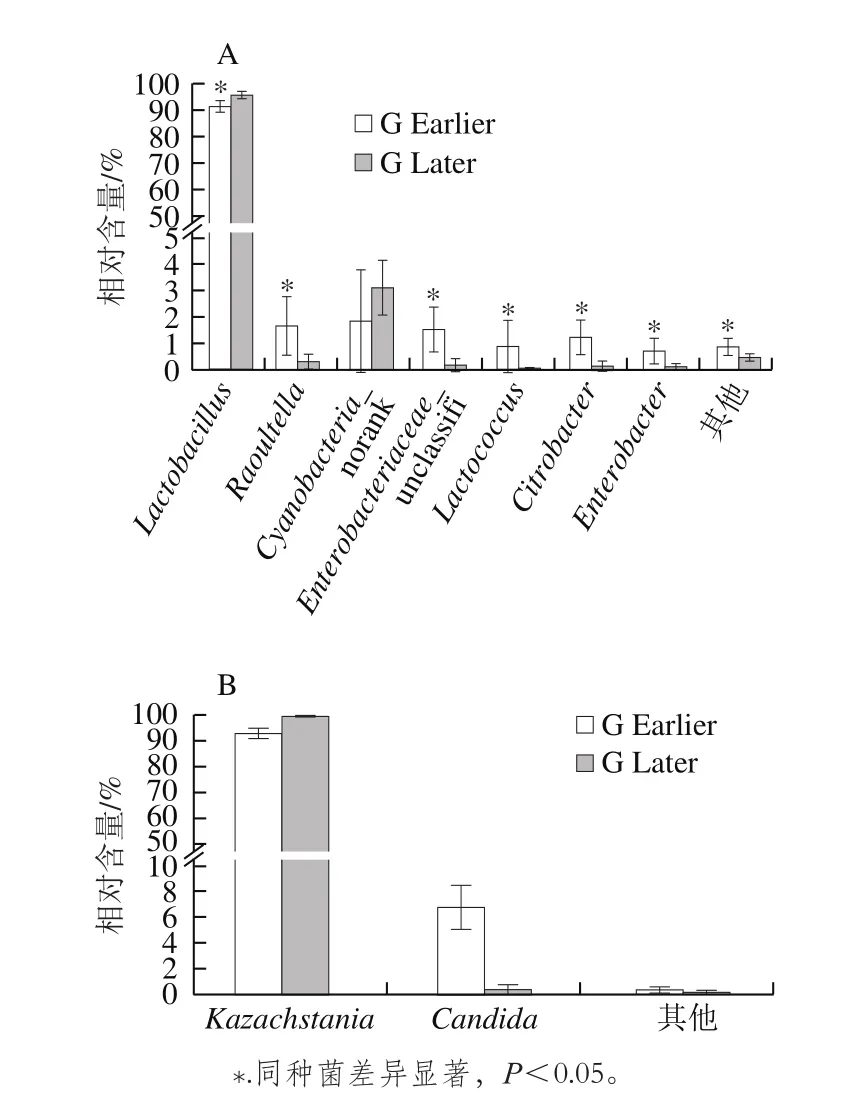
图7 不同发酵阶段泡菜母水中主要细菌(A)和真菌(B)属相对含量对比Fig. 7 Comparison of the relative contents of major bacteria and fungi in Paocai brine
图6 显示,不同发酵阶段泡菜母水的细菌群落结构和真菌群落结构有明显差异,其中7代以前(包含7代)的泡菜母水中细菌菌属较多,优势细菌属主要是Lactobacillus和Cyanobacteria_norank。优势真菌属是Kazachstania,5代之后的泡菜母水中微生物真菌菌属明显减少,微生物种类多样性显著降低。分别根据不同发酵时期泡菜母水细菌和真菌属水平上群落结构对进行聚类分析,将1、2、3、5代和7代聚为一类,命名为G Earlier;10、12、15、18代和20代聚为一类,命名为G Later,结果如图7所示。从细菌多样性来看,G Earlier泡菜母水中的细菌属明显多于G Later,其多样性显著优于G Later。从细菌群落结构来看,G Later泡菜母水中的Lactobacillus和Cyanobacteria_norank相对含量高于G Earlier,而Raoultella、Citrobacter、Enterobacteriaceae_unclassifi、Lactococcus的相对含量明显低于G Later,Lactobacillus和Cyanobacteria_norank是泡菜母水中优势菌属,且含量逐渐提高。优势真菌属主要是Kazachstania,发酵后期泡菜母水中Kazachstania含量略高于发酵前期,Candida和其他真菌的含量明显低于发酵前期,Kazachstania的含量在整个发酵过程中始终为优势菌属。
3 结论与讨论
通过分析不同代数泡菜母水中微生物群落的变化,结果显示,泡菜母水中的细菌群落主要包括7个门,其中Firmicutes和Proteobacteria分别占94.64%和2.73%,为优势菌门,这和Cao Jialu等[15]的研究一致。Liang Huipeng等[5]研究证明,泡菜中优势菌门也是Firmicutes和Proteobacteria,说明不同代数发酵泡菜和发酵母水中优势菌群是一致的;泡菜母水中真菌群落主要包括3个门和1个未分类种群,其中Ascomycota占99.93%,为优势菌门,Yang Hongyan等[32]的研究结果也证明Ascomycota在泡菜的发酵中有极大的作用。泡菜母水中细菌属有7个,主要包括Lactobacillus、Raoultella、Citrobacter、Lactococcus等;泡菜母水中的真菌属主要是Kazachstania,含量超过99%。对不同发酵阶段泡菜母水中的微生物群落组成和多样性的研究发现,随着发酵代数的增加,泡菜母水中的细菌与真菌多样性呈下降趋势,微生物群落构成趋于稳定:Lactobacillus和Cyanobacteria_norank是达到稳态的泡菜母水中的主要细菌属,Kazachstania是达到稳态的泡菜母水中的主要真菌属。发酵后期泡菜母水中微生物菌群结构更为稳定,也更单一,其风味相对前几代泡菜可能更为稳定。不同代数发酵泡菜中风味物质与为微生物菌落结构变化的关系有待进一步研究。
本研究在门水平上的结果与已有研究所报道的微生物菌群呈现出较高一致性,且较全面准确地揭示了传统四川泡菜的微生物菌群结构。在属水平上微生物菌群结构与已有报道有所差异,Leuconostoc和Weissella在泡菜体系微生物多样性分析中[5,32]中多有报道,本研究中却未见检出;本研究也首次发现Kazachstania在四川泡菜中作为主要真菌属,其在泡菜发酵过程中的作用特性有待进一步探索。一般认为真菌与泡菜水中膜的形成、不良气味的产生、泡菜质地变软等有关[33],也有学者认为某些真菌有助于提高泡菜品质,有利于泡菜后熟和芳香物质的形成[30,34]。真菌在四川泡菜中的具体菌群结构、作用特性的相关报道较少,有待进一步探索。
