戴尔有孢圆酵母WA19与酿酒酵母F33混合发酵在樱桃酒酿造中的应用
2019-01-07李华敏孙舒扬黄萍萍孙雪梅车长远刘文丽
李华敏,孙舒扬*,黄萍萍,孙雪梅,车长远,刘文丽
(鲁东大学食品工程学院,山东 烟台 264025)
樱桃色泽鲜艳、味道鲜美、营养丰富且具有药用价值,但是随着引种栽培规模的不断扩大,鲜樱桃已出现供过于求的局面。由于樱桃的采摘期短,皮薄汁多,不易保存,因此极易造成鲜果的积压与腐败,由此造成的经济损失每年达上亿元[1-2]。将樱桃酿制成樱桃酒是解决上述难题的有效途径。樱桃酒富含矿物质、维生素和多酚等保健成分,具有促进血液循环、改善机体代谢、提高心脑血管功能等功效,符合国家倡导的“压缩粮食酒,发展水果酒”政策,也符合消费者追求天然、酒精度低、有益于健康的果酒趋势[3-4]。
香气是决定樱桃酒品质的重要指标,是多种挥发性化合物相互作用的结果,也是吸引消费者和增强市场竞争力的重要因素[5-7]。香气的主要来源包括樱桃品种、微生物代谢发酵以及陈酿[8]。发酵香气是樱桃酒香气构成中最重要的因素,需要多种酵母菌株(包括酿酒酵母和产香酵母)的参与。产香酵母又称产酯酵母,是一类能产生挥发性香味物质的非酿酒酵母,它能够产生大量的甘油、酯类等代谢产物,并且能够分泌蛋白酶、糖苷酶、果胶酶、脂肪酶等多种酶类,通过这些酶类的代谢作用可以将樱桃果实中的香气前体物质分解并释放出香气组分,从而赋予酒体浓郁的发酵香味,提升产品风味及感官质量[9-11]。将产香酵母与酿酒酵母混合构成发酵菌群,是目前果酒领域的研究热点。越来越多的学者开始着眼于产香酵母菌种资源的开发,以期获得优良菌种提升果酒的品质[12-13]。研究发现法尔皮有孢汉生酵母和酿酒酵母混合发酵能够增加乙酯类物质的生成,同时还可以降低乙醇含量[11,14]。美极梅氏酵母协同酿酒酵母共同发酵时,葡萄酒中的萜烯和内酯等芳香族化合物含量会明显增加[15]。假丝酵母和酿酒酵母混合发酵时可以更好地控制葡萄酒的发酵进程,促进甘油、羟基丙酮、琥珀酸的合成,使果酒的特色更加突出[16]。戴尔有孢圆酵母与酿酒酵母同时或依次进行发酵,可以提高葡萄酒中乙醇和具果香酯类物质的含量,同时能够降低乙酸的含量[17]。
樱桃酒产业在我国起步相对较晚,生产工艺尚不成熟,产品也存在一定的质量缺陷,如特征香气不明显、果香不够浓郁等[18]。使用产香酵母和酿酒酵母混合发酵能够有效解决以上问题,但是使用何种发酵菌株以及具体的发酵工艺仍亟待开发。本课题在前期研究中通过自主筛选获得了1株产酯能力优异且能够较好耐受樱桃酒发酵条件的产香酵母,经鉴定该菌株是1株戴尔有孢圆酵母(Torulaspora delbrueckii),编号为WA19。本研究以该菌株为研究对象,研究其在樱桃酒酿造过程中的变化趋势、与酿酒酵母的相互作用,以及对酒体组成、挥发性组分和感官品质的影响,分别以酿酒酵母F33单独发酵的樱桃酒、商业化戴尔有孢圆酵母Viniflora Prelude和F33混合发酵的樱桃酒为对照,深入挖掘戴尔有孢圆酵母WA19的潜力,以期为后续在樱桃酒中规模化应用该菌株奠定基础。
1 材料与方法
1.1 材料与试剂
樱桃品种为红灯,采自烟台,于2017年6月成熟并收集。基本化学成分:总糖155 g/L,总酸5.8 g/L(以苹果酸计),pH 3.82。
酿酒酵母F33(简称F33) 法国Laffort公司;戴尔有孢圆酵母Viniflora Prelude 丹麦Hansen公司;戴尔有孢圆酵母WA19(简称WA19)保藏于鲁东大学食品工程学院微生物菌种保藏中心;2-辛醇、香气物质标准品美国Sigma公司;葡萄糖、氢氧化钠、酒石酸钾钠国药集团化学试剂有限公司;其他试剂均为国产分析纯。
WL营养培养基(1 L):葡萄糖50 g,酵母粉5 g,胰蛋白胨5 g,磷酸二氢钾550 mg,氯化钙125 mg,氯化铁2.5 mg,氯化钾425 mg,硫酸锰2.5 mg,硫酸镁125 mg,溴甲酚绿22 mg,琼脂20 g,pH 6.5,121 ℃灭菌20 min[19]。
赖氨酸琼脂培养基(1 L):D-葡萄糖10 g,DL-蛋氨酸2 mg,DL-色氨酸2 mg,L-组氨酸1 mg,对氨基苯甲酸200 µg,泛酸2 mg,生物素20 µg,叶酸2 µg,烟酸400 µg,盐酸吡哆醇400 µg,核黄素200 µg,盐酸硫胺素400 µg,肌醇10 mg,硼酸500 µg,碘化钾100 µg,氯化铜40 µg,氯化铁200 µg,钼酸钠200 µg,硫酸锌400 µg,硫酸锰400 µg,磷酸氢二钾150 mg,磷酸二氢钾850 mg,氯化钙100 mg,硫酸镁500 mg,赖氨酸盐酸盐2.5 g,氯化钠100 mg,琼脂20 g,pH值自然,121 ℃灭菌20 min[19]。
YPD培养基(1 L):酵母膏10 g,蛋白胨20 g,葡萄糖20 g,琼脂20 g,121 ℃灭菌20 min。
1.2 仪器与设备
6890N-MS 5975气相色谱-质谱联用仪 美国Agilent公司;50/30 μm DVB/CAR/PDMS固相微萃取头 美国Supelco公司;LC-20A高效液相色谱仪 日本岛津公司;FE20K pH计 瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 樱桃酒酿造工艺
樱桃采摘后清洗、破碎,于20 L发酵瓶中,装液量为80%,加入50 mg/L SO2抑制果浆氧化。添加适量蔗糖使还原糖质量浓度达到210 g/L,然后接种酵母启动发酵。本研究设计3 组实验,分别为戴尔有孢圆酵母WA19与酿酒酵母F33混合发酵(WA19/F33组合),戴尔有孢圆酵母Viniflora Prelude与酿酒酵母F33混合发酵(Viniflora Prelude/F33组合),以及F33单独发酵(空白对照),具体过程如下:
混合发酵:先接种戴尔有孢圆酵母(WA19或Viniflora Prelude),接种量为106CFU/mL。戴尔有孢圆酵母WA19或Viniflora Prelude接种前需要进行活化,即在YPD培养基中28 ℃培养24~50 h。戴尔有孢圆酵母发酵48 h后接种酿酒酵母F33,接种量为300 mg/L,启动乙醇发酵。
单独发酵:仅接种戴尔有孢圆酵母F33启动乙醇发酵,不接种产香酵母。
所有发酵均于28 ℃进行,单独发酵需要6~7 d,混合发酵需要8~10 d。整个发酵过程中,监测果浆中糖度和酵母数的变化,定期搅拌循环。当樱桃酒还原糖质量浓度低于4 g/L时,离心分离出酵母菌,终止乙醇发酵,并采用膨润土-明胶法进行下胶澄清处理,再经硅藻土过滤澄清,用于后续实验分析。
1.3.2 理化指标的测定
还原糖、总酸、乙醇体积分数、挥发酸的测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》。具体如下:乙醇体积分数采用密度瓶法;还原糖采用斐林试剂法测定(以葡萄糖计);挥发酸和总酸通过氢氧化钠滴定法测定,分别以乙酸和苹果酸计。甘油参照刘锐萍等[20]采用高效液相色谱法测定。
1.3.3 微生物生长的测定
采用梯度稀释法测定酿酒酵母和戴尔有孢圆酵母在发酵过程中的生长情况。取5 mL樱桃酒样,用无菌生理盐水梯度稀释后(稀释倍数为102~108),涂布于WL营养培养基,在28 ℃好氧条件下培养48 h后计算酿酒酵母的数目。酒样经稀释后涂布于赖氨酸琼脂培养基,在28 ℃好氧条件下培养72 h后计算戴尔有孢圆酵母的数量。
1.3.4 挥发性香气物质的萃取
利用顶空固相微萃取法获得樱桃酒中的挥发性香气物质。将5 mL樱桃酒、1.5 g NaCl和5 μL 2-辛醇(内标)依次加入15 mL顶空瓶中,加盖密封,然后置于30 ℃水浴中预平衡10 min,采用50/30 μm DVB/CAR/PDMS萃取头吸附挥发性组分,萃取时间为30 min[21]。
利用气相色谱-质谱联用法对挥发性香气组分进行分离和检测。色谱柱DB-Wax(60 m×0.25 mm,0.25 µm),不分流进样。采用程序升温,初始温度为40 ℃保持2 min,6 ℃/min升温至230 ℃,持续15 min。载气为氦气,体积流量为2 mL/min。质谱仪在70 eV的电子冲击模式下进行,扫描范围为m/z 34~348,离子源温度为230 ℃。
挥发性化合物定性分析通过比较来自NIST数据库(安捷伦)的质谱光谱数据和已经被文献报道的保留指数(retention index,RI)确定。定量分析采用标准曲线法:用标准样品配制成一系列不同浓度的溶液,在与待测组分相同的色谱条件下,等体积准确进样,测量各峰的峰面积或峰高,用峰面积或峰高对样品浓度绘制标准曲线[21]。
1.3.5 樱桃酒感官评定
采用定量描述分析法对樱桃酒的香气特征进行评价。评价小组由11 人组成,包括4 男7 女,年龄21~38 岁。小组成员预先接受为期4 周的培训,第1轮熟悉樱桃酒及评价过程,初步产生描述语;第2轮以标准物或对应实物对描述语的修正、补充与完善,形成樱桃酒香气特征的描述语词汇表,包括果香、花香、醇香、发酵香、生青气味和整体香气;第3轮进行标度培训及其熟练使用训练;第4轮进行综合描述指导与训练[18]。
实验在标准品评室完成(单间小格90 cm×100 cm,低于40 dB噪音,通风良好,周围无杂物及产异味物等)。将20 mL左右的樱桃酒样品呈递给评价员,每个样品均以3位数字随机编号并随机摆放。要求品评者对样品的香气特征进行选择并打分,打分选取10 点制,即0~9(0为没气味,9为气味最强),实验重复3 次[18]。评分在0~3为低强度,3~6为中等强度,6~9为高强度。
1.4 数据处理
使用SPSS v13.0(SPSS公司,美国)对所有数据进行方差分析。利用方差分析和邓肯氏多重比较确定酒样指标间的差异。所有的变量都经标准化(1/Sdev)处理。
2 结果与分析
2.1 樱桃酒发酵对酵母菌生长的影响
在樱桃酒混合发酵过程中,先接种戴尔有孢圆酵母,因为其不耐乙醇,主要在发酵初期进行繁殖,之后再接种酿酒酵母,启动乙醇发酵直至结束。2 种酵母菌在樱桃酒中的生长状况如图1~3所示。
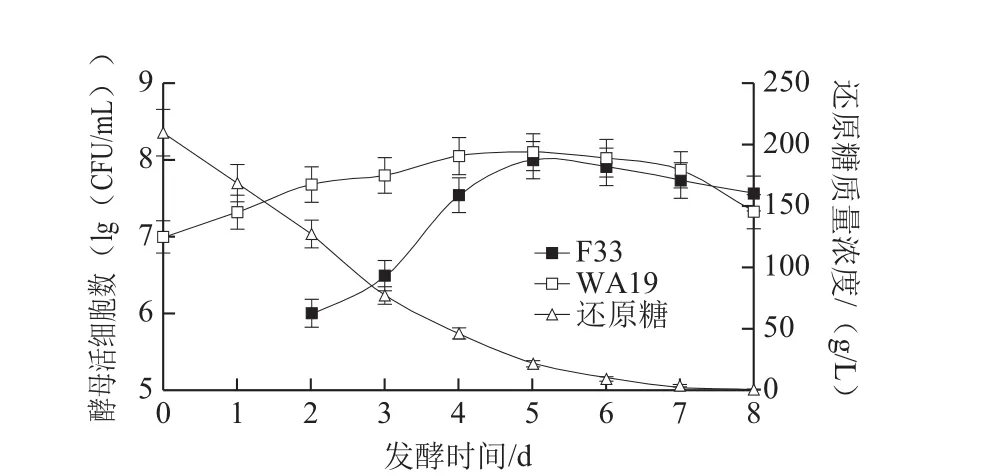
图1 WA19/F33混合发酵和还原糖代谢过程Fig. 1 Growth kinetics and sugar consumption during cherry wine-making process with mixed WA19 and F33 culture
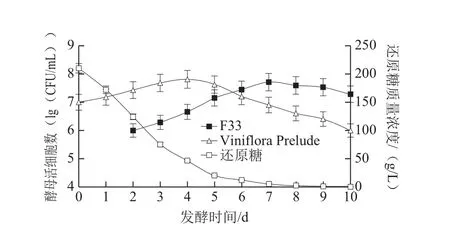
图2 Viniflora Prelude/F33混合发酵和还原糖代谢过程Fig. 2 Growth kinetics and sugar consumption during cherry wine-making process with mixed Viniflora Prelude and F33 culture
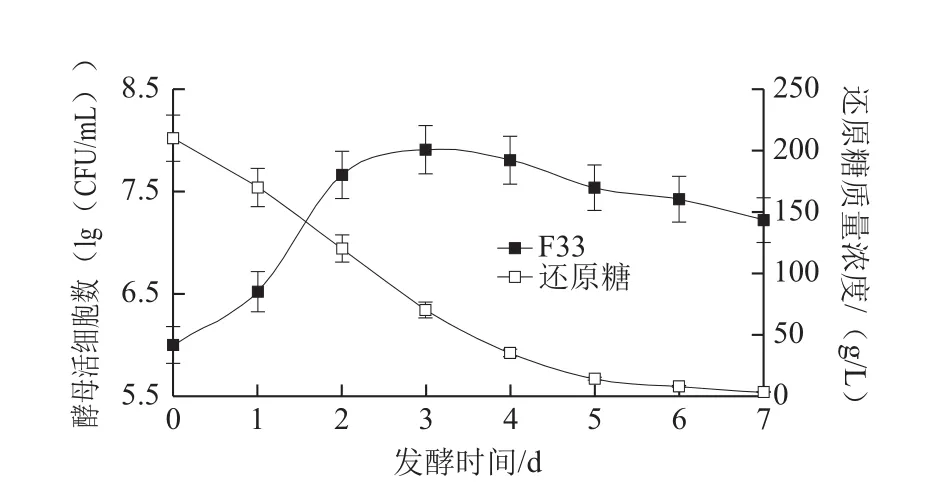
图3 F33单独发酵和还原糖代谢过程Fig. 3 Growth kinetics and sugar consumption during cherry wine-making process with pure F33
如图1所示,在樱桃酒发酵初期,WA19能迅速适应发酵环境,迅速繁殖,数量急剧增加。发酵2 d后接种F33,F33也实现了快速生长,并保持较高的发酵速率,直至第5天,活细胞数达到最高值(8.7×107CFU/mL)。WA19的活细胞数几乎也在发酵第4、5天达到峰值,为1.3×108CFU/mL。之后,F33和WA19开始衰老死亡,数量逐渐减少。由图2可知,在Viniflora Prelude/F33混合发酵对照实验中,发酵初期Viniflora Prelude也能迅速适应樱桃汁环境,实现快速增殖,但是接种F33后,其生长受到一定程度的抑制,活细胞数出现下降。F33的增殖也受到了影响,第7天活细胞数达到最高值(3.2×107CFU/mL),发酵周期较WA19/F33混合发酵延长了2 d。在另一组对照实验中(F33单独发酵),F33表现出最强的发酵动力,发酵第3天活细胞数达到最高值(7.9×107CFU/mL),整个发酵周期只有7 d(图3)。
在监测发酵过程中还原糖变化时发现,F33利用糖的能力最强,还原糖浓度自接种F33后就开始急剧下降,发酵5 d时还原糖质量浓度已低于15 g/L(图3)。在混合发酵酒样中(图1、2),还原糖质量浓度的变化趋势类似,虽然发酵初期糖质量浓度在迅速减少,但是发酵4 d后糖的消耗率开始下降,因此发酵周期也有所延长。
2.2 混合发酵对樱桃酒基本理化指标的影响
发酵结束后,离心去除酵母和发酵皮渣后测定樱桃酒的基本理化指标,结果如表1所示。
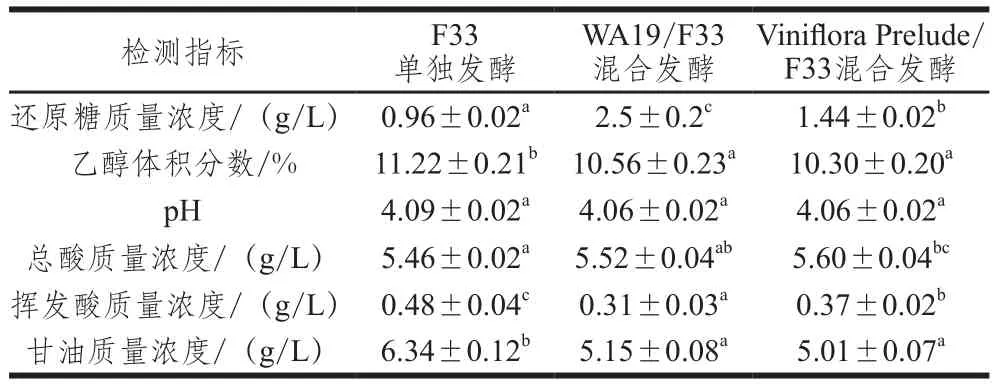
表1 樱桃酒的基本理化指标Table 1 Physicochemical properties of cherry wines
WA19/F33混合发酵、Viniflora Prelude/F33混合发酵、F33单独发酵的樱桃酒还原糖质量浓度都低于4 g/L,说明樱桃酒已发酵完全。F33单独发酵樱桃酒的乙醇体积分数和甘油含量最高,说明F33纯种发酵具有最强的还原糖转化能力和甘油合成能力。pH值在4.06~4.09之间,总酸质量浓度为5.46~5.60 g/L,在各个樱桃酒之间存在一定差异。挥发酸含量的差异最为显著,F33单独发酵樱桃酒的挥发酸质量浓度达到了0.48 g/L,而WA19/F33、Viniflora Prelude/F33混合发酵樱桃酒的挥发酸质量浓度仅为0.31 g/L和0.37 g/L。
2.3 混合发酵对樱桃酒挥发性组分的影响

表2 樱桃酒主要芳香组分的含量Table 2 Concentrations of main volatile compounds in cherry wines mg/L
由表2可知,F33单独发酵樱桃酒的挥发性香气总量为59.46 mg/L,而混菌发酵樱桃酒的挥发性组分含量明显增加,WA19/F33混合发酵为64.93 mg/L,Viniflora Prelude/F33样品为63.67 mg/L。
2.3.1 酯类
酯类是构成樱桃酒香气最重要的挥发性组分,在发酵过程中由酸类和醇类酯化形成。由表2可知,樱桃酒中检测到10 种酯类,混合发酵樱桃酒的总酯含量较高,WA19/F33组合为6.97 mg/L,Viniflora Prelude/F33为6.77 mg/L,含量最低的是F33单独发酵的樱桃酒,为5.58 mg/L。对于这10 种酯类化合物,混合发酵提升了其中6 种酯类的含量,包括丁酸乙酯、异戊酸乙酯、己酸乙酯、3-己烯酸乙酯、辛酸乙酯和乙酸苯乙酯,特别是前5 种化合物,其在混合发酵樱桃酒中的含量几乎是F33单独发酵的2~3 倍,因此混合发酵可以显著提升樱桃酒的果香,改善樱桃酒酯香不足的问题。就2 种戴尔有孢圆酵母而言,WA19更多地增加了丁酸乙酯、异戊酸乙酯、辛酸乙酯和乙酸苯乙酯的含量,而Viniflora Prelude则更多地提升了己酸乙酯和3-己烯酸乙酯的含量。
2.3.2 醇类
果酒中的挥发性醇类化合物主要来源于发酵、氨基酸的转化及亚麻酸降解物的氧化。由表2可知,在樱桃酒中共检测到7 种醇类,混合发酵樱桃酒的总醇质量浓度较高,WA19/F33混合发酵为38.85 mg/L,Viniflora Prelude/F33为37.51 mg/L,含量最低的是F33单独发酵的樱桃酒,为32.26 mg/L。2 种戴尔有孢圆酵母均明显增加了β-苯乙醇的合成量,其在WA19/F33和Viniflora Prelude/F33组合中含量分别是F33单独发酵的1.8 倍和1.6 倍。就2 种戴尔有孢圆酵母而言,WA19更多地增加了丙醇、丁醇、苯甲醇的含量,而Viniflora Prelude则更多地提升了异丁醇和异戊醇含量。
2.3.3 酸类
酸类是构成樱桃酒香气特征非常重要的贡献者,但是当其浓度过高时可能会导致樱桃酒出现奶酪味或脂肪味等不良气味,因此其含量需要控制在合适的浓度范围内。由表2可知,所有的樱桃酒中均检测到5 种酸类化合物,其中F33单独发酵酒样的总酸质量浓度最高(18.8 mg/L),其次是Viniflora Prelude/F33混合发酵(16.51 mg/L),最少的是WA19/F33组合(16.08 mg/L)。混合发酵并未增加樱桃酒中酸类物质的总量,反而使其浓度降低,尤其是乙酸、2-甲基丁酸和己酸,它们在混合发酵樱桃酒中的含量较F33单独发酵分别降低了14.7%~20%、32.8%~48.2%和16.3%~28.1%。仅有2 种酸类,即2-甲基丙酸和辛酸,在混合发酵樱桃酒中的含量超过了F33单独发酵。
2.3.4 其他芳香类
除了挥发性酯类、醇类和酸类化合物外,樱桃酒中还检测到了醛类、萜烯类和异戊二烯类芳香组分,包括乙醛、苯甲醛、里那醇和β-大马酮。由表2可知,混合发酵对醛类没有显著性影响,因为乙醛和苯甲醛的含量较F33单独发酵没有明显变化。但是混合发酵提升了里那醇和β-大马酮的含量,特别是WA19/F33组合,2 种化合物在WA19/F33混合发酵樱桃酒中含量是F33单独发酵的2.08 倍和1.43 倍。
2.4 气味活度值计算
气味活度值的计算广泛应用于食品关键气味活性化合物的筛选和鉴定上,其计算方法为化合物浓度与该物质嗅觉阈值的比值[22-23]。一般认为,气味活度值大于1,表明其对气味有贡献,气味活度值越大表明该化合物个体贡献越大。
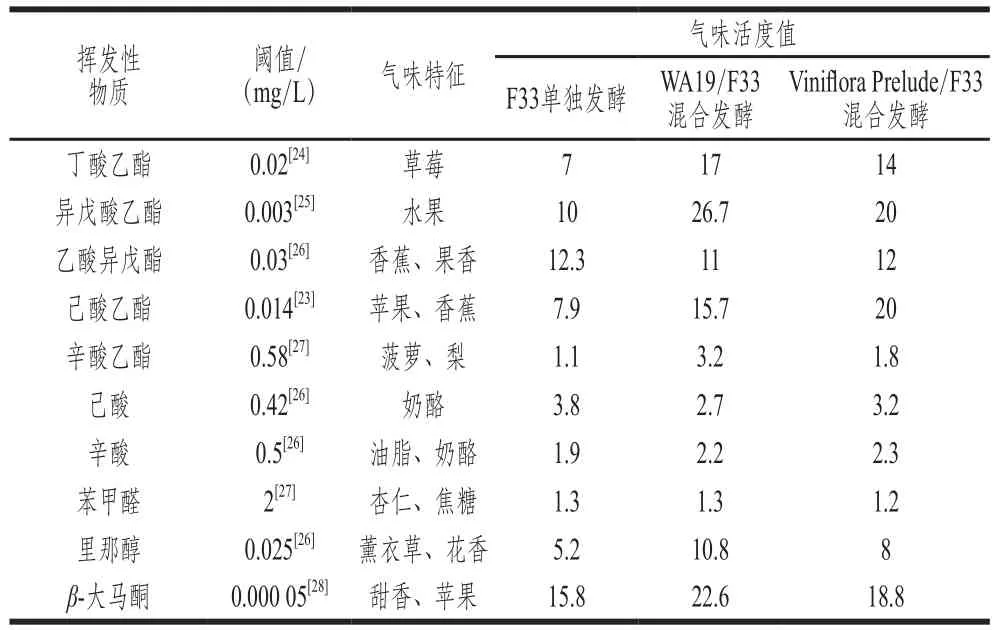
表3 樱桃酒中气味活度值大于1的芳香化合物及其气味特征Table 3 Mean values of OAV for volatile compounds with OAV > 1 in cherry wines
由表3可知,混合发酵樱桃酒中的大多数香气组分的气味活度值都高于F33纯种发酵,特别是丁酸乙酯、异戊酸乙酯、己酸乙酯、辛酸乙酯,以上这些挥发性酯类化合物具有典型的水果香气,如香蕉、苹果、菠萝、梨等[23,25],因而能够赋予樱桃酒更浓郁的果香。里那醇能够散发出类似薰衣草气味的花香[26],其在混合发酵樱桃酒中的气味活度值显著高于单纯发酵,因而可能赋予混合发酵樱桃酒更强烈的花香。由气味活度值结果可推测混合发酵樱桃应该具有更浓郁的果香和花香,风味特征会显著优于F33纯种发酵,但实际结果还需要感官评价进一步验证。
2.5 樱桃酒的感官评定结果
由图4可知,单独接种F33的樱桃酒具有中等强度的果香、醇香和发酵香,低强度的花香和生青气味,整体评价为中等。接种WA19樱桃酒的果香和花香最浓郁,同时具有中等强度的发酵香和醇香,以及低强度的生青气味,香气特征富有层次感,因此总体得分最高。Viniflora Prelude/F33组合也具有较高强度的果香,但花香、发酵香和醇香的评分不及WA19/F33组合,总体评分也低于WA19/F33。
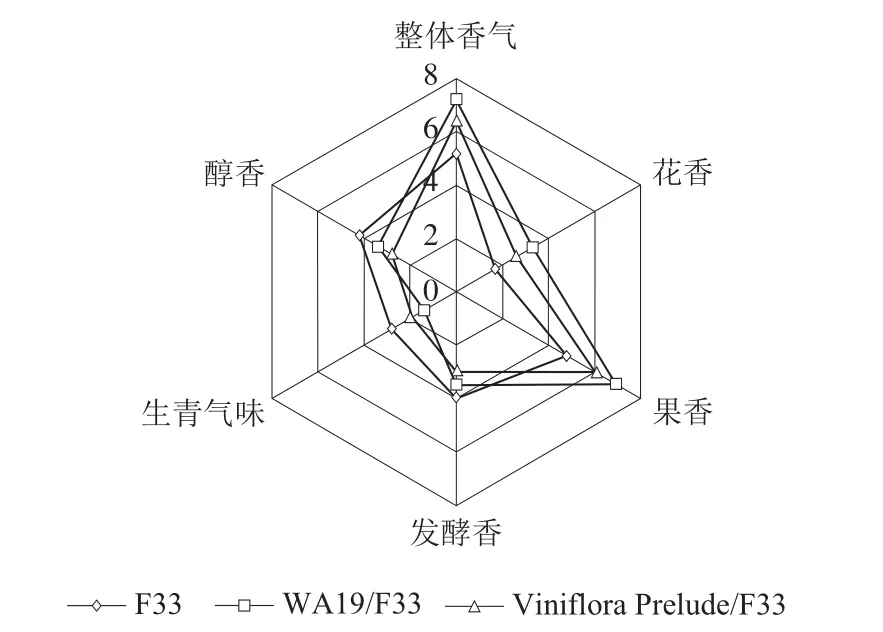
图4 樱桃酒香气品评结果Fig. 4 Sensory evaluation of cherry wines
3 讨 论
3.1 混合发酵对戴尔有孢圆酵母和酿酒酵母的影响
在戴尔有孢圆酵母WA19与酿酒酵母F33混合接种模式下,WA19在发酵前5 d一直在持续增殖,并达到了较高的菌体量。F33的最大活细胞数较其单独发酵并未减少,说明WA19与F33之间不存在明显的竞争性抑制,两者共同主导发酵进程。而在Viniflora Prelude与F33的混合发酵中,Viniflora Prelude与F33之间存在相互抑制,F33的最大活细胞数较其单独发酵减少了12.7%,而Viniflora Prelude则在接种F33后开始衰亡。据文献[29]报道,戴尔有孢圆酵母属于温和发酵型酵母,增殖速率较慢,与酿酒酵母协同发酵时容易被酿酒酵母抑制,但是一些特殊的戴尔有孢圆酵母却具有较强的弑杀酿酒酵母特性,因其分泌了某些针对酿酒酵母的毒素或其他代谢产物,导致酿酒酵母生长受到抑制。与Viniflora Prelude相比,自筛酵母WA19发酵更温和,对酿酒酵母未产生明显抑制,因此更适宜作为樱桃酒发酵的产香酵母。
3.2 混合发酵对樱桃酒基本理化指标的影响
与F33单独发酵相比,混合发酵在乙醇体积分数、还原糖、总酸含量三方面与之差异较小,但混合发酵显著降低了挥发酸的质量浓度,WA19/F33组、Viniflora Prelude/F33组合的挥发酸含量仅有F33单独发酵的64.6%和77.1%。以往的研究认为,非酿酒酵母发酵效率低、发酵不彻底,且会产生较高含量的挥发酸、乙醛等不良风味物质,会导致果酒的酸败,对果酒酿造不利。后来有研究证实,戴尔有孢圆酵母在发酵过程中不会产生大量乙酸,且与酿酒酵母混菌发酵可以增加果酒的香气复杂性,有利于果酒品质的提高[11,29]。本实验结果证实此结论,确认了2 株戴尔有孢圆酵母在降低挥发酸含量方面的优势。
3.3 混合发酵对樱桃酒香气组分的影响
不同酵母的生理活性及代谢过程不同,对风味物质的影响也不同[30]。本研究中使用的戴尔有孢圆酵母与酿酒酵母混合发酵技术能够提升樱桃酒挥发性香气组分的含量,增强樱桃酒的香气特征。WA19/F33组合、Viniflora Prelude/F33组合的香气总量均约为F33单独发酵的1.1 倍。
利用戴尔有孢圆酵母提高果酒香气组分的含量是目前果酒领域的研究热点,在葡萄酒酿造中的研究较多[29,31-32],但是涉及樱桃酒的报道很少。Lu Yi等[33]证实戴尔有孢圆酵母与酿酒酵母混合使用能够提高榴莲酒中多种挥发性酯类化合物的产量。Viana等[34]发现,戴尔有孢圆酵母具有较强的产生辛酸乙酯的能力。Comitini等[35]发现戴尔有孢圆酵母可以增大葡萄酒中β-苯乙醇的合成量。这些结论与本实验的研究结果相符。苯乙醇质量浓度的增加可能与戴尔有孢圆酵母中β-葡萄糖苷酶的活性有关,也有可能是酵母中β-葡萄糖苷酶的活性与L-苯丙氨酸的代谢共同作用的结果[29]。
Azzolini等[36]研究发现,戴尔有孢圆酵母有利于酸类的积累,但在本研究中,戴尔有孢圆酵母与酿酒酵母混合发酵却使酸类含量降低,特别是乙酸、2-甲基丁酸和己酸。乙酸含量的降低会导致樱桃酒挥发酸浓度下降,这与本实验中理化指标的测定结果一致,且对提高樱桃酒的品质有积极作用。混合发酵中酸类的下降可能是其参与合成了芳香酯类,但具体原因还需进一步研究。本实验还发现,混合发酵有利于增加里那醇和β-大马酮的含量,特别是在WA19参与的发酵中,这对于突出樱桃酒的品种香气有积极作用。Sun Shuyang等[37]发现戴尔有孢圆酵母可以提升里那醇的含量。原因在于,与酿酒酵母相比,戴尔有孢圆酵母含有更多的糖苷水解酶,更有利于水解果酒中的结合态糖苷香气物质并促进游离态香气成分的释放[38]。
在本研究中,虽然自筛的戴尔有孢圆酵母WA19和商业化戴尔有孢圆酵母Viniflora Prelude均能提高樱桃酒挥发性香气物质的合成量,但两者之间也有显著性差异。Viniflora Prelude更多地提高了己酸乙酯、3-己烯酸乙酯、异丁醇、异戊醇和辛酸的产量,而WA19更多地促进了丁酸乙酯、辛酸乙酯、乙酸苯乙酯、丙醇、丁醇、苯甲醇、β-苯乙醇、2-甲基丙酸、里那醇和β-大马酮的合成,而且WA19参与发酵的樱桃酒的香气物质总量更高。
3.4 樱桃酒感官评定与香气组分之间的关系
WA19/F33组合总体评分最高,Viniflora Prelude/F33组合次之,最低的是F33单独发酵。品评结果与本实验中挥发性香气组分测定结果基本符合,WA19/F33组合生成了丰富的酯类化合物,如丁酸乙酯、异戊酸乙酯、辛酸乙酯等,以上这些挥发性酯类化合物具有典型的水果香气,因而能够赋予WA19/F33樱桃酒更浓郁的果香。里那醇能够散发出类似薰衣草气味的花香,它在WA19/F33组合中的含量最高,因而可能赋予该樱桃酒最强烈的花香。在本研究中,接种戴尔有孢圆酵母的樱桃酒的生青气味较F33单独发酵均有所下降,推测可能是由于较高强度的果香和花香在一定程度上掩盖了生青气味。
4 结 论
本实验研究戴尔有孢圆酵母WA19和酿酒酵母F33混合发酵对樱桃酒质量的影响,以F33单独发酵樱桃酒和Viniflora Prelude/F33混合发酵樱桃酒为对照。研究结果表明,WA19能够快速适应酒体环境,迅速增殖,且不会对酿酒酵母的生长产生影响。WA19/F33混合发酵对酒体的理化指标几乎不产生影响,但是可以显著提高多种芳香化合物含量,增强其风味特征。樱桃酒感官评定的结果表明,WA19/F33混合发酵增强了樱桃酒的果香、花香和发酵香气,并在一定程度上掩盖了生青气味,使樱桃酒的香气特征更鲜明,解决了樱桃酒果香寡淡的问题。
