基于拉曼光谱解析冻藏过程中鱼糜蛋白的结构变化
2019-01-07高文宏叶瑞森潘廷跳曾新安
高文宏,叶瑞森,潘廷跳,曾新安
(华南理工大学食品科学与工程学院,广东 广州 510641)
冷冻鱼糜是生产各类鱼糜制品(鱼香肠、鱼丸、模拟蟹肉等)的原材料,是肌原纤维蛋白的浓缩物[1]。在冷冻过程中,受冰晶的机械破坏、结合水的脱离、细胞液的浓缩、次级键的新生和断裂等因素的影响,蛋白质分子发生聚集和氨基酸多肽链逐渐展开,从而导致冷冻变性,蛋白质逐渐丧失生物活性[2-4]。随着冷藏的不断进行,鱼糜蛋白物理化学性质发生变化[5]:蛋白盐溶性、总巯基含量、Ca2+-ATP酶活性等呈现下降趋势;而二硫键含量、羰基含量、表面疏水性等则呈现上升趋势。现阶段对于鱼糜蛋白冷冻变性的研究,主要集中在物理化学性质变化方面,较少涉及到微观分子结构水平,对变性的解释多数停留在假设阶段。为进一步探索蛋白质冷冻变性规律,有必要明确冻藏过程中蛋白质结构变化。
目前对蛋白质结构的研究主要采用圆二色谱、荧光光谱、核磁共振、红外吸收光谱和拉曼光谱等技术。其中,拉曼光谱是一种包含分子振动、转动及结构等信息的散射光谱,受水相干扰小,可以对固、液相样品进行快速无损检测[6-7]。该技术通过反射氨基酸或者肽链的不同种振动模式得到响应信号,能提供包含蛋白质分子二级结构和三级结构信息的光谱信息图[8-9]。作为一种新兴的研究手段,拉曼光谱技术已经被运用到监控肉类蛋白(如肌球蛋白)结构变化[10-11]。本实验基于拉曼光谱检测技术,对草鱼鱼糜进行光谱扫描并获得拉曼“指纹谱”,重点讨论鱼糜蛋白特征峰区带图谱,解析鱼糜蛋白结构变化信息,尝试在分子层面评价鱼糜蛋白冷冻变性;同时利用化学方法辅助验证蛋白冷冻变性。
1 材料与方法
1.1 材料与试剂
鲜活草鱼 市购;超微量Ca2+-ATP酶测试盒 南京建成生物工程研究所;实验所用试剂均为分析纯或生化级。
1.2 仪器与设备
YLS-86A食品加工机 中山市雅乐思电器实业有限公司;JW-3024HR高速冷冻离心机 安徽嘉文仪器装备有限公司;FJ-200高速分散均质机 上海标本模型厂;UV-1800紫外分光光度计 日本岛津制作所;HH-6数显恒温水浴锅 常州澳华仪器有限公司;HR Evolution拉曼光谱仪 美国HORIBA Scientific公司。
1.3 方法
1.3.1 鱼糜样品的制备
新鲜草鱼去头尾、鳞片以及内脏,用清水冲洗干净,选取白肉放入食品加工机中绞碎,得到碎肉分别进行清水和(0.15%)盐水漂洗(温度10 ℃以下,每次搅拌5 min,静置3 min)后用纱布进行脱水(水分质量分数控制在80%),得到新鲜鱼糜定型于圆柱形铝制模具(半径2 cm,高1.5 cm),封口袋包装后置于-18 ℃冻藏。整个加工过程用碎冰控制温度。分别对新鲜鱼糜样品、冻藏2 周和冻藏8 周鱼糜样品进行数据采集。
1.3.2 盐溶性蛋白含量的测定
参照杨利艳等[12]的方法,略作修改。2 g鱼糜添加20 mL磷酸缓冲液(I=0.05,pH 7.5),充分匀浆30 s,4 ℃、6 000 r/min离心10 min,弃去上清液。重复上述步骤1 次。所得沉淀添加20 mL Weber-Edsall溶液(0.6 mol/L KCl-0.01 mol/L NaCO3-0.04 mol/L NaHCO3),充分匀浆30 s,置于4 ℃提取20 h,4 ℃、6 000 r/min离心10 min,上清液用双缩脲法测定盐溶性蛋白含量。
1.3.3 肌原纤维蛋白液的提取
参照胡耀辉等[13]的方法,略作修改。2 g鱼糜添加20 mmol/L Tris-maleate溶液(pH 7.0,内含0.05 mol/L KCl),充分匀浆30 s,4 ℃、9 000 r/min离心10 min,弃去上清液。所得沉淀添加20 mmol/L Tris-maleate溶液(pH 7.0,内含0.5 mol/L KCl),充分匀浆30 s,置于4 ℃提取1 h,4 ℃、6 000 r/min离心10 min,上清液为肌原纤维蛋白液。
1.3.4 巯基含量的测定
参照张静雅等[14]的方法,略作修改。肌原纤维蛋白液稀释至4 mg/mL,取0.5 mL稀释蛋白液加入4.5 mL 0.2 mol Tris-HCl缓冲液(内含8 mol脲素、2%十二烷基硫酸钠、10 mmol/L EDTA,pH 6.8),混匀后取出4 mL混合液加入0.4 mL 0.1%的5,5’-二硫代双(2-硝基苯甲酸),40 ℃水浴25 min,于波长412 nm处测定吸光度。空白组用0.6 mol/L KCl溶液代替。按下式计算巯基含量,以105g蛋白中含有巯基的物质的量计:
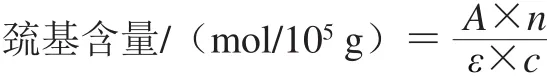
式中:A为波长412 nm处的吸光度;n为稀释倍数;ε为分子吸光系数13 600L/(mol·cm);c为蛋白液质量浓度/(mg/mL)。
1.3.5 Ca2+-ATP酶活力测定
采用南京建成生物工程研究所超微量Ca2+-ATP酶测试盒测定,以每小时每毫克蛋白质产生无机磷的量(μmol/(mg·h))表示。
1.3.6 拉曼光谱扫描
将少量鱼糜样品平铺在玻璃片上,置于载物台上进行拉曼光谱扫描。采用氩离子激光器作为拉曼扫描光源,激光波长为633 nm,拉曼位移波数范围为350~3 500 cm-1,采集时间为10 s,累积2 次。每个样品取3 个点扫描,最终拉曼光谱曲线取3 次结果的平均值。采用拉曼设备配套软件LabSpec 6对光谱进行基点校正并扣除荧光背底,以(1 004±2)cm-1(苯丙氨酸残基在该峰位处保持稳定振动[15])处峰位为内标进行归一化。
1.4 数据处理
蛋白质二级结构定量通过Peakfit 4.12软件进行峰的分离和曲线拟合,数据采用Origin 9.0软件进行数据绘图。
2 结果与分析
2.1 草鱼鱼糜盐溶性蛋白、巯基和Ca2+-ATP酶活力的变化
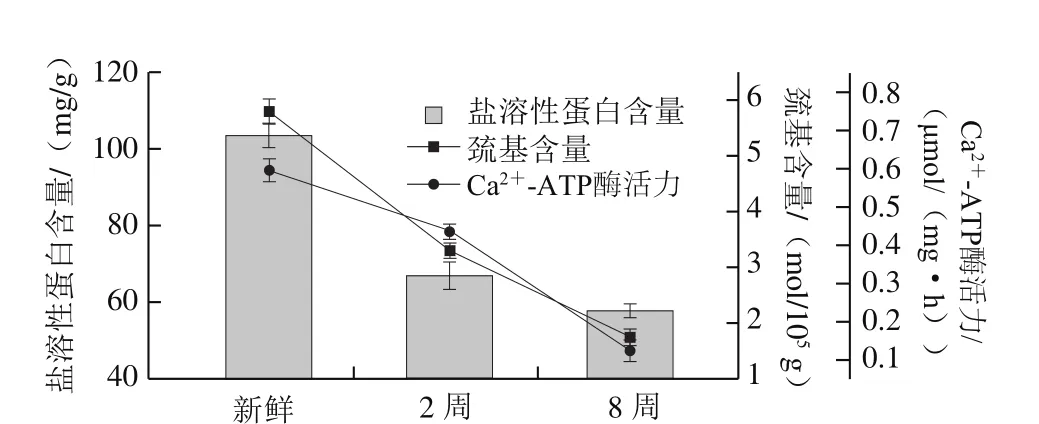
图1 草鱼鱼糜盐溶性蛋白、巯基和Ca2+-ATP酶活力变化Fig. 1 Changes in salt-soluble protein, sulfhydryl content and Ca2+-ATPase activity of grass carp surimi
在冻结和冻藏过程中,肌动球蛋白受大冰晶破坏以及蛋白水化层的消解等作用而发生冷冻变性,主要表现在蛋白杆部性质变化、盐溶解性下降[16-17]。而肌动球蛋白是肌原纤维蛋白的重要组成部分,所以蛋白盐溶性是反应鱼糜蛋白冷冻变性的常用指标。同时随着蛋白冷冻变性的不断深入,蛋白分子之间生成疏水键和氢键等非共价键,生成超大的不溶性聚合体,盐溶性蛋白含量减少[4]。由图1可知,新鲜、冻藏2 周以及冻藏8 周的鱼糜盐溶性蛋白含量分别为103.61、66.83 mg/g和57.66 mg/g,冻藏2 周和冻藏8周分别下降了35.50%和44.35%。可见,冻藏前2 周造成盐溶性蛋白含量大幅下降(36.78 mg/g),后2~8 周又持续小幅下降了9.17 mg/g。
巯基含量的减少也是鱼糜蛋白冷冻变性的重要体现。随着冻藏时间的延长,巯基含量从新鲜鱼糜的5.79 mol/105g下降到第2周的3.30 mol/105g,至冻藏8 周结束,巯基含量为1.74 mol/105g,下降幅度达69.95%。蛋白分子的聚集和变性引起巯基的暴露,使得巯基逐渐被氧化成二硫键,从而进一步改变蛋白分子的空间构型,加剧蛋白的冷冻变性。同时,在肌球蛋白活跃区域的巯基与Ca2+-ATP酶活力密切相关[18]。
Ca2+-ATP酶活力是反映肌球蛋白完整的主要探针,在一定程度上反映了蛋白的冷冻变性,其活性越高,说明蛋白品质越高[19-20]。Ca2+-ATP酶活力在冻藏过程中不断下降,新鲜、冻藏2 周以及冻藏8 周分别为0.60、0.44、0.13 μmol/(mg·h),冻藏2 周和冻藏8 周的下降幅度分别达到26.67%和78.33%。
2.2 草鱼鱼糜蛋白拉曼光谱图
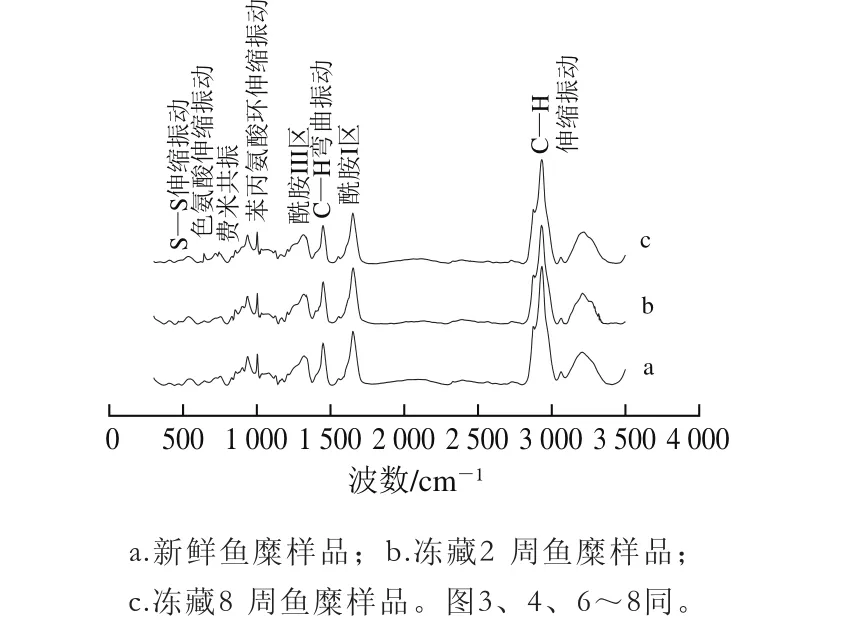
图2 草鱼鱼糜蛋白拉曼图谱Fig. 2 Raman spectra of grass carp surimi proteins
如图2所示,鱼糜蛋白空间构象与氨基酸残基微环境的变化主要集中在500~1 800 cm-1(指纹图谱区)和2 800~3 050 cm-1(C—H伸缩振动区)体现。通过对比鱼糜样品在上述2 个重要拉曼谱带的特征峰峰位和相对峰强度信息,可以解释冻藏对草鱼鱼糜蛋白结构变化的具体影响。鱼糜蛋白拉曼光谱区带的指认[10-11,15,21],如表1所示。

表1 草鱼鱼糜蛋白拉曼光谱中谱带归属Table 1 Tentative assignment of selected bands in the Raman spectra of grass carp surimi proteins
2.3 蛋白质主链构象

图3 草鱼鱼糜蛋白酰胺III区拉曼图谱Fig. 3 Raman spectra in amide III region of grass carp surimi proteins
拉曼特征光谱中酰胺III区(1 230~1 350 cm-1)是构象灵敏的谱带区。该谱带区域能提供多肽链主链构象的振动信息[21],包括C—N伸缩振动、N—H面内弯曲振动、Cα—C伸缩振动以及C=O面内弯曲振动。另外,图谱中蛋白二级结构中的α-螺旋结构、多种形式的C—H弯曲振动以及芳香环的振动信息也反映了碳骨架的主链构象。
如图3所示,新鲜、冻藏2 周以及冻藏8 周的鱼糜蛋白拉曼峰分别出现在1 320、1 320、1 315 cm-1处,相对峰强为0.949 7、0.960 7、0.902 4。冻藏前2 周,该处拉曼峰峰位置未出现变化。而随着冻藏时间继续延长,鱼糜蛋白在酰胺III区的拉曼峰逐渐向小波数方向偏移。至8 周冻藏期结束,拉曼峰位偏移了5 cm-1,整体峰强的减小,说明鱼糜蛋白中α-螺旋结构减少。但冻藏2 周鱼糜样品的拉曼峰峰强有所上升,尚未得到很好的解释。鱼糜蛋白二级结构中β-折叠谱带(1 230~1 245 cm-1)和无规卷曲谱带(1 240~1 255 cm-1)部分重叠,使得酰胺III区的解析相对困难。冻藏2 周以及冻藏8 周相比新鲜鱼糜蛋白,在1 250 cm-1附近中均形成了拐角,峰形坡度有所减缓,并且冻藏8 周的减缓趋势更加明显。有研究表明[11],在1 250 cm-1和1 315 cm-1附近形成的谱带分别是由肌球蛋白的球形结构和纤维状结构的头部和尾部区域的α-螺旋结构引起的。蛋白质分子的冷冻变性、巯基的氧化、水分子-蛋白质分子间氢键的变化,造成了蛋白质原有的二级结构和空间构象的破坏。
碳链骨架中C—C伸缩振动能引起940 cm-1(图3)附近拉曼峰的变化,是α-螺旋结构在拉曼光谱上的另一个重要体现。该峰的相对强度从新鲜状态的0.931 8下降到冻藏8 周后的0.891 3,相对强度下降幅度达到了4.37%。蛋白质α-螺旋结构的破坏并逐步向β-折叠和无规卷曲的转变,导致了该区段谱带信号减弱。
2.4 二级结构定量结果
酰胺I区(1 600~1 700 cm-1)对蛋白质二级结构的解析提供了更加丰富的信息。这个谱带区域不仅含有C=O伸缩振动的信息,还提供了多肽链基团内部的C—N伸缩振动、Cα—C—N弯曲振动以及N—H面内弯曲振动的信息[22]。鱼糜蛋白的二级结构对其的加工特性影响显著[23]:α-螺旋结构的含量与加工中的凝胶强度密切相关;β-折叠结构则提供了鱼糜凝胶的硬度;β-转角和无规卷曲结构则不能促使生成有序的凝胶网状结构。一些拉曼光谱和红外光谱的蛋白质解析工作发现[24-25],酰胺I区的谱带信息与蛋白质主链构象和二级结构的定量相关。多肽链分子的天然构象决定了肽链-肽链分子间的氢键易改变,造成了酰胺I区的图谱信息的改变。
蛋白质中二级结构含量的不同,会影响其在酰胺I区的峰形[9,26-27]:α-螺旋结构含量高的蛋白在该谱段的峰会集中在1 645~1 657 cm-1之间,β-折叠结构含量高的会集中在1 665~1 680 cm-1之间,而1 660 cm-1之间附近的拉曼峰则预示蛋白质无规卷曲结构含量高。代表蛋白不同二级结构的拉曼峰存在一定程度的峰位重叠的现象,造成了各二级结构定量上的困难。实验中通过去卷积、求二阶导和曲线拟合的方法对拉曼峰进行分峰处理,得到单个峰位信息。
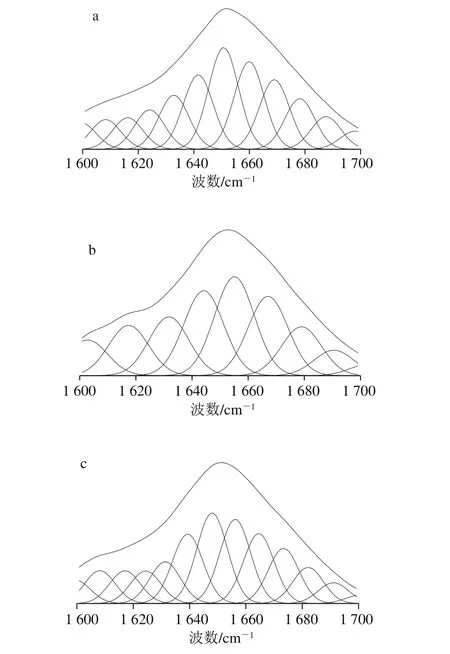
图4 草鱼鱼糜蛋白酰胺I区分峰和迭代拟合曲线Fig. 4 Segregated and iterative curve-fitted Raman bands in amide I region of grass carp surimi proteins
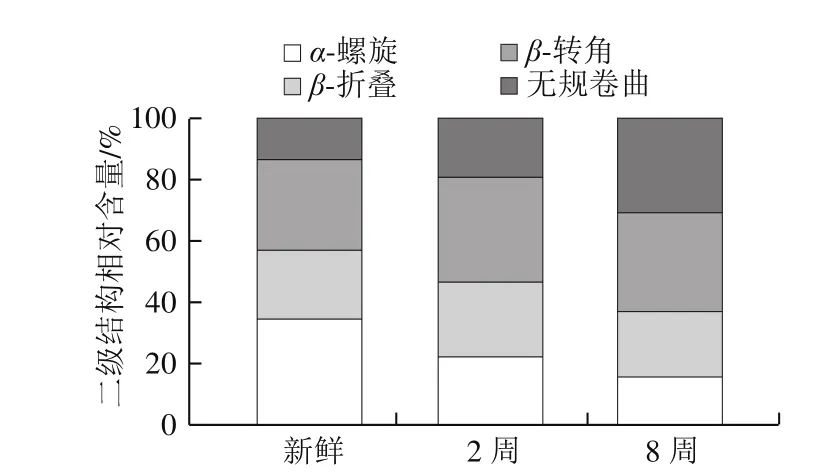
图5 草鱼鱼糜蛋白酰胺I区二级结构相对含量Fig. 5 Secondary structure contents from amide I band region of grass carp surimi proteins
通过Peakfit 4.12软件对酰胺I区进行峰分离和曲线迭代拟合处理得到图4,然后对比不同二级结构对应的峰的峰面积[27-28],计算出草鱼鱼糜蛋白二级结构的相对含量,如图5所示。新鲜的鱼糜与冻藏2 周和8 周的鱼糜相比,α-螺旋含量逐步下降,由新鲜时相对含量34.31%下降到冻藏第2周的22.18%,至冻藏第8周时,α-螺旋相对含量下降到15.33%。可以看出,α-螺旋在冻藏初期(2 周内)剧烈下降,降幅达到12.13%,接下来6 周冻藏降幅为6.85%,下降速率减慢。新鲜、冻藏2 周以及冻藏8 周β-折叠相对含量分别为22.68%、24.33%和21.57%。冻藏过程中,β-折叠相对含量先略微升高后又下降,这可能是由于冻藏初期蛋白分子内或分子间的氢键作用力增强,引起β-折叠相对含量升高,而冻藏后期蛋白持续变性又引起氢键的变化。无规卷曲的相对含量持续增加,由新鲜鱼糜的13.47%上升到冻藏8 周的30.89%,而β-转角相对含量的变化不明显。
2.5 酪氨酸和色氨酸残基微环境
2.5.1 酪氨酸残基
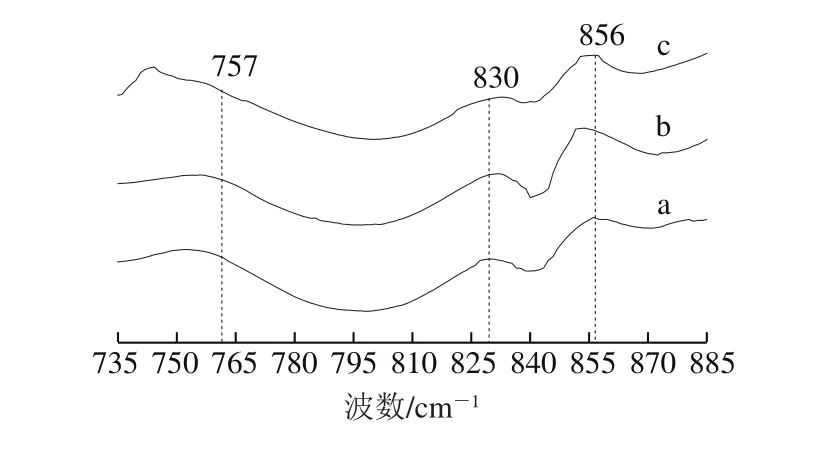
图6 草鱼鱼糜蛋白氨基酸残基微环境拉曼图谱Fig. 6 Raman spectra of amino residue microenvironments from grass carp surimi proteins
酪氨酸残基上对位取代苯环的振动能在830 cm-1和850 cm-1附近形成费米共振双峰,此双峰与基团所处的微环境和酚羟基间的氢键作用力有关[29],I850/I830反映酪氨酸残基处于“包埋”或者“暴露”状态,是监控酪氨酸残基微环境的有效探针。当I850/I830值介于0.7~1.0时,酪氨酸残基处于“包埋”状态,表明酪氨酸疏水性基团相互聚集,形成疏水核并被埋藏在多肽链内部;当I850/I830值低于0.3,表明酪氨酸残基中存在强的氢键作用力;当I850/I830值大于1.0时,表明酪氨酸残基暴露在水相或者极性的微环境中。新鲜、冻藏2 周和冻藏8 周鱼糜样品的I850/I830值分别为1.81、1.89和1.99,如图6所示,草鱼制成鱼糜样品后酪氨酸已经处于极性的水相微环境。这可能与加工过程中漂洗步骤有关,低温清水和盐水的漂洗使鱼糜蛋白处于极性的水相环境中,疏水核受水相环境的影响逐渐打开,由“包埋”向“暴露”状态的转变。随着冻藏的深入,冷冻造成的蛋白结构的改变使酪氨酸更加暴露在多肽链表面,鱼糜样品的I850/I830值上升。
2.5.2 色氨酸残基
拉曼光谱中757 cm-1和1 340 cm-1附近区域能表征色氨酸残基的微环境,I757下降(图6)以及I1340下降(图3)都反映了色氨酸残基的暴露[21,30]。冻藏能引起I1340强度的下降,新鲜、冻藏2 周和冻藏8 周该值分别为0.869 0、0.872 1和0.758 9,说明8 周冻藏使色氨酸残基从包埋的疏水性环境中暴露到极性环境。I757先由新鲜的0.275 1降至第2周的0.231 1,也印证了色氨酸残基的暴露,但是该值在冻藏8 周没有持续下降,反而升至0.261 7。这可能是757 cm-1附近色氨酸残基微环境谱带与755 cm-1附近的脂肪族氨基酸残基振动谱带相互重叠造成的。
2.6 二硫键的变化
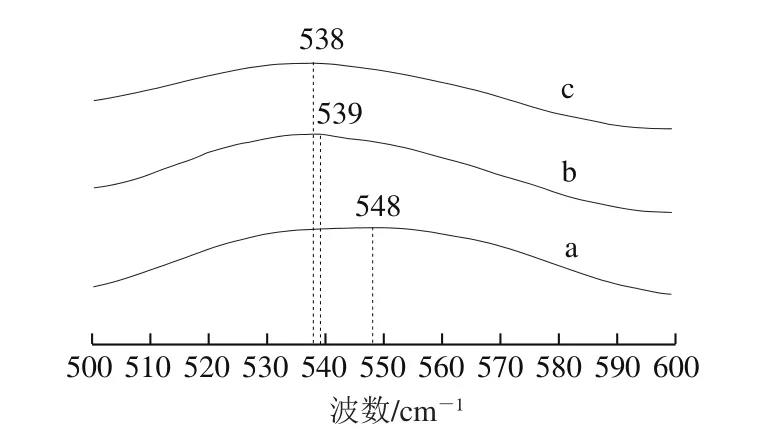
图7 草鱼鱼糜蛋白二硫键伸缩振动拉曼图谱Fig. 7 Raman spectra of the stretching vibrations of disulfide bonds from grass carp surimi proteins
二硫键的特征振动谱带在500~550 cm-1附近,并且与分子内部和分子间的巯基/二硫键相互转化有关。此谱带的巯基/二硫键高密度区域能形成多种形式的非网状交联结构。在525 cm-1和545 cm-1附近的振动分别为二硫键扭式-扭式-反式和反式-扭式-反式构象形式[9,26]。由图7可以看出,新鲜鱼糜蛋白的在548 cm-1处出现拉曼峰,这表明未经冻藏的鱼糜蛋白二硫键主要为反式-扭式-反式构象。冻藏2 周后二硫键的拉曼峰向小波数(扭式-扭式-反式构象谱带)移动至539 cm-1处,至冻藏8 周结束,拉曼峰移动至538 cm-1处。峰位的变化可能是由于部分二硫键的构象在冻藏初期(2 周内)由反式-扭式-反式向扭式-扭式-反式的转变,冻藏2~8 周基本维持不变。随着冻藏的深入,二硫键构象持续变化不大。
2.7 芳香族氨基酸C—H伸缩振动
芳香族氨基酸、多肽和蛋白质的C—H伸缩振动会在2 900 cm-1附近形成强烈的谱带。拉曼图谱中2 933 cm-1处形成尖峰,这是由CH3的对称伸缩振动或者CH2非对称伸缩振动引起的,而在2 874 cm-1附近形成的次峰则是由CH2非对称伸缩振动引起的[21]。C—H伸缩振动形成的拉曼峰峰强的变化可能与羟基链在极性环境中暴露有关。另有研究[22]猜测α-螺旋结构的展开使得芳香族氨基酸暴露,造成脂肪族氨基酸的C—H基团间的疏水作用力增强。同时,C—H伸缩振动拉曼峰的长宽比与蛋白质的疏水性和功能特性(如乳化性)有关[31]。
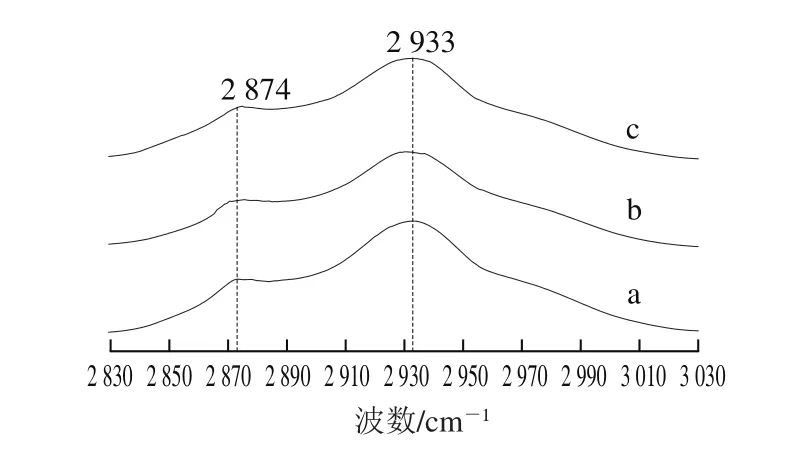
图8 草鱼鱼糜蛋白芳香氨基酸C—H伸缩振动拉曼图谱Fig. 8 Raman spectra of C—H stretching vibrations of aromatic amino acid from grass carp surimi proteins
如图8所示,经过8 周的冻藏,I2874和I2933从新鲜的1.908 1和3.868 7分别下降到1.721 5和3.352 6,降幅达到9.78%和13.34%。在鱼糜冻藏期间,由于肌原纤维蛋白的冷冻变性,造成蛋白质主链构象的变化以及多肽链展开,促使芳香族氨基酸侧链不断暴露,形成疏水相互作用力,进而又导致蛋白质二级和三级结构不断变化,蛋白质逐步丧失其功能特性。
3 结 论
草鱼鱼糜拉曼光谱中酰胺III区和940 cm-1峰形和峰强有效提供鱼糜蛋白主链构象信息,冻藏过程中鱼糜蛋白α-螺旋结构减少,蛋白构象由有序向无序逐渐转变;且酰胺I区分峰、曲线拟合计算进一步说明这种无序化与无规卷曲的相对含量增加有关。I757、I1340和I850/I830变化,色氨酸和酪氨酸残基暴露程度逐渐加深。表征二硫键构象的拉曼峰向小波数方向移动,冻藏可能造成部分二硫键由反式-扭式-反式构象向扭式-扭式-反式构象转变;C—H伸缩振动峰I2933的减弱,芳香族氨基酸疏水相互作用力增强。另一方面,本实验通过对不同冻藏期草鱼鱼糜化学指标的检测,验证冻藏引起鱼糜蛋白的冷冻变性。综上,拉曼光谱技术能够有效评价冷藏对鱼糜蛋白结构的影响,是利用化学特性评价冷冻鱼糜蛋白体系的另一重要补充,从蛋白结构和化学键变化等方面更加微观具体地评价冷冻变性。
