叶酸-壳聚糖修饰姜黄素纳米脂质体的制备及其性质
2019-01-07朱雨晴邹立强
朱雨晴,刘 伟,陈 兴,成 策,邹立强*
(南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047)
姜黄素是一种从姜黄根茎中提取的多酚化合物,在食品和化学工业中,常作为着色剂、香料和防腐剂,过去数千年,南非人也将姜黄素当做药物使用[1-2]。姜黄素具有诸多生理活性,如抗肥胖、抗氧化、抗炎症、抗病毒和抗癌症等[3-5];姜黄素还可以调控蛋白质的聚集程度从而降低蛋白质聚集物的毒性[2];有研究报道姜黄素可以影响脂质代谢,从而减轻高血脂和动脉粥样硬化的风险[6],因此姜黄素近年来已成为研究热点。然而,姜黄素的水溶性和热稳定性较差,对光和pH值敏感,在生理环境下不稳定,生物可利用率低,限制了其在食品和制药工业中的应用[7]。随着包埋技术的发展,水凝胶、胶束、复合物纳米粒子、乳液和脂质体等被用来包埋姜黄素[8],旨在提高其生物利用率和扩大其应用范围。
脂质体是一种自组装的球形囊泡,包含磷脂双分子层和疏水性空腔,具有无毒、生物可降解以及无过敏性等特点,可以用于包埋和运载多种药物、营养素、功能性因子,从而提高这些生物活性物质的稳定性和生物可利用率[9-12]。然而,脂质体也存在较多缺陷[13-14]。首先,在加工和贮藏过程中容易发生聚集,导致药物泄漏;其次,磷脂稳定性较差,使得脂质体在体内的生物半衰期较短;再者,脂质体表面缺乏与细胞表面受体蛋白结合的官能团,靶向性差。为弥补传统脂质体的这些缺陷,修饰剂可通过形成生物黏附和聚合层对脂质体表面进行修饰,改善脂质体的性质[15]、壳聚糖[16-17]、聚合物电解质[18]、蛋白质[19]、聚乙二醇[20]等都是常见的修饰剂。
壳聚糖是迄今自然界中发现的唯一带正电的多糖,化学名为(1→4)-2-氨基-2脱氧-β-D-葡聚糖。由葡萄糖胺共聚物和N-乙酰葡萄糖胺通过β-(1-4)糖苷键组成,大多存在于微生物中,壳聚糖具有良好的生物相容性、生物可降解性和黏附性[11,21]。有研究表明,壳聚糖包裹可以提高脂质体的稳定性和适用性[16,22-23]。叶酸,即蝶酰谷氨酸,是人体必需的B族维生素,且叶酸受体在多种肿瘤细胞中过量表达,叶酸修饰可赋予细胞一定的靶向性。在N-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳乙二胺盐酸盐的催化作用下,壳聚糖分子的氨基可以和叶酸发生酰化反应产生叶酸-壳聚糖复合物(folic acidchitosan,FA-CS),其反应原理如图1所示[24]。壳聚糖分子带大量正电荷,FA-CS可通过静电相互作用吸附在带负电的纳米脂质体表面形成一种新的运载体系,即叶酸-壳聚糖修饰纳米脂质体(folic acid-chitosan-nanoliposomes,FA-CS-NLs)。
本实验室前期已经采用薄膜分散法结合动态高压微射流法成功制备姜黄素纳米脂质体(nanoliposomescurcumin,NLs-Cur),并发现脂质体具有较好缓释性、pH值和金属离子稳定性,但是存在细胞摄取量低的问题[25]。为进一步提高细胞摄取量,本实验以叶酸和壳聚糖为原料合成FA-CS,用于脂质体的修饰,得到FA-CS-NLs运载体系,用于运载姜黄素,并对其贮存稳定性、缓释性能、细胞毒性及细胞摄取量进行考察。
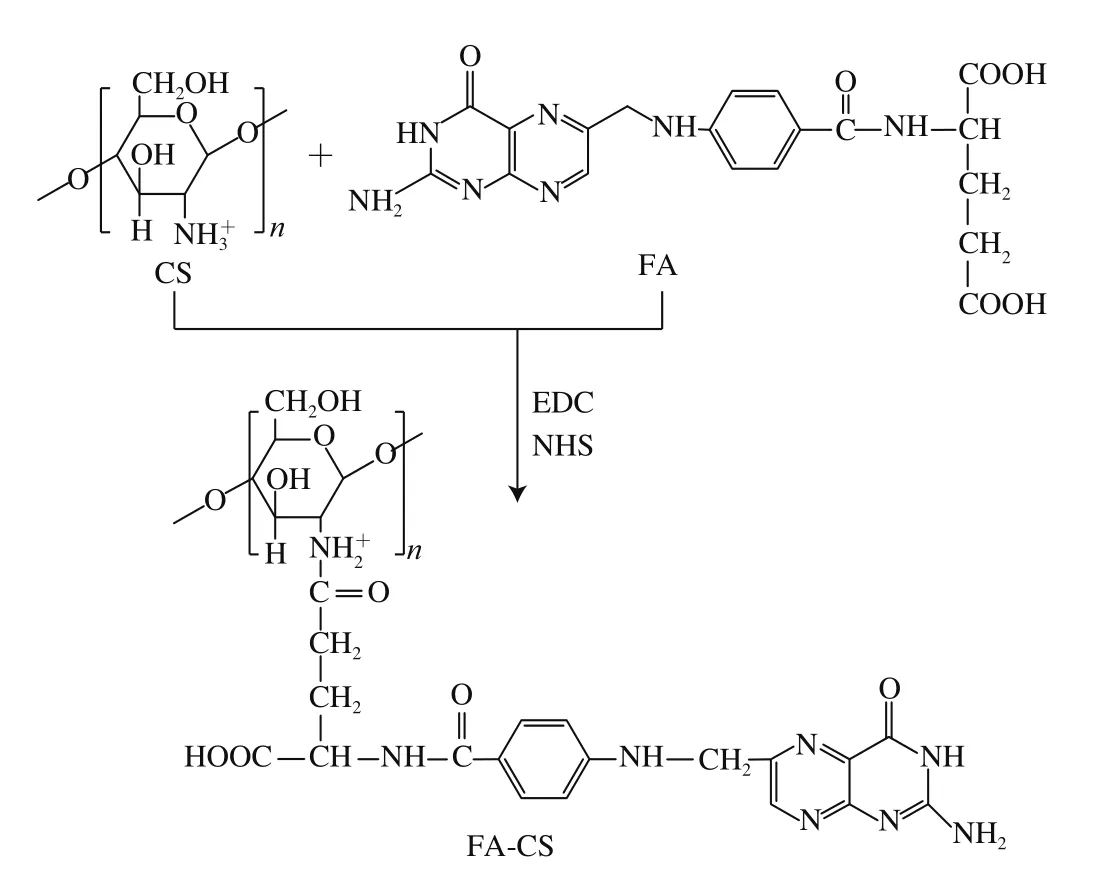
图1 FA-CS合成原理图Fig. 1 Synthetic route of FA-CS complex
1 材料与方法
1.1 材料与试剂
壳聚糖(mw50 000 Da,脱乙酰度90%) 美国Sigma-Aldrich公司;叶酸(D1525009)、1-(3-二甲氨基丙基)-3-乙基碳乙二胺盐酸盐(D1525009)、N-羟基琥珀酰亚胺(C1427075)、姜黄素(纯度98%) 阿拉丁试剂上海有限公司;大豆磷脂(phospholipid S75) 德国Lipoid GmbH公司;胎牛血清 美国Gibco公司;DMEM高糖培养基 北京索莱宝科技公司;其他试剂均为分析纯。
1.2 仪器与设备
M-110动态高压微射流 美国Microfluidic公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;Nicomp 380ZLS激光纳米粒度仪 美国Santa Barbara公司;5500原子力显微镜 美国安捷伦科技有限公司;3110 CO2恒温培养箱 美国Thermo Fisher科技公司;IX51-A12PH倒置荧光显微镜 日本Olympus公司;EPOCHh2酶标仪 美国BioTek公司。
1.3 方法
1.3.1 FA-CS的合成及叶酸偶联率的测定
FA-CS的合成:参考Yang Kuikun等[24]的方法,以1-(3-二甲氨基丙基)-3-乙基碳乙二胺盐酸盐与N-羟基琥珀酰亚胺为催化剂,反应物中叶酸与壳聚糖的最终物质的量(mol)比分别为0.02、0.06和0.12。反应结束后将产物pH值调至9.0,并转移至截留分子质量为10 kDa的透析袋中透析4 d,每4 h换一次水。透析结束后,将混合物冻干,得到黄色海绵状叶酸壳聚糖复合物。FA-CS的制备过程均在避光的环境下进行。
叶酸偶联率的测定:将适量的FA-CS冻干物溶解于醋酸-醋酸钠缓冲液中,用醋酸-醋酸钠缓冲液稀释到适当倍数后,采用紫外分光光度计于363 nm波长处测定其吸光度,并根据标准曲线(y=0.015x+0.001 5,R2=0.999 8)计算叶酸含量,标准曲线线性范围为5~30 μg/mL。根据公式(1)计算叶酸偶联率:

1.3.2 NLs-Cur、叶酸-壳聚糖修饰姜黄素纳米脂质体(folic acid-chitosan-nanoliposomes-curcumin,FA-CSNLs-Cur)的制备
NLs-Cur的制备:在实验室之前的研究方法[25]上稍作修改,采用薄膜分散法结合动态高压微射流法制备姜黄素脂质体。将姜黄素、大豆磷脂、胆固醇和吐温-80以1∶28∶4.4∶8的质量比溶于无水乙醇后,转移至圆底烧瓶中,在45 ℃水浴中进行真空旋转蒸发以除去乙醇,将pH 6.5的磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓慢倒入圆底烧瓶中,45 ℃洗膜后得姜黄素粗脂质体。粗脂质体用微射流在120 MPa的压力下处理2 个循环,制备出NLs-Cur。
FA-CS-NLs-Cur的制备:将FA-CS溶于1%的醋酸溶液中,调pH值至5.5,制得5g/L的FA-CS溶液。将NLs-Cur逐滴加入到叶酸壳聚糖溶液中,于100 r/min持续搅拌反应2 h,即得FA-CS-NLs-Cur,FA-CS与磷脂的质量比为1∶16.8。
1.3.3 原子力显微镜观察FA-CS-NLs-Cur的微观形貌
原子力显微镜的分辨率可达0.1 nm,与其他电子显微镜相比,制样快速简单,可以使得被测样品保持原来的状态。参考实验室之前的研究方法[26],将脂质体稀释适当倍数后,先将云母片平稳地固定在培养皿内,移取1滴脂质体滴于干净的云母片中央,待液滴自然摊开风干后,将其转移至原子力显微镜下采用轻敲模式进行观察。
1.3.4 FA-CS-NLs-Cur的贮存稳定性
将NLs-Cur和FA-CS-NLs-Cur贮存在25 ℃恒温箱中,每隔7 d分别测定粒径、电位、分散系数和姜黄素总量的变化,连续观测28 d。所有的样品均用超纯水稀释10 倍后,参考实验室之前的研究方法[26],采用激光纳米粒度仪分别测定25 ℃样品的粒径、电位、分散系数,光检测角度为90°。贮存过程中姜黄素总量用紫外分光光度法测定,取样品100 μL用无水乙醇稀释100 倍,于421 nm波长处测吸光度,根据姜黄素标准曲线计算姜黄素的量。姜黄素标准曲线方程为y=0.130 4x+0.002,R2=0.999 5,线性范围为0.25~10 μg/mL。
1.3.5 FA-CS-NLs-Cur的体外释放
参考实验室之前的研究方法[25]对FA-CS-NLs-Cur的释放性能进行评估。分别取4 mL NLs-Cur和FA-CS-NLs-Cur于截留分子质量为10~12 kDa的透析袋中,分别至于100 mL含0.5%吐温、20%乙醇的PBS(pH 5.5/pH 7.4)混合液中,37 ℃透析24 h。分别于1、2、4、6、8、10、12、24 h取透析液于421 nm波长处测定吸光度,计算姜黄素的含量。
1.3.6 FA-CS-NLs-Cur的细胞毒性与细胞摄取
细胞毒性的测定:采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide,MTT)比色法评估各组药物对结肠癌细胞的毒性[25]。取对数期的细胞,经胰蛋白消化酶消化后,通过血球计数板计数并用新鲜培养基稀释至2×104cells/mL,以每孔100 μL的接种量将细胞液接种于96 孔板上。接种完成后将细胞置于37 ℃、5% CO2的培养箱中孵育培养24 h,吸去培养液,实验组分别加入不同浓度的空白脂质体(空白 NLs和空白 FA-CS-NLs)和姜黄素脂质体(NLs-Cur和FA-CS-NLs-Cur),空白对照组不加药。继续培养24 h,取出培养板,吸去培养液,并用PBS清洗2 次,每孔加入50 μg MTT。继续于培养箱中孵育4 h,终止培养,吸去MTT,每孔加入二甲基亚砜150 μL,于摇床上振荡10 min,使蓝紫色甲瓒结晶充分溶解。用酶标仪于490 nm波长处测得各孔的吸光度。根据公式(2)计算细胞存活率:

式中:AT和A0分别为实验组吸光度和空白组吸光度。
细胞摄取的测定[25]:取对数期生长的结肠癌细胞,按每孔1×105cells/mL的浓度接种于12 孔板中,于37 ℃、5% CO2的培养箱中孵育培养24 h。分别加入20 μg/mL的NLs-Cur和FA-CS-NLs-Cur,于培养箱中继续孵育6 h,取出12 孔板,吸去培养液,用PBS洗涤2 次,利用姜黄素自发荧光的特性,于荧光倒置显微镜下观察荧光强度并拍照,考察细胞摄取情况。
1.4 数据分析
每组实验至少3 组平行,实验结果用 ±s表示,应用SPSS 1.7软件对数据进行分析,采用t检验,P<0.05,差异有统计学意义。
2 结果与分析
2.1 叶酸偶联率、叶酸与壳聚糖的确定
分别采用物质的量比为0.02、0.06和0.12的FA与CS制备FA-CS,得到的复合物中叶酸偶联率分别为3.4%、7.8%和8.3%,随着FA与CS物质的量比的增加,叶酸偶联率增加。但FA与CS物质的量比从0.06增加至0.12时,叶酸偶联率的增加并不显著。Yang等[27]的研究表明,随着叶酸与氨基的物质的量比增加,叶酸与复合物中叶酸与氨基的物质的量比增加,但是复合物得率下降。此外,FA与CS物质的量比为0.12时,形成的复合物的复水性较差,而FA与CS物质的量比为0.06时,合成得到的FA-CS具有较好的复水性。如图2a所示,冻干后的FA-CS呈淡黄色雪花状,溶于pH 4.7的醋酸缓冲液中,可得到透明的浅黄色溶液(图2b),这表明合成得到的FA-CS具有较好的复水性。因此,实验选择物质的量比为0.06的FA与CS制备FA-CS。

图2 冻干后(a)与复溶后(b)的FA-CSFig. 2 Freeze-dried (a) and redissolved (b) FA-CS complex
2.2 FA-CS-NLs-Cur的粒径与微观形貌
本实验前期实验测得的姜黄素脂质体包封率为(57.1±1.1)%[25]。FA-CS-NLs-Cur的微观形貌采用原子力显微镜观察,如图3所示。从图3a、b可以看出,NLs-Cur粒径小于100 nm,FA-CS-NLs-Cur粒径大于100 nm,且粒径分布均匀,与激光纳米粒度仪测定的结果一致,NLs-Cur的平均粒径为(67.4±2.3)nm,分散系数为0.406±0.016,FA-CS-NLs-Cur平均粒径为(103.6±4.1)nm,分散系数为0.378±0.01(图3c)。此外,NLs-Cur的表面电位为(-13.81±2.75)mV,而FA-CS-NLs-Cur的表面电位为(16.35±3.54)mV,这说明经FA-CS修饰在脂质体表面后,脂质体的粒径增大,且表面负电荷转变为正电荷。这是因为壳聚糖带有大量的正电荷,壳聚糖分子中的阳离子氨基()与脂质体中带负电荷的磷酸根()之间发生静电相互作用[28],使得脂质体表面电位发生改变。Liu等[18]采用壳聚糖和海藻酸钠对脂质体进行层层自组装修饰,经壳聚糖修饰后脂质体平均粒径由(89.3±11.8)nm变为(160.3±28.3)nm,电位由(-6.34±0.62)mV变为(2.27±0.67)mV。与之相比,本实验制备的FA-CS-NLs较修饰之前粒径增幅较小,对脂质体性质的影响更小。
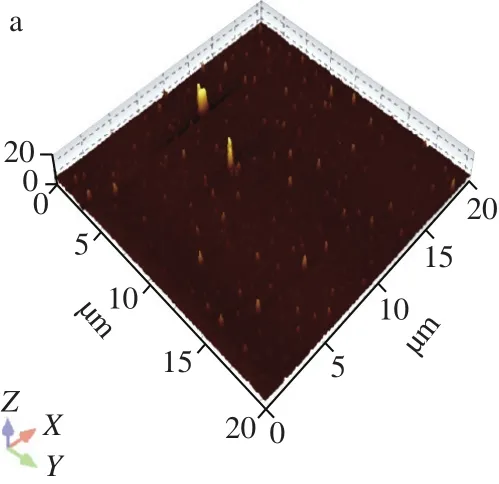
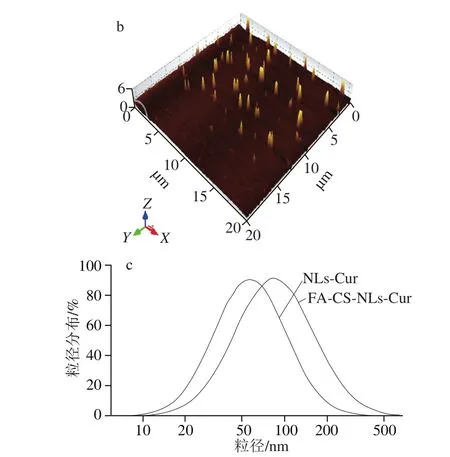
图3 NLs-Cur(a)和FA-CS-NLs-Cur(b)的微观形貌图及其粒径分布图(c)Fig. 3 AFM micrographs of NLs-Cur (a) and FA-CS-NLs-Cur (b) and particle size distribution of NLs-Cur and FA-CS-NLs-Cur (c)
2.3 FA-CS-NLs-Cur贮存过程中理化性质的变化

表1 NLs-Cur与FA-CS-NLs-Cur贮存稳定性Table 1 Storage stabilities of native and modified curcumin nanoliposomes
脂质体在25 ℃的贮存稳定性采用粒径、电位、姜黄素质量浓度等参数进行表征。如表1所示,NLs-Cur在25 ℃贮存28 d后,其粒径、电位均无显著性变化,但是姜黄素质量浓度由(0.523±0.04)mg/mL下降至(0.428±0.03)mg/mL。FA-CS-NLs-Cur在25 ℃贮存28 d后,其粒径、电位均无显著性差异,姜黄素质量浓度由(0.529±0.05)mg/mL下降至(0.499±0.03)mg/mL,这表明FA-CS-NLs-Cur较NLs-Cur在25 ℃姜黄素有更好的贮存稳定性。Liu等[28]发现姜黄素脂质体在25 ℃贮存40 d,姜黄素质量浓度显著下降,壳聚糖修饰能显著增加姜黄素脂质体在25 ℃的贮存稳定性。Zhou Wei等[29]制备的VC脂质体在4 ℃稳定性较好,在25 ℃贮存21 d,其粒径、泄药率和丙二醛值显著增大,但经低酯或高脂果胶修饰后的脂质体在25 ℃的贮存稳定性明显改善。这些结果表明,本实验制备的FA-CS-NLs-Cur可以有效提高姜黄素在运载体系中的贮存稳定性。
2.4 FA-CS-NLs-Cur的缓释性能
为模拟肿瘤细胞内部弱酸性环境和生物体内的弱碱性环境,本实验考察24 h内NLs-Cur和FA-CS-NLs-Cur在37 ℃、pH 5.5及37 ℃、pH 7.4环境下药物释放情况,用紫外分光光度法测定释放过程中姜黄素的含量,标准曲线回归方程为:y = 0.130 4x-0.002,R2= 0.999 5。药物释放情况如图4所示,在弱碱性环境下(pH 7.4),经24 h透析时,NLs-Cur和FA-CS-NLs-Cur姜黄素释放率分别为22.4%和17.7%;在弱酸性环境下(pH 5.5),经24 h透析时,NLs-Cur和FA-CS-NLs-Cur姜黄素释放率分别为25.4%和27.2%。这表明在pH 7.4环境下,FA-CS-NLs-Cur的缓释性能优于NLs-Cur;在pH 5.5环境下,NLs-Cur和FA-CS-NLs-Cur的缓释能力差异不大。
NLs-Cur和FA-CS-NLs-Cur在pH 7.4和pH 5.5环境下,10 h内姜黄素释放速度较快,10 h后姜黄素缓慢释放。这是由于吸附在脂质体表面和溶解在胶束里的姜黄素很容易释放出来,而包裹在脂质体内部的姜黄素难以释放,前10 h释放的大多是吸附在脂质体表面和溶解在胶束里的姜黄素。
此外,FA-CS-NLs-Cur在pH 7.4环境下的缓释性能显著优于pH 5.5环境下的缓释性能,这说明FA-CS-NLs-Cur在体循环pH值环境中能发挥较佳的缓释作用,但当FACS-NLs-Cur到达肿瘤细胞内部pH值环境时,药物释放加快。这可能是由于在不同的pH值环境中,多聚物呈现出松弛或禁闭的状态,影响其与磷脂膜的作用力,从而改变姜黄素的释放速率。在酸性环境下,FA-CS通过质子化作用呈现溶解的松弛状态,而在碱性环境下,FA-CS处于曲缩状态。它们不同的状态也影响到与脂质体膜的结合状态,从而影响载药体系的缓释特性。Yuan Roufen等[30]制备了甘草次酸修饰的姜黄素支链淀粉纳米粒子(Cur-GAP NPs),且Cur-GAP NPs在pH 7.4环境下的缓释性能优于pH 5.8环境下的缓释性能。Salem等[31]制备了叶酸修饰的β-环糊精磁性纳米粒子,并用于运载姜黄素,发现姜黄素在pH 5.4的环境下的释放速率较pH 7.4更快。这可能是由于弱酸性条件下,姜黄素中烯羧酸电离度下降,导致姜黄素疏水性增强,更倾向于被包埋在β-环糊精疏水性内腔中。
2.5 FA-CS-NLs-Cur的细胞毒性和细胞摄取
2.5.1 细胞毒性
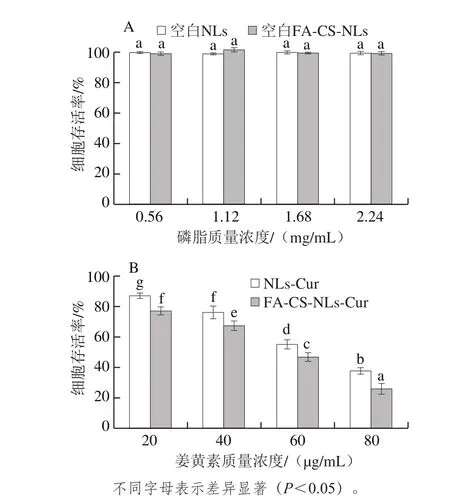
图5 不同磷脂和姜黄素质量浓度下空白NLs和空白FA-CS-NLs(A)以及NLs-Cur和FA-CS-NLs-Cur(B)的细胞毒性Fig. 5 Cytotoxicity of native and modified nanoliposomes without curcumin at different lipid concentrations (A) and containing curcumin (B) at different lipid concentrations
采用MTT比色法测定药物的细胞毒性,其原理为:活细胞线粒体中琥珀酸脱氢酶可以还原MTT形成蓝紫色甲瓒沉积在细胞中,而死细胞没有此功能[32]。本实验依次考察NLs-Cur、FA-CS-NLs-Cur及空白脂质体的细胞毒性。如图5A所示,经空白NLs与空白FA-CS-NLs处理后,细胞的存活率在99%~106%之间,这表明磷脂质量浓度为0.56~2.24 mg/mL的空白NLs与空白FA-CS-NLs对结肠癌细胞均无细胞毒性。
NLs-Cur与FA-CS-NLs-Cur的细胞毒性测定结果如图5B所示,当姜黄素质量浓度为20 μg/mL时,NLs-Cur及FA-CS-NLs-Cur的细胞存活率分别为84%、78%;当姜黄素质量浓度为80 μg/mL时,NLs-Cur处理的细胞存活率为38%,而FA-CS-NLs-Cur处理的细胞存活率仅为26%。随着姜黄素质量浓度(20~80 μg/mL)的增加,细胞存活率显著降低,且相同姜黄素质量浓度下,FA-CS-NLs-Cur的细胞存活率明显低于NLs-Cur。这说明姜黄素质量浓度为20~80 μg/mL时,随着姜黄素质量浓度的增加,FA-CS-NLs-Cur与NLs-Cur的细胞毒性均增大,且相同姜黄素质量浓度下前者的细胞毒性更大。
采用倒置显微镜对空白对照组(PBS)和实验组(FA-CS-NLs-Cur与NLs-Cur)细胞的形态进行观察,进一步验证FA-CS-NLs-Cur与NLs-Cur对结肠癌细胞的细胞毒性作用。如图6所示,空白对照的细胞长势良好,细胞间界限清晰,形态良好,数量最多。对于实验组,随着药物浓度的递增,FA-CS-NLs-Cur与NLs-Cur组的细胞数量下降,而且细胞呈现畸形状态,细胞皱缩、失去原有形态。在相同姜黄素质量浓度的情况下,FA-CSNLs-Cur组的细胞残片碎片明显多于NLs-Cur组,该结果与MTT实验结果相吻合。Yuan Roufen等[30]的研究表明,随姜黄素质量浓度的增加,游离姜黄素和甘草次酸修饰的姜黄素支链淀粉纳米粒子(Cur-GAP NPs)对肝癌细胞的毒性均增加,且相同姜黄素质量浓度下,包埋的姜黄素毒性较游离姜黄素更高,这是由于肝细胞表面大量的甘草次酸受体和支链淀粉对肝脏的吸附作用引起的;Li Lielie等[33]制备的叶酸-聚二乙炔修饰的脂质体运载体和聚二乙炔修饰的脂质体运载体对细胞存活率几乎没有影响,运载多烯紫杉醇后,相同药物浓度下,叶酸-聚二乙炔修饰的脂质体较聚二乙炔修饰的脂质体对乳腺癌细胞(Bcap-37 cells)毒性更大,然而对人乳腺细胞(Hs578Bst cells)毒性相当,这是由于癌细胞表面叶酸受体过度表达导致的。这些实验说明,脂质体包埋活性物质后,细胞毒性均有一定程度的增加,这可能是活性物质与运载体系的相互作用引起的。
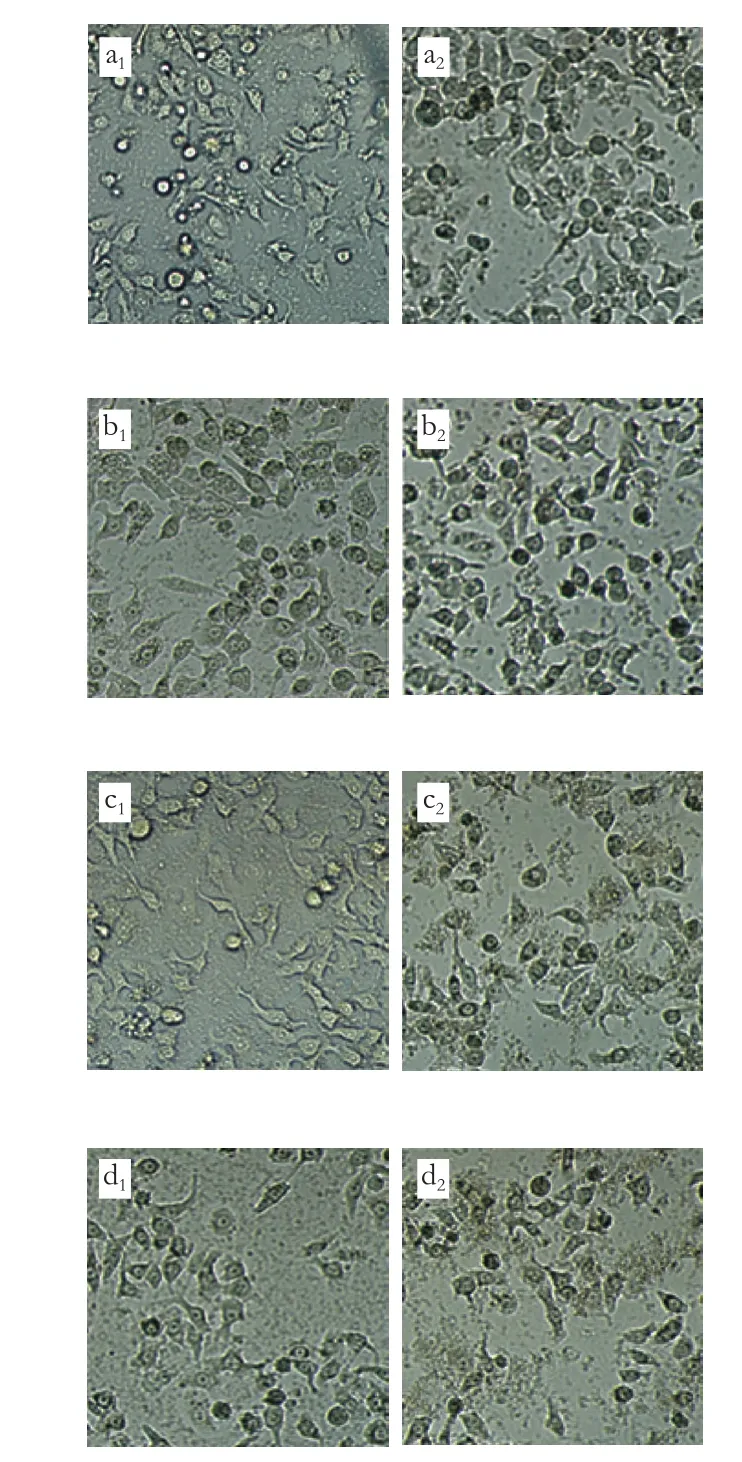

图6 脂质体处理24 h后结肠癌细胞的形态Fig. 6 Morphology of Caco-2 cells treated with liposomes for 24 h
2.5.2 细胞摄取
采用倒置荧光显微镜观察经FA-CS-NLs-Cur与NLs-Cur处理6 h后,结肠癌细胞对姜黄素的摄取情况。在姜黄素质量浓度为20 μg/mL时,经NLs-Cur与FA-CS-NLs-Cur处理后细胞存活率均大于80%,因此,采用该质量浓度进行细胞摄取实验,利用姜黄素自发荧光的性质观察姜黄素的摄取情况。如图7所示,经6 h孵育后,FA-CSNLs-Cur处理后的细胞荧光强度显著高于NLs-Cur处理的细胞,这表明结肠癌细胞对FA-CS-NLs-Cur的摄取量高于NLs-Cur,也导致相同姜黄素质量浓度下,FA-CS-NLs-Cur细胞毒性更大。由于结肠癌细胞表面叶酸受体过度表达[34],在叶酸的介导作用下,脂质体更易于进入细胞,从而增加姜黄素的细胞摄取。Yang Kuikun等[24]采用FACS-NLs包埋荧光素,发现叶酸修饰后的荧光素脂质体细胞摄取量显著高于普通脂质体包埋的荧光素,与本实验结果一致。

图7 NLs-Cur(a)、FA-CS-NLs-Cur(b)与结肠癌细胞作用6 h后的摄取荧光图Fig. 7 Fluorescent images of Caco-2 cells treated with native and modified nanoliposomes containing curcumin for 6 h
3 结 论
本研究合成了FA-CS,并用于修饰脂质体,构建FACS-NLs运载体系,该体系运载的姜黄素较普通脂质体运载的姜黄素在25 ℃贮存稳定性更好。在pH 7.4环境下,FA-CS-NLs-Cur的缓释性能优于NLs-Cur;在pH 5.5环境下,NLs-Cur和FA-CS-NLs-Cur的缓释能力差异不大;此外,FA-CS-NLs-Cur在pH 5.5环境下姜黄素的释放显著快于pH 7.4环境下。在相同姜黄素质量浓度下,FA-CSNLs-Cur的细胞毒性大于NLs-Cur,且经叶酸修饰后细胞对姜黄素脂质体的摄取量有所提高。因此,作为一种无细胞毒性的运载体系,FA-CS-NLs有潜力开发为一种可通过改变pH值控制释放的药物载体。
