北沙参多糖铁配合物的制备、结构特征及生物活性
2019-01-07景永帅张瑞娟吴兰芳张丹参
景永帅,张瑞娟,吴兰芳,苏 蕾,李 超,张丹参,*
(1.河北科技大学化学与制药工程学院,河北 石家庄 050018;2.河北中医学院药学院,河北 石家庄 050200)
北沙参又名海沙参、野沙参、辽沙参等,为伞形科植物珊瑚菜(Glehnia littoralis Fr. schmidt ex Miq.)的干燥根,是我国传统的药食两用资源,具有滋阴清肺、益胃生津等功效[1-2]。北沙参中含有多糖类、磷脂、香豆素类等多种有效成分,其中含量最多的是多糖类,也是其主要有效成分之一[2]。关于北沙参多糖的研究主要集于提取工艺和药理活性,其中,提取工艺研究包括热水提取[3]、超声波辅助[4]和微波辅助提取[5]等,药理活性报道包括抗氧化[5]和免疫调节活性[6]等。
随着多糖研究的深入,多糖的多种生物活性逐渐被发现,其不仅具有多方面的药理作用,而且来源广泛,毒副作用低,是一种理想的药品和保健食品开发来源[7]。近年来国内外学者利用多糖与铁配合生成多糖铁配合物,这类有机配合物对胃肠道刺激小、生物利用度高,并且当配合物中的铁脱离配体多糖后,多糖的多种生物活性在体内也可发挥功效[8]。目前,已报道的多糖铁配合物有:土党参多糖铁配合物[9]、香菇多糖铁[10]、米糠多糖铁[11]、茶叶多糖铁[12]、孔石莼多糖铁[13]等,这类多糖铁配合物可作为补铁剂治疗缺铁性贫血症,具有很好的临床疗效,且不良反应少[14-15]。
因此,本实验采用三氯化铁共热合成法对北沙参多糖进行结构修饰,得到北沙参多糖铁配合物,并对其理化性质、结构特征和生物活性进行表征和分析,为北沙参多糖铁配合物作为补铁剂提供理论依据。
1 材料与方法
1.1 材料与试剂
北沙参购自成都本珍生物科技医药有限公司,河北中医学院药学院生药教研室鉴定为伞形科植物珊瑚菜(Glehnia littoralis Fr. schmidt ex Miq.)的干燥根;透析袋(截留分子质量500 Da) 上海绿鸟科技有限公司;1,1-二苯基-2-苦味基肼、α-葡萄糖苷酶、对硝基苯-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG)、各标准单糖、抗坏血酸(VC) 上海阿拉丁生化科技股份有限公司;无水乙醇、FeSO4、水杨酸、过氧化氢、混和磷酸盐、无水碳酸钠、柠檬酸三钠、NaOH、FeCl3、邻菲罗啉等为国产分析纯。
1.2 仪器与设备
HH-2恒温水浴锅、DF-2磁力加热搅拌器 江苏金坛宏华仪器厂;EYELA N-1100旋转蒸发仪 东京理化株式会社;KS-300DE超声波清洗器 昆山洁力美超声仪器有限公司;400Y多功能中药粉碎机 永康市铂欧玉金制品有限公司;UV-2550紫外-可见分光光度计 日本岛津仪器制造有限公司;101-2AB电热鼓风干燥箱 天津市泰斯特仪器有限公司;TGL-15B高速离心机 上海安亭科学仪器厂;AL204电子分析天平 梅特勒-托利多国际贸易有限公司;S-100傅里叶变换红外光谱仪 珀金埃尔默仪器有限公司;JEM-2100透射电镜 日本Jeol公司;ICS-2500高效阴离子交换色谱-电流安培检测器(high performance anion-exchange chromatography-pulsed amperometric detection,HPAEC-PAD) 美国戴安公司;STD-2960差热-热重联用热分析仪 美国TA仪器公司。
1.3 方法
1.3.1 北沙参多糖及其铁配合物的制备
1.3.1.1 北沙参多糖的制备
取北沙参药材,粉碎,过40 目筛,用3 倍体积的95%乙醇溶液回流提取2 次,药渣干燥后,备用。取25 g北沙参除脂后粉末,加入30 倍体积的蒸馏水,于恒温水浴锅中回流提取2 h,提取2 次,分别将上清液8 000 r/min离心4 min,抽滤后合并,在旋转蒸发仪上减压浓缩至小体积,用等体积的无水乙醇将浓缩液进行醇沉,静置过夜,抽滤,沉淀干燥即得北沙参多糖。
1.3.1.2 北沙参多糖铁配合物的制备
称取2.0 g北沙参多糖,在三口瓶中用100 mL蒸馏水溶解,加入0.5 g柠檬酸三钠,在70 ℃的水浴中持续搅拌,同时滴加20% NaOH和2 mol/L FeCl3溶液,控制反应体系pH值在8.0~9.0之间,当体系中生成不溶的棕红色沉淀时,停止滴加NaOH和FeCl3溶液,继续搅拌反应1 h,趁热8 000 r/min离心4 min,取上层棕红色液体,用4 倍体积的无水乙醇醇沉,抽滤,收集沉淀,沉淀用适量的蒸馏水溶解,放入500 Da的透析袋中,用流水和蒸馏水分别透析24 h,浓缩,干燥,即得多糖铁配合物[11]。
1.3.2 北沙参多糖及其铁配合物的理化性质和结构特征
1.3.2.1 北沙参多糖的单糖组成分析
分别称取2.0 mg的各单糖标准品(L-阿拉伯糖、L-鼠李糖、L-岩藻糖、D-果糖、D-甘露糖、D-葡萄糖和D-半乳糖),配制成质量浓度为1.0 mg/mL的溶液,量取20.0 μL进行HPAEC-PAD测定。称取北沙参多糖样品2.0 mg,加入2.0 mL的2 mol/L的三氟乙酸溶液,于110 ℃条件下水解6 h,加适量甲醇减压浓缩,去除剩余三氟乙酸,加入蒸馏水溶解,取20.0 μL进行HPAEC-PAD测定,根据各峰的保留时间和峰面积比计算出样品的单糖组成和物质的量比[16]。
1.3.2.2 铁离子含量测定
铁离子含量标准曲线的绘制:分别取0.4、0.8、1.2、1.6、2.0、2.5、3.0 mL的10 mg/L的FeSO4标准溶液于试管中,加入2.0 mL的10% VC溶液和2.5 mL的0.1%邻菲罗啉溶液,加蒸馏水至10 mL,摇匀,在37 ℃恒温水浴锅中反应10 min,紫外-可见分光光度计在510 nm波长处测定吸光度。以Fe2+质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
多糖铁配合物中铁离子含量测定:取1.0 mL的0.08 mg/mL的多糖铁配合物溶液、2 mL的10% VC溶液和2.5 mL的0.1%邻菲罗啉溶液加入到试管中,加蒸馏水至10 mL,摇匀,37 ℃恒温反应1 h,于510 nm波长处测定吸光度,将结果带入标准曲线,计算多糖铁配合物中Fe3+质量浓度C/(mg/mL),按公式(1)计算多糖铁配合物中铁质量分数S[11]:

1.3.2.3 紫外-可见光谱分析
分别配制0.1 mg/mL的北沙参多糖和多糖铁配合物溶液,用紫外-可见分光光度计在200~800 nm波长范围内扫描[17]。
1.3.2.4 红外光谱分析
分别称取1.0 mg的北沙参多糖和多糖铁配合物,与KBr按1∶1比例混合,研磨成粉末,压片,在红外光谱仪上在4 000~500 cm-1范围内扫描[18-19]。
1.3.2.5 透射电镜扫描
取1.0 mg的多糖铁配合物样品,加入无水乙醇,超声5 min使其分散,再将其滴于有支撑膜的铜网上,常温放置至干燥后进行透射电镜观察[20]。透射电镜最大放大倍数:106倍,分辨率:0.14 nm,加速电压:120 kV。
1.3.2.6 热重分析
分别称取2.0 mg的北沙参多糖和多糖铁配合物,温度由室温升至800 ℃,升温速率为10 ℃/min,进行热重分析,包括差示扫描量热分析(differential scanning calorimetry,DSC)和热解重量分析(thermal gravimetric analysis,TGA)。以温度为X轴,以质量损失率(某一温度下质量损失后样品的实测质量与样品总质量的比值)为Y轴,绘制热重变化曲线[21]。
1.3.3 北沙参多糖及其铁配合物的生物活性
1.3.3.1 清除羟自由基活性
北沙参多糖和多糖铁配合物清除羟自由基的测定参照文献[22]方法。
1.3.3.2 对α-葡萄糖苷酶抑制活性
分别取3 mL的pH 6.81缓冲溶液、0.8 mL的2 mmol/L PNPG溶液,37 ℃恒温孵育20 min,加入1 mL 40 U/mL的α-葡萄糖苷酶溶液,继续反应20 min,加入1 mL 1.0 mol/L碳酸钠溶液终止反应,用紫外-可见分光光度计在400 nm波长处测吸光度,作为对照组,为A1,平行测定3 次。将体系中的1 mL α-葡萄糖苷酶换为1 mL蒸馏水,其余溶液不变,在相同的条件下测定吸光度,作为空白组,为A2。
取2 mL pH 6.81缓冲溶液、0.8 mL 2 mmol/L PNPG溶液,分别加入1 mL质量浓度为4、2、1、0.5 mg/mL的多糖样品溶液,同上进行反应。反应完毕后于400 nm波长处测吸光度,作为样品组,为A3,平行测定3 次。将体系中1 mL的α-葡萄糖苷酶换为1 mL蒸馏水,其余溶液不变,在相同的条件下测定吸光度,作为样品对照组,为A4[23]。阿卡波糖作为阳性对照品。按公式(2)计算抑制率:
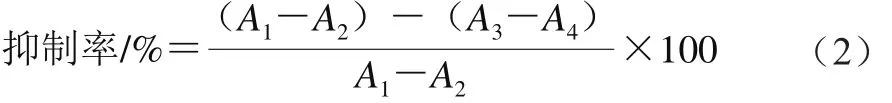
2 结果与分析
2.1 北沙参多糖的提取率和单糖组成分析
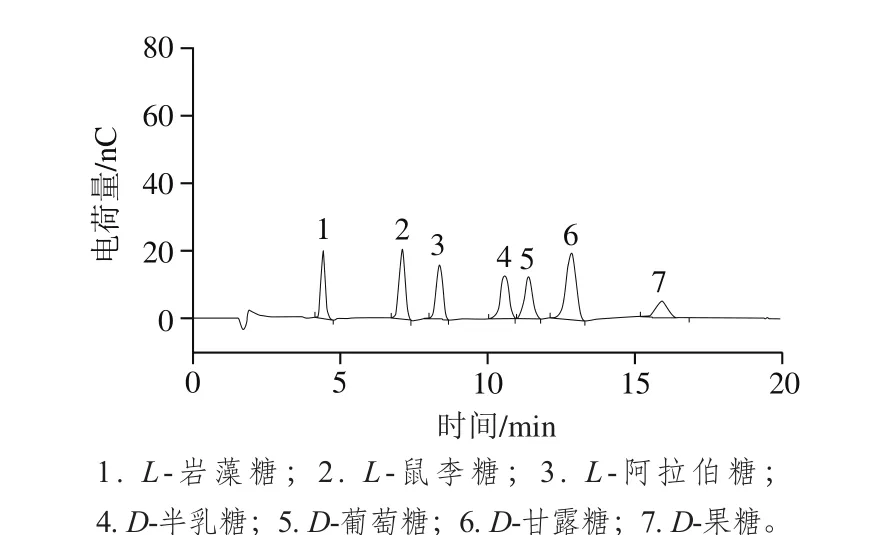
图1 标准单糖的高效阴离子交换色谱图Fig. 1 HPAEC-PAD chromatograms of standard monosaccharides
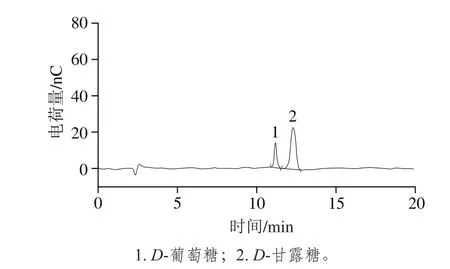
图2 北沙参多糖完全酸水解的高效阴离子交换色谱图Fig. 2 HPAEC-PAD chromatograms of GLP
北沙参经乙醇除脂、水提醇沉法制备后,得到北沙参多糖为4.6 g,提取率为18.4%。北沙参多糖经完全酸水解后,用HPAEC-PAD分析,与标准单糖的高效阴离子交换色谱保留时间和峰面积对照(图1、2),结果表明:北沙参多糖由葡萄糖和甘露糖组成,其物质的量比为1.00∶4.25。
2.2 北沙参多糖及其铁配合物的理化性质和结构特征
2.2.1 多糖铁配合物中铁含量测定
根据标准曲线得到标准曲线方程:y=0.150 7x+0.005 2,R2=0.996 8,其中y为吸光度,x为Fe2+质量浓度。由标准曲线方程计算铁含量,北沙参多糖铁配合物中铁质量分数为19.31%。
2.2.2 紫外-可见光谱图谱分析
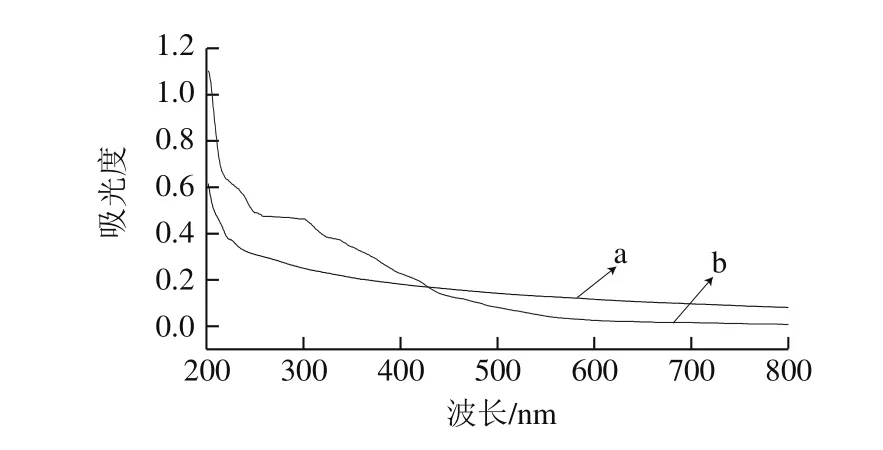
图3 北沙参多糖(a)和多糖铁配合物(b)紫外-可见光谱图谱Fig. 3 UV-visible spectra of GLP (a) and GLP-Fe (b)
由图3可知,北沙参多糖在260 nm和280 nm波长处无吸收峰出现,说明样品中不含有核酸和蛋白质。在紫外区,多糖铁配合物的吸收强度明显比北沙参多糖的吸收强度强,推测可能为铁离子与多糖中的羟基发生了络合反应[24]。
2.2.3 红外光谱分析
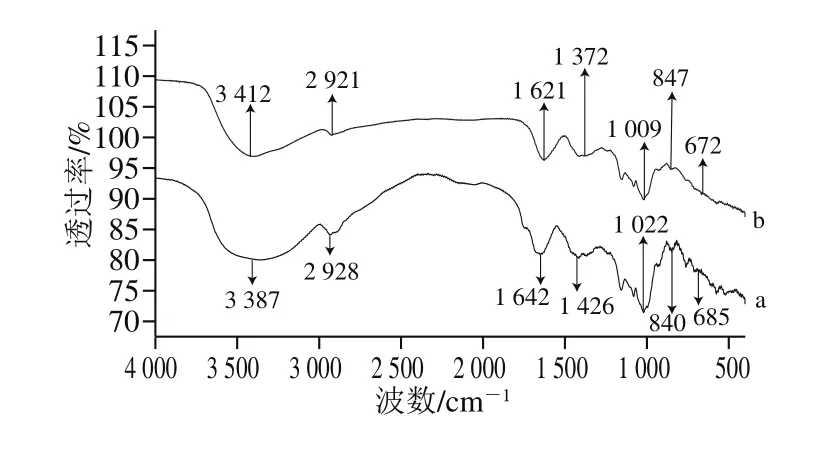
图4 北沙参多糖(a)和多糖铁配合物(b)红外图谱Fig. 4 Infrared spectra of GLP (a) and GLP-Fe (b)
由图4可看出,修饰前后的红外图谱主要特征吸收峰未发生显著改变,说明铁配合物修饰未破坏其基本结构[11]。3 400 cm-1附近为多糖分子中羟基的伸缩振动吸收峰,修饰后,峰形发生变化,可能因多糖的羟基参与了络合反应[24],这与紫外-可见光谱分析结果相一致;1 600 cm-1左右为C=O的伸缩振动吸收峰,修饰后吸收峰减弱,可能是多糖的C=O与铁离子配位造成的[25];1 250~1 000 cm-1范围内是C—O的伸缩振动吸收,修饰后吸收峰减弱,推测可能是C—O键参与了多糖与铁的络合,或是因为氢键之间的相互作用;680 cm-1和850 cm-1附近的吸收峰增强,与文献[26]报道的β-FeOOH的红外光谱一致。红外光谱图显示,北沙参多糖与FeCl3反应形成了多糖铁配合物。
2.2.4 透射电镜分析

图5 多糖铁配合物透射电镜图Fig. 5 Transmission electron microphotograph of GLP-Fe
由图5可以看出,黑色斑点是铁核,外围电子透明的亮区即北沙参多糖,铁核在多糖中分布较分散,大小不一,还比较规则,直径在100~200 nm范围。由图5C可看到,出现衍射光斑,光斑呈环状分布[26]。由透射电镜和红外光谱结果可知,多糖铁配合物是以聚合的β-FeOOH微核为核心,多糖在其表面配合形成的多糖铁(Fe3+)表面配合物。
2.2.5 热重分析结果
2.2.5.1 北沙参多糖热重分析
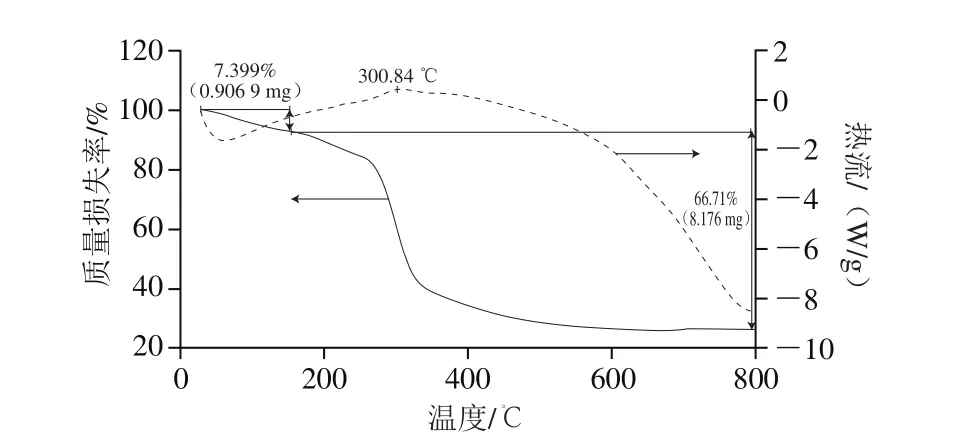
图6 北沙参多糖的热重曲线图Fig. 6 Thermogravimetric curve of GLP
由图6的DSC曲线(虚线)可知,图谱主要特征为有1 个吸热峰1 个放热峰,53 ℃的吸热峰是由多糖中的吸附水升华引起的,300.84 ℃为多糖分解的放热峰。由TGA曲线(实线)可知,北沙参多糖的热分解曲线分为两个阶段,第1个阶段为27~160 ℃,此阶段失去的主要是水,质量损失率为7.399%;第2个阶段为160~800 ℃,在270~350 ℃区间,多糖快速质量损失,在350~800 ℃质量损失速度减慢,此阶段的质量损失率为66.7%,说明在该温度区域,多糖发生了分解,化学键受到了破坏[27]。
2.2.5.2 多糖铁配合物热重分析图
由图7的DSC曲线(虚线)可知,多糖铁配合物主要特征为有2 个吸热峰1 个放热峰,55 ℃的吸热峰可能是因为多糖铁复合物中的吸附水升华引起的, 288.58 ℃有一个放热峰,596.99 ℃有一个小的吸热峰。由TGA曲线(实线)可知,多糖铁配合物的热分解曲线分为3 个阶段,第1个阶段是32~150 ℃,此阶段失去的主要是水,质量损失率为10.65%;第2个阶段是150~550 ℃,此阶段质量损失率为41.45%,说明在该温度区域,多糖发生了分解,化学键受到了破坏;第3个阶段是550~800 ℃,质量损失率为11.78%。
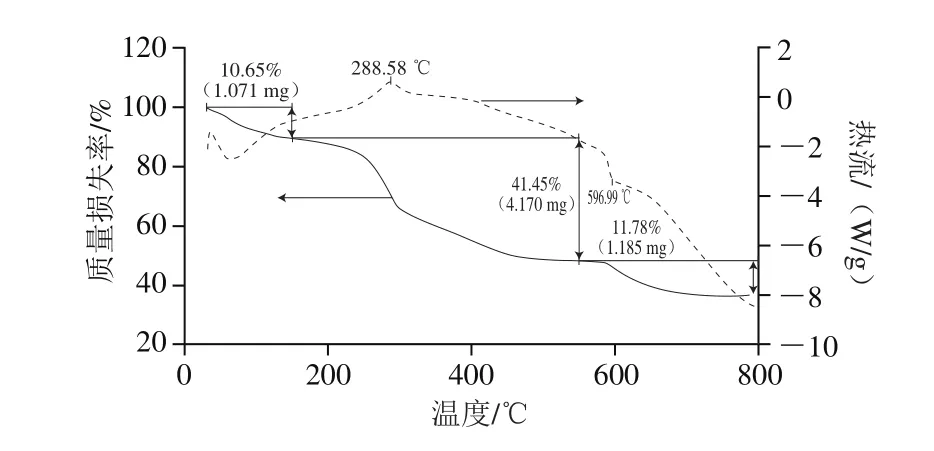
图7 多糖铁配合物的热重曲线图Fig. 7 Thermogravimetric curve of GLP-Fe
结合TGA曲线和DSC曲线可知,55 ℃的吸热峰是由于样品中的吸附水升华引起的,DSC中288.58℃的放热峰和TGA中300 ℃左右的质量损失峰高度关联,说明288.58 ℃的放热峰是可能是多糖铁配合物分解失去结晶水和铁核的相转化引起的[25]。综上所述,经铁修饰后,多糖的热分析曲线趋势比较缓和,说明修饰后的多糖的稳定性有所提高。
2.3 北沙参多糖及其铁配合物的生物活性
2.3.1 清除羟自由基作用
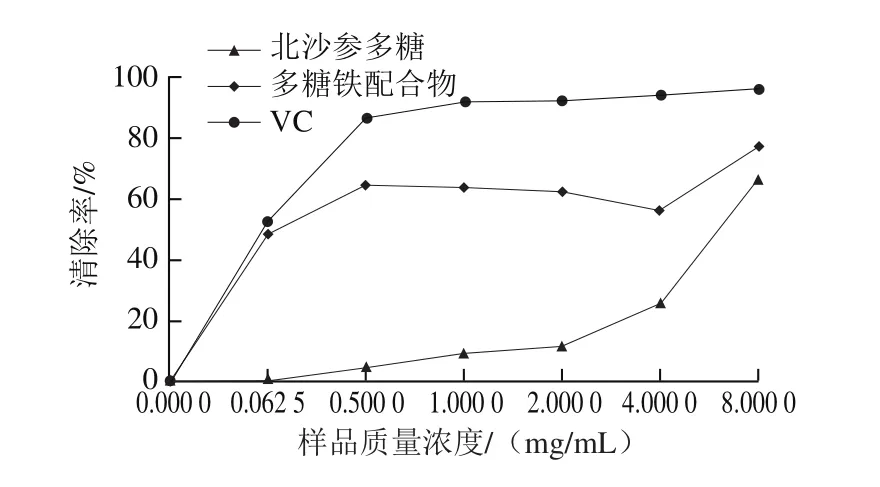
图8 北沙参多糖和多糖铁配合物对羟自由基清除作用Fig. 8 Hydroxyl radical scavenging effect of GLP and GLP-Fe
从图8可知,北沙参多糖及其铁配合物对羟自由基均有一定的清除作用,样品质量浓度不同,对羟自由基的清除作用也不同,整体呈线性关系。北沙参多糖的IC50值为6.413 mg/mL,多糖铁配合物的IC50值为0.057 mg/mL,VC的IC50值为0.047 mg/mL,IC50值越小,清除作用越好。铁修饰后的多糖铁配合物的活性显著提高。先宏等[28]合成褐藻硫酸多糖铁配合物,何瑞雪等[29]合成大豆多糖铁配合物,并对其抗氧化活性进行考察,研究发现,经铁修饰后,抗氧化活性明显增强,和本研究的结果相一致。
2.3.2 对α-葡萄糖苷酶的抑制活性
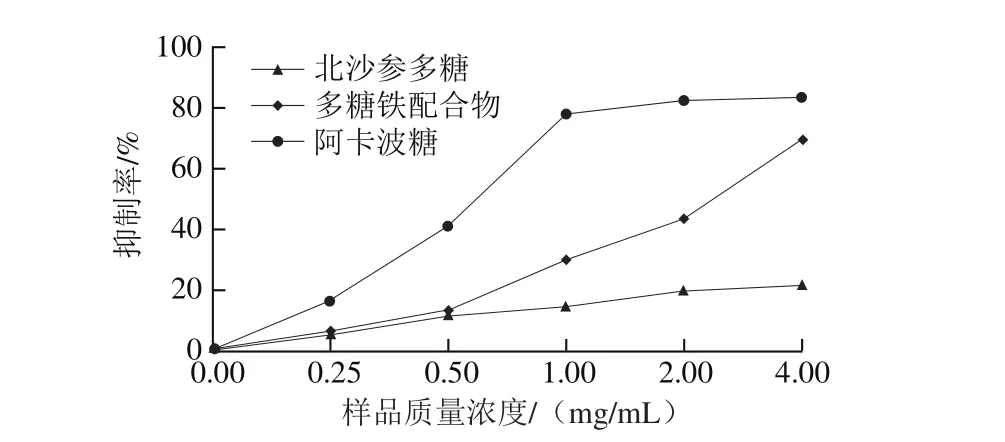
图9 北沙参多糖和多糖铁配合物对α-葡萄糖苷酶抑制率的影响Fig. 9 α-Glucosidase inhibitory effect of GLP and GLP-Fe
从图9可看出,随着样品质量浓度的升高,北沙参多糖和多糖铁配合物对α-葡萄糖苷酶的抑制作用也逐渐增强,呈现质量浓度依赖性。当质量浓度为4 mg/mL时,北沙参多糖及其铁配合物对α-葡萄糖苷酶的抑制率分别为23.6%和69.35%,铁修饰后,抑制率明显增强,但均低于阳性对照阿卡波糖对α-葡萄糖苷酶的抑制率。杜国丰等[30]报道苦瓜多糖及其铁配合物组均能显著降低高血糖模型小鼠的血糖水平,且苦瓜多糖铁降血糖效果更显著,与本研究结果相似。
3 结 论
选用北沙参为原料,采用水提醇沉法制备北沙参多糖。对制备的多糖进行铁配合物修饰。采用紫外-可见光谱、红外光谱、HPAEC-PAD、透射电镜、DSC和TGA等对多糖及其铁配合物的理化性质和结构特征等进行评价,从清除羟自由基和对α-葡萄糖苷酶的抑制活性两个方面进行生物活性测试,得出以下结论:1)北沙参多糖的提取率为18.4%,是由葡萄糖和甘露糖组成,其物质的量比为1.00∶4.25,不含有核酸和蛋白质。2)多糖铁配合物中铁离子质量分数为19.31%,是以聚合的β-FeOOH微核为核心,多糖在其表面配合形成的多糖铁(Fe3+)表面配合物。3)北沙参多糖经铁修饰后,对羟自由基清除作用和对α-葡萄糖苷酶的抑制能力均得到明显提高。北沙参多糖铁配合物具有较好的稳定性和生物活性,有望开发成为一种具有多重保健功能的生物多糖型补铁剂。
