碱金属对煤灰熔融特性的影响机理
2019-01-05,,,
,,,
(1.上海理工大学理学院,上海 200093; 2.上海理工大学环境与建筑学院,上海 200093)
1 前 言
我国新疆准东煤田已探明储量达2136亿吨,是中国乃至世界最大的整装煤田[1]。然而该地区煤的原生矿物中含有大量的Na、K等碱金属元素[2]。在燃用高碱煤过程中,其灰的沾污、结渣行为与常规动力用煤的沾污结渣行为有很大不同,导致新疆准东地区大多数燃煤电站锅炉均无法长期、稳定燃用该煤种,极大地增加了电站运行成本和能耗。
灰沉积过程是一个复杂的物理化学变化过程,在灰沉积过程中矿物质的化学变化方面,有学者研究了纯矿物质和矿物质与煤的混合物在火焰中的化学转化过程[3-7];除了化学转化,煤灰在燃烧过程中的破碎、凝聚、蒸发以及冷凝等一系列物理转化在灰沉积的过程中也扮演着重要角色[8]。随灰沉积研究方法的发展,一些学者用数值模拟方法去模拟灰沉积过程[9],用数字影像技术去研究积灰的自发脱落过程[10];在一个中式实验台中,两种灰样的微观结构也被定量测量和模拟[11]。在灰沉积吸附机制方面,有作者认为这与灰的界面反应有关[12],为此,灰吸附机制的相关实验研究也在小式实验台和煤粉炉[13-14]中进行。Abbott等报道了熔融灰粒在金属表面润湿性和其粘附力的关系,并指出粘附力影响灰粒沉积速度[15-18],碱性矿物质降低灰熔融温度的特性,增加了灰沉积速度[19],这是灰沉积的关键。因此,许多学者研究了碱金属矿物质在灰熔融过程中的作用机制,比如,碱性物质在生物能利用过程中[20, 21]和混合燃烧过程中[22-23]的转化行为;低阶煤气化过程中碱金属和碱土金属的转化行为,研究者发现分散的Ca元素首先挥发进入细灰颗粒,然后大多数灰粒与固有粘土矿物质相互作用形成复杂的硅铝酸盐[24]。以上学者的研究大多是宏观层面,在微观层面,陈玉爽等[25]通过量子化学理论深入研究了向配煤中加入助溶剂对其煤灰的熔融特性的影响,结果发现,当向配煤中加入钙系助溶剂时能够有效降低煤灰灰熔点;李洁等[26]研究了向煤灰中掺杂不同比例的硼砂对煤灰的熔融特征温度的影响。在煤的气化与燃烧方面,量子化学计算已经为我们提供了新的广阔前景。
本文选取一种高碱煤和四种非高碱煤在影像式烧结点试验仪上进行熔融特性试验,分析了碱性物质对熔融曲线的影响;利用ICP和XRD对不同温度下高碱煤灰元素和矿物演变行为进行研究,进而利用量子化学理论,建立碱性物质分子模型,计算其前沿轨道,从分子层面分析碱性矿物质对煤灰熔融特性的影响机理。
2 实验与建模理论
2.1 实验
煤灰的熔融性是衡量煤在燃烧过程中结渣倾向与能力的一个重要的因素和指标。本文选用五种煤样制灰:一种典型的高碱煤:准东煤;同时,为了形成对比效果,选取了两种新疆非准东地区煤种(准南煤、柳黄沟煤)以及两种非新疆地区煤种(神华煤、内蒙泥煤)进行对比实验,煤样粒度均为200目以下(<75μm),煤质分析如表1所示。煤灰的制备按照GB/T 1574-1995规定进行,灰柱规格为3×3mm。对比五种煤灰的熔融特性时,选用815℃制灰,将五种灰样分别放入影像式烧结点试验仪,对灰渣在熔融过程中的收缩、膨胀和流动全过程进行捕捉和记录,通过对图片的分析来测定煤灰熔融特征温度。准东煤、准南煤、柳黄沟煤、神华煤、内蒙泥煤的灰样代号分别记为ZD、ZN、LH、SH、NM。在数据处理方面,用截面积的变化率ηs来表示实验中样品的体积变化率,ηs的计算式如下:
(1)
其中,A0、At分别表示试验煤柱的初始截面积和不同温度下的截面积,此外,还引入半熔融态灰渣的概念,其定义为灰柱处于开始收缩时的温度至收缩速率趋于稳定时的温度之间的状态。为了进一步研究碱性物质对煤灰熔融特性的影响,我们再选取450、550和650℃三个制灰温度对ZD制灰,重复上述试验步骤,灰样代号分别为ZD1、ZD2、ZD3。由表2可以看出,不同的制灰温度下,ZD、ZD1、ZD2、ZD3中主要的金属氧化物有着不同的变化趋势,变化比较明显的是Na2O的含量。随着制灰温度的升高,煤灰中Na2O的含量呈减小的趋势,由5.28%减小到标准制灰温度下的3.82%,这是由于煤中碱金属在加热过程中会从煤中挥发[27],挥发的量随着制灰温度的升高而增加。而ZD、ZN、LH、SH、NM灰样中最大的差别就是ZD灰样中Na、K含量高。这些特点为我们研究碱性矿物质在灰熔融过程中的行为机理提供了很好条件。
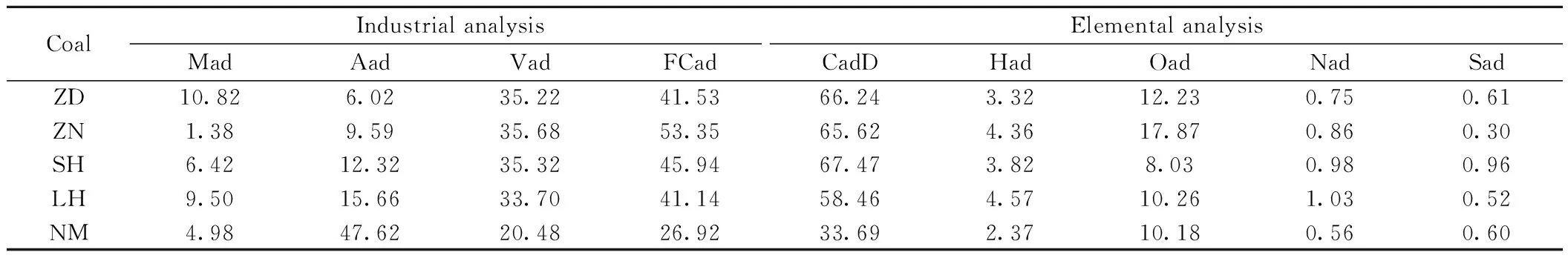
表1 煤样的工业分析及元素分析Table 1 Industrial analysis and elemental analysis of coal
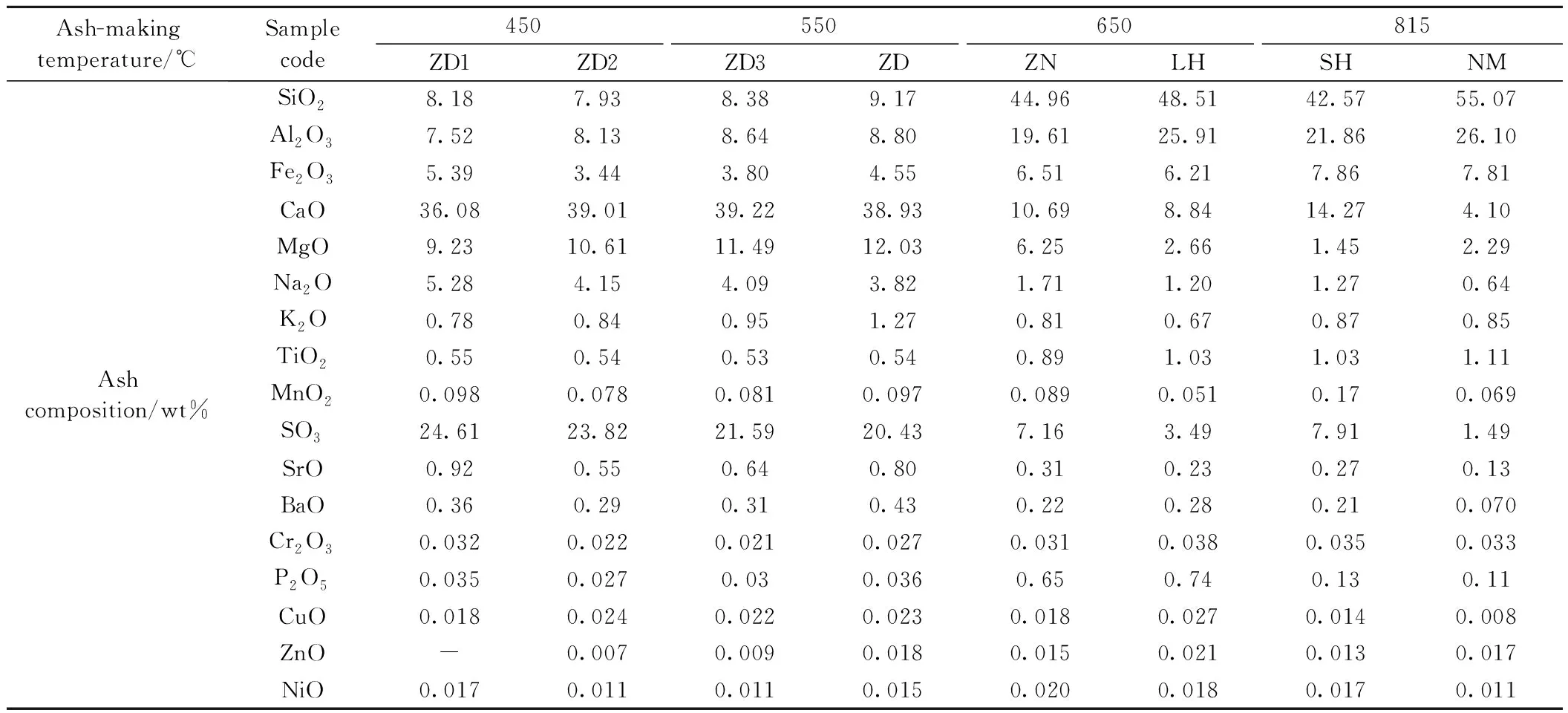
表2 灰样分析Table 2 Analysis of ash
灰样的熔融特性实验采用SJY-II型影像式烧结点试验仪进行,该仪器由聚光装置,加热主体装置,投影成像装置,电气控制箱等四部分组成。聚光部分采用12V、30W光源灯泡发光并经聚光镜片聚光;加热采用钼丝为发热元件的管式电阻炉,用氩气保护发热元件不被过快氧化,最高炉温可达1700℃,炉膛试验区的温度梯度为±15℃;投影成像装置中,平行光线从聚光镜发射,通过炉膛,将炉膛内试样通过凸透镜聚焦到投影部分的放映镜头上,经棱镜折射到平镜,再由平镜反射到镜屏,进而通过安装在镜筒前端的CCD摄像头将放大后的影像捕捉并记录在电脑中,这样我们就可以清晰地看到炉内试样随温度变化而产生的收缩、膨胀、钝化及完全球化的投影图像;采用A810P型温控仪进行温度控制,使其升温速率得到很好保证。
将本实验高碱煤样按照GB/T 1574-1995中规定进行815℃标准制灰,然后将等量灰样放入挥发分坩埚并置于高温马弗炉中,分别从900℃到1500℃每隔100℃一个工况进行制样,每个工况保持7min,保证灰中矿物反应完全。然后将每个温度下的样品放入干冰激冷,待样品恢复室温后对其进行取样,进行XRD和ICP分析。
使用D8 ADVANCE型XRD仪,光源为Cu靶,陶瓷X光管,电压≤40kV,电流≤40mA,样品台水平固定,测角仪精度高,角度重现性达±0.0001°,最小步长为0.0001°,可θ,2θ单独驱动,工作模式为θ/θ模式,步进马达和光学编码器确保测角仪快速而准确定位,探测器为新型的LYNXEYE_XE点阵探测器,具有灵敏度高,线性范围大的特点。利用iCAP6300型ICP仪对样品中Na、K、Ca、Mg等元素进行检测。其焦距为383mm;波长范围为166~847nm;在200nm处:像素分辨率为0.010nm,光学分辨率为0.007nm;中阶梯光栅为52.91条/mm;CID面积为28×28mm;检测单元为540×540(291,600)。
2.2 建模理论
密度泛函总能计算是在Perdew等提出的广义梯度近似(GGA)[28]下进行的,利用Materials Studio软件包中CASTEP[29]模块,采用基于第一性原理(first-principles)的超软赝势(Ultrasoft Pseudo-potential)[30]平面波法,将离子势用赝势替代,电子波函数用平面波基组展开,结构优化采用BFGS算法[31],对模型进行量子计算。
采用前线分子轨道理论(Frontier molecular orbital theory)阐述HOMO/LUMO(最高占用分子轨道/最低未占分子轨道)对分子特性的影响[32]。占据在HOMO中的电子被认为如原子中的价电子那样在反应中起着主要的作用。在反应过程中,反应物之间的HOMO和LUMO必须达到最大的重叠,以使电子能从HOMO迁移到LUMO而促使旧键的断裂和新键的生成.在反应体系中只有单个被占据分子轨道时,它就起着HOMO或LUMO的部分作用,或者同时是两者的部分作用。
煤灰中的Na+、K+、Ca2+离子,由于其离子半径较大,所以主要存在于结构疏松、空隙较大的架状结构硅酸盐中。在这类矿物质中,部分硅氧四面体[SiO4]4-被铝氧四面体[AlO4]5-所代替,进而出现过剩负电荷,形成架状络阴离子,需要半径较大的阴离子填充其中用来中和负电荷以使整体达到电中性。本文选用由四分之一[SiO4]4-被[AlO4]5-置换的硅酸盐而形成的钠长石(NaAlSi3O8)来研究其在降低高碱煤灰熔点方面的作用机理,建模数据参考Prewitt, C.T.[33]的研究。初始模型如图1所示。
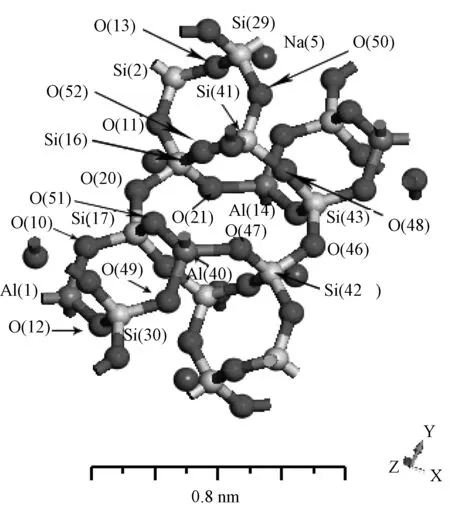
图1 钠长石(NaAlSi3O8)初始模型Fig.1 Initial model of NaAlSi3O8
从结构上看,钠长石是由硅氧四面体[SiO4]4-四个顶点的氧与邻近硅氧四面体[SiO4]4-或者铝氧四面体[AlO4]5-连接,构成无限架状结构,后Na+离子填充其中而形成(如图1)。钠长石架状结构中有两种空间八边形,一种只含有氧原子和硅原子(如Si(2)、O(13)、Si(29)、O(50)、Si(41)、O(52)、Si(16)、O(11));另一种含有氧原子、硅原子和铝原子(如O(10)、Si(17)、O(51)、Al(40)、O(49)、Si(30)、O(12)、Al(1))。这两种空间八边形通过桥氧键(如Si(16)-O(20)-Si(17)、Si(16)-O(21)-Al(14)、Si (43)-O(48)-Si(41)、Al(40)-O(47)-Si(42))相连,构成网络架状结构。
3 结果与讨论
3.1 Na对煤灰熔融特性的影响
五种灰样的熔融行为如图2所示,其熔融特性参数见表3。ZD的行为特性与其他四种煤灰表现出了明显不同,其发生初始熔融时对应的最低温度为770℃左右,而SH、ZN、LH以及NM相应的温度点分别为830、960、850和880℃。同时,ZD发生初始熔融的量即半熔融态渣量相对最多,达24%,而其他四种灰样的初始熔融的渣量为8%~15%,远远小于ZD,这也是准东煤与其他煤种相比,表现出易沾污和结渣的主要原因之一。分析比较这几种煤灰的化学组成,ZD中Na、Ca、Mg等碱金属和碱土金属氧化物的含量要远远高出其他四种煤种,说明在此气氛下,灰中这些氧化物的存在对煤灰初始熔融行为的影响比较大。这主要是由于煤灰中碱性金属氧化物的含量较大,一方面为钙铝黄长石、钙长石、钠长石、霞石等低熔点矿物质以及低温共熔体的生成和存在提供了条件,从而在相对较低的温度下煤灰中便出现了较多的液相量;另一方面煤灰中的碱性组分如Na+、K+、Ca2+、Mg2+等具有较低的离子势,在氧化性氛围中,能够破坏酸性高离子势组分与氧结合形成复杂离子或多聚物[34-36]的能力,从而表现出助熔作用。因此,准东煤灰高碱性氧化物含量大的特点使得其发生初始熔融的温度较低,半熔融态灰渣的量较大。
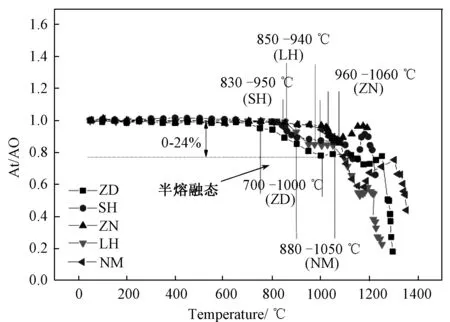
图2 五种煤灰熔融特性曲线Fig.2 Fusion characteristic curve of five kinds of coal ash

Ash sampleTemperature range of semi-molten slag t/℃Slag amount of semi- molten slag/%ZD770~10000~24SH830~9500~12ZN960~10600~15LH850~9400~13NM880~10500~8
本文对准东煤在450、550和650℃以及815℃四种不同温度下进行缓慢灰化制得灰样。观察灰皿内灰样可以发现,随着制灰温度的升高,灰样颜色加深。再进一步研究不同制灰温度下准东煤煤灰的熔融特性参数,结果见图3,表4。由图3可知,不同制灰温度下的准东煤煤灰表现出了不同的熔融行为。随着制灰温度的升高,其发生初始熔融行为对应的温度也相应升高,由700℃逐渐升高至770℃;而另一方面,煤灰发生初始熔融的量随着制灰温度的升高而呈现降低的趋势,415℃制得的煤灰在熔融过程发生初始熔融的量最大,达到38%,这说明随着制灰温度的降低,其沾污、结渣的倾向增强。由于随着制灰温度的升高,灰中碱金属的含量和形态发生了变化,尤其是碱金属Na的含量,如表2所示,Na2O的含量由5.28%降低到标准制灰温度下的3.82%。灰中的碱金属含量减少导致煤灰熔融的特性曲线出现了上述差别,在煤灰熔融的初始行为中,产生的低温共熔体的量相对减少,从而导致随着制灰温度的减低,煤灰发生初始熔融的温度降低,而熔融的量增加的现象,从而对煤灰的结渣特性产生影响。
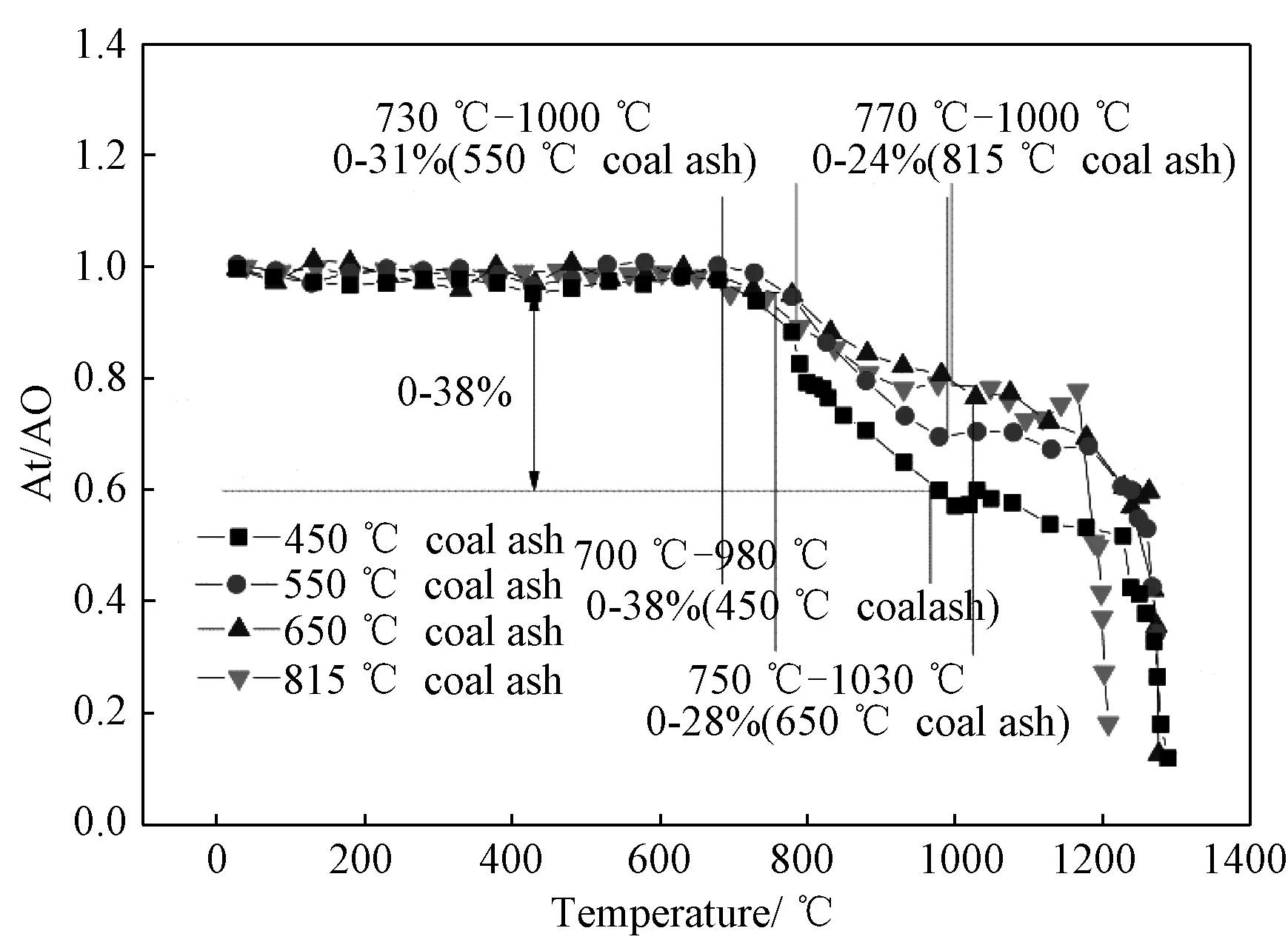
图3 不同制灰温度下准东煤灰熔融特性曲线Fig.3 Fusion characteristic curve of ZD coal ash with different making temperature

Ash-making temperature/℃Temperature range of semi-molten slag t/℃Slag amount of semi-molten slag/%450700~9800~38550730~10000~31650750~10300~28815770~10000~24
3.2 准东煤灰熔融元素迁移及矿物演变特性
由图4可知,准东煤在制灰过程中S元素从1200℃开始减少, 以SO2或者SO3形式释放出去,而此温度下其他元素相对稳定,这是因为在900度时已经有81%的Na挥发[37],当温度高于900℃时,整个灰样中Na的总含量变化不大,只会在不同形式之间转换,温度越高越有利于水溶性和酸溶性的Na转化为不溶性的Na[38],保留在灰中的这部分Na很有可能跟其他矿物发生低温共融;而1000℃到1200℃恰恰又是硫酸盐开始分解的温度区间[39],因此S含量发生了明显变化。
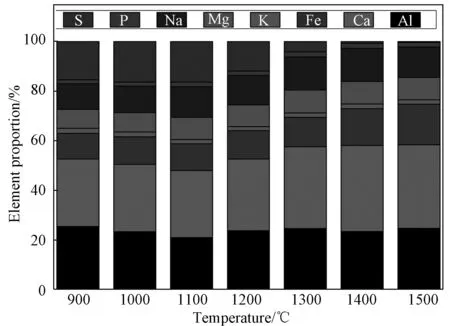
图4 准东煤在不同温度制灰所得样品的元素比例Fig.4 Element retio of high alkali coal with different temperature
图5为高碱煤随制灰温度升高所得的灰样的物相变化XRD图谱,表5为不同温度高碱煤灰矿物相列表。随制灰温度升高,灰样中晶相含量及种类逐渐减少,玻璃相逐渐增加。815℃灰中有NaAlSiO4,高于815℃时均没有此物相,与上文图3、4比较,正好在此温度区间高碱煤灰液相开始增加,可能是由于NaAlSiO4与灰中其他矿物质发生反应生成了低温共熔体。在815℃制得灰样中有SiO2、K2SO4、K0.25Na6Al6.24Si9.76O32、CaSO4、NaAlSiO4、Fe2O3六种矿物质,其中SiO2为主要矿物质,有相当含量的CaSO4,少量的NaAlSiO4、K2SO4,以及微量的K0.25Na6Al6.24Si9.76O32、Fe2O3。900℃时,灰中有SiO2、K0.25Na6Al6.24Si9.76O32、CaSO4、Fe2O3四种矿物质,K0.25Na6Al6.24Si9.76O32峰值相较于815℃标准灰中峰值减弱,并且原有K2SO4、NaAlSiO4物相消失,这说明此时这些矿物质可能参与了低温共熔体生成,增加了灰中液相。1000℃以上时,灰中液相进一步增加,到1200℃时高碱煤灰几乎全部熔融。

图5 准东煤在不同温度制得的灰样XRD图谱 Fig.5 XRD patterns of ZD ash with different temperature
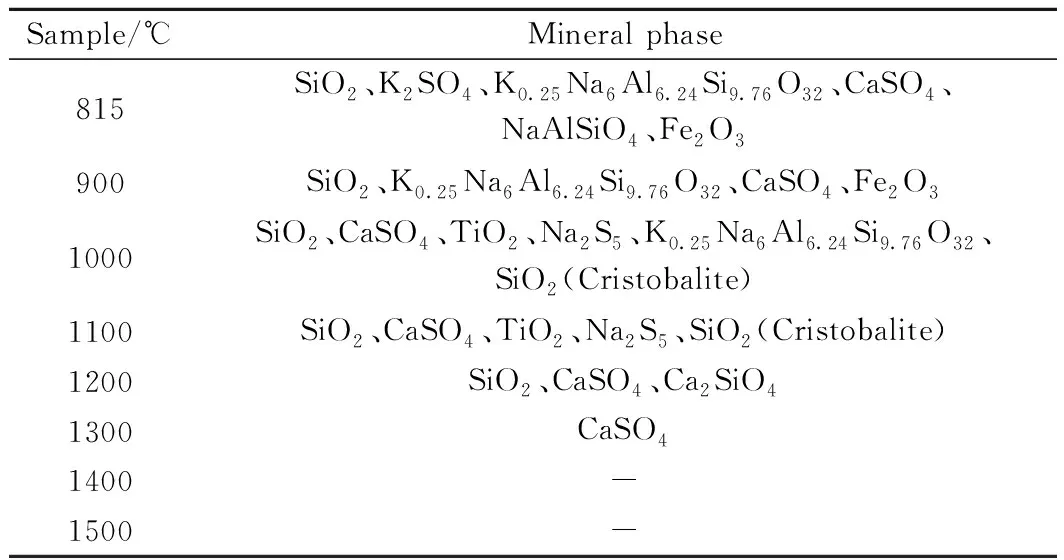
Sample/℃Mineral phase815SiO2、K2SO4、K0.25Na6Al6.24Si9.76O32、CaSO4、NaAlSiO4、Fe2O3900SiO2、K0.25Na6Al6.24Si9.76O32、CaSO4、Fe2O31000SiO2、CaSO4、TiO2、Na2S5、K0.25Na6Al6.24Si9.76O32、SiO2 (Cristobalite)1100 SiO2、CaSO4、TiO2、Na2S5、SiO2 (Cristobalite)1200 SiO2、CaSO4、Ca2SiO41300 CaSO41400 -1500 -
3.3 碱性矿物质降低高碱煤灰熔融特性机理
由上述实验结果可知,随着碱性矿物质的增加,灰的初始熔融温度降低,表现出易沾污结渣的特性。从ICP数据可知,煤中Na在900℃之后基本不随温度的升高而释放,说明碱金属改变熔融温度是由于Na的硅铝酸盐演变为低熔点共熔物而使灰中液相增加,进而降低灰熔点。由XRD分析可知,815℃时存在NaAlSiO4,而之后的温度区间这种碱性矿物消失,进一步支持ICP的结论,即随温度升高,其与其他矿物质形成了低温共熔体。下面通过计算NaAlSiO4的前沿轨道特性来分析其改变灰熔点的机理。
从分子层面分析碱性矿物质改变灰熔融机理,可以加深对灰沾污结渣特性的理解。图6为对钠长石结构优化后计算得到的最高占据分子轨道(HOMO)和最低空余分子轨道(LUMO)。
由图6可知,钠长石最高占据轨道和最低空余轨道完全由氧原子贡献,因此,对于钠长石,氧原子是活性反应位点。如图6(a)所示,对HOMO贡献最大的为硅氧四面体[SiO4]4-与铝氧四面体[AlO4]5-公用的氧原子,如O(10)、O(51)、O(49)、O(21)、O(12),而贡献较小的为两个硅氧四面体[SiO4]4-所公用的氧原子,如O(11)、O(13)、O(50)、O(52)、O(48),因此当其与其他含有电子受体的体系接触时,如K+、Mg2+等离子首先攻击O(10)、O(51)、O(49)、O(21)、O(12)等氧原子,将硅氧四面体[SiO4]4-与铝氧四面体[AlO4]5-分离,破坏其架状结构,多余的电子受体离子会进一步破坏硅氧四面体[SiO4]4-之间的连接,进一步地解离钠长石结构。被解离出来的硅氧四面体[SiO4]4-、铝氧四面体[AlO4]5-进一步与周围空间的K+、Mg2+、Na+等阳离子结合形成熔点较低的低熔点共熔物SiO2+Na2O+K2O(熔点540℃)、SiO2+Al2O3+K2O(熔点695℃)、SiO2+MgO+K2O(熔点700℃)等,致使煤灰在较低的温度下出现液相,加强了灰粒表面与水冷壁的润湿强度,使灰粒更容易附着在水冷壁表面。如图6(b)所示,相对于HOMO轨道,LUMO轨道的区域很小,所以当钠长石在煤灰中发生键的断裂进而形成其他能量更低的体系时,电子贡体的作用很小。
由上面微观分析可知,钠长石中对HOMO轨道贡献大的原子分布于各自体系的网络节点部位,其中这些原子在钠长石(熔点1118℃)中的分布最为均匀,如O(10)、O(51)、O(49)、O(21)、O(12),O(11)、O(13)、O(50)、O(52)、O(48)等原子,且它们对最高占据轨道贡献相差不大,各个原子对本体系HOMO轨道贡献越均匀,贡献大小差别越小,熔点越低,进而其体系越容易受到离子势小的离子的破坏[32-34],游离出的硅氧四面体、铝氧四面体的碎片越多,这些碎片进而与周围环境中的离子如K+、Mg2+、Na+等离子势较低的离子形成低温共熔体,进一步加剧煤灰中液相成分。

图6 钠长石表面HOMO(a)和LUMO(b)结构Fig.6 LUMO(a) and HOMO(b) map of albite surface
4 结 论
1. ZD高碱煤发生初始熔融时对应的温度为770℃左右,低于其他四种非高碱煤,最易发生沾污结渣现象。
2.随着ZD制灰强度的升高,其灰中碱金属的含量降低,导致煤灰初始熔融温度升高,沾污、结渣倾向减轻。
3. 不同温度ZD煤灰中S元素质量从1200℃开始减少,其他元素含量及质量在900~1500℃之间基本保持不变。
4. 钠长石最活跃的相变位点为其体系中硅氧四面体[SiO4]4-与铝氧四面体[AlO4]5-公用的氧原子,它们易受到灰中K+、Mg2+、Na+等离子势较低的离子的攻击,进而发生分子段的重组,形成熔点更低的低温共熔体。
