利用粉煤灰基X型沸石去除废水中的铜离子
2019-01-05,,,,,
, ,, , ,
(榆林学院化学与化工学院,陕西省低变质煤洁净利用重点实验室,陕西 榆林 719000)
1 前 言
随着我国经济的发展,过程工业中产生的重金属离子量呈逐年增加趋势,导致环境污染问题严重。重金属离子的污染治理已成为当下亟待解决的问题[1-3]。其中,Cu2+是常见的重金属污染物,主要来源于选矿、冶炼、电镀、化工以及印染等工业生产产生的废水,治理Cu2+的污染,防止其进入水体及土壤影响低等生物与植物的生长,阻断其进一步通过食物链富集进入人体发生毒害作用[4]。处理含Cu2+废水的主要方法有化学沉淀法、电解法、氧化还原法、蒸发浓缩法以及膜分离法等,但上述方法均存在能耗与处理成本较高等缺点。采用高效吸附材料对含Cu2+废水进行吸附净化,具有工艺简单,吸附材料可重复利用以及吸附速率较快等优点而被广泛应用[5-6]。
以纯活性炭为传统吸附剂的吸附法对Cu2+及其它重金属离子具有良好的去除效果,但表现为处理成本较高,吸附剂不可循环利用。采用火电行业排放的固体废弃物——粉煤灰为合成原料,制备不同孔道结构的沸石作为吸附剂处理水与空气中的污染物具有很高的潜在应用价值,尤以粉煤灰为原料合成的沸石吸附重金属离子的能力是普通沸石的3~5倍,是粉煤灰的6~7倍[7-8]。利用粉煤灰制备沸石并将其应用于废水中重金属离子的去除不但可以解决粉煤灰堆放造成的环境污染问题,而且可以有效提高水资源的利用效率,进一步缓解区域缺水的突出矛盾[9-10]。
基于以废治废的思路,本文采用经碱熔融-离心提取处理的粉煤灰作为合成NaX型沸石的原料,利用NaX型沸石处理含Cu2+废水,并详细研究了Cu2+在NaX型沸石上的吸附平衡、吸附动力学与热力学特性。
2 材料与方法
2.1 试剂与仪器
试验所用原料为:NaOH(分析纯);浓硝酸(分析纯);硅溶胶(工业品);Cu(NO3)·3H2O(分析纯);原料粉煤灰,其化学组成如表1所示。

表1 实验用粉煤灰的化学组成Table 1 Coal fly ash chemical composition of shaanxi yulin power plant
试验采用D/max-2500型全自动旋转靶X-射线衍射仪(XRD)对NaX沸石样品进行结构表征;采用Sigma 300 型电子扫描显微镜(SEM)测定样品的形貌;采用QUADRASORB SI型物理吸附仪测定样品理化性能参数;采用AA-6800F型原子吸收分光光度计测定模拟废水溶液中离子的浓度;采用Zetasizer Nano分析仪测定样品表面电荷性质。另外,在样品的制备过程中使用78-1磁力加热搅拌器、HH-1智能油浴仪、AL-204电子天平和Phs-3c精密酸度计完成样品的制备与性能测试。
2.2 粉煤灰基X型沸石的合成
将粉煤灰研磨至180目以下与一定量的NaOH混合均匀后放入坩埚中,置于管式炉中在一定温度下焙烧2h后自然冷却至室温。将焙烧产物研磨至200目以下,调节体系碱度,搅拌30min彻底溶解后离心提取上层白色胶状液备用。取30ml的上层提取液置于烧杯中搅拌,按照投料配比为4.8n(Na2O)∶n(Al2O3)∶3.7n(SiO2)∶180n(H2O)依次补加NaOH、NaAlO2、硅溶胶,室温下搅拌一定时间后,移至水热反应釜中密封,升温至100℃后在自生压力条件下进行晶化,后经洗涤、过滤、干燥后得到合成样品备用。
2.3 吸附实验
将一定质量的Cu(NO3)2·3H2O溶解于一定量的蒸馏水中,加入一定量的硝酸,分别配置成不同质量浓度的含Cu2+标准溶液,按照实验需求,将Cu2+标准溶液稀释成相应质量浓度的待用液。吸附实验采用静态吸附,取不同浓度的含Cu2+模拟废水置于100mL的烧杯中,适当调节模拟废水的pH值,精确称取一定量的粉煤灰基X型沸石加入烧杯搅拌,在25℃下吸附,再经离心分离后测定Cu2+的浓度。去除率η和平衡吸附容量Qe的计算公式如下:

(1)
(2)
上式中,C0为模拟废水Cu2+的初始浓度,mg·L-1;Ct为吸附后溶液中Cu2+的浓度,mg·L-1;Qe为平衡吸附量,mg·L-1;V为含Cu2+的溶液体积,L;m为煤灰基X型沸石的投加量,g。
3 结果与讨论
3.1 合成粉煤灰基X型沸石的表征
从表1中可见,粉煤灰中SiO2和Al2O3的质量之和约占总质量的73%,是合成沸石的理想原料。从图1(a)所示的粉煤灰样品XRD谱图中可以发现,粉煤灰中的化学成分主要以石英和莫来石的形态存在,图1(b)是经碱熔融-离心处理后合成的粉煤灰基X型沸石的衍射谱图,谱图中无杂晶衍射峰且基线平整,说明合成样品纯度极高。图2为合成样品的N2-吸附-脱附等温线与BJH孔径分布图,根据N2-吸附-脱附等温线计算可得样品的BET比表面积为872.52m2·g-1,总孔容为0.341cm3·g-1,由BJH孔径分布图(插图)可以发现,样品的孔径约为0.74 nm。上述结果说明,粉煤灰经碱熔融-离心处理后合成的样品为典型的X型沸石,纯度极高、且BET比表面积较大。

图1 粉煤灰与粉煤灰基X型沸石的XRD谱图Fig.1 XRD spectra of coal fly ash and zeolite X synthesized from coal fly ash
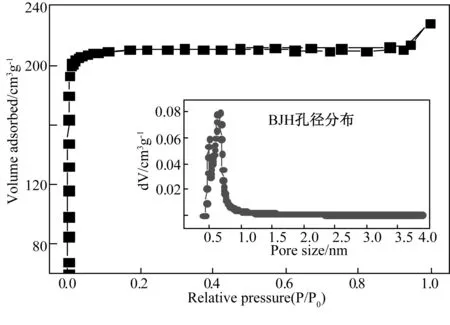
图2 粉煤灰基X型沸石的N2-吸附-脱附等温线及BJH孔径分布图Fig.2 N2-adsorption-dessorption isotherm and BJH pore size distribution of zeolite X synthesized from coal fly ash
图3为粉煤灰基X型沸石的SEM形貌照片。由图可见,合成样品中包含约2μm大小、均匀分布的颗粒,颗粒形貌呈八面体状,是典型的X型沸石晶体形貌。

图3 粉煤灰基X型沸石的SEM图像Fig.3 SEM photography of coal fly ash and synthesis zeolite X
3.3 溶液pH值对Cu2+吸附的影响

图4 pH值对粉煤灰基X型沸石去除模拟废水中Cu2+效果的影响Fig.4 Effect of pH of removal of Cu2+ with zeolite X synthesized from coal fly ash

图5 粉煤灰基X型沸石的Zeta电位与pH的关系Fig.5 Relationship between Zeta potential and pH of zeolite X synthesized from coal fly ash
图4为溶液pH值对粉煤灰基X型沸石去除Cu2+效果的影响。从图可见,当pH=2时,Cu2+的去除率较低,导致这种情况的原因可能是在强酸环境中,一方面溶液中的H+与Cu2+构成了竞争吸附的关系,争夺X型沸石表面的活性位点导致去除率相对较低;另一方面,结合图5中pH与Zeta电位之间的关系,当pH=2时,样品表面荷正电导致Cu2+与Na+间发生排斥效应,影响溶液中Cu2+的去除效率。随着吸附溶液pH的升高,Cu2+的去除率逐渐增大,这是因为溶液中H+的含量下降导致竞争效应显著削弱,且样品表面荷负电(如图5所示)促进了Cu2+的吸附速率。当含Cu2+废水pH≥8时,Cu2+与OH-作用生成Cu(OH)2沉淀,使得Cu2+的去除率接近100%。综上所述,本实验选择pH=6的含Cu2+模拟废水进行研究。
3.4 吸附动力学
本文采用准一阶、二阶动力学,Elovich动力学以及粒子内扩散模型研究粉煤灰基X型沸石对含Cu2+模拟废水的吸附动力学特性,通过对实验数据的非线性拟合,进一步研究其过程吸附反应级数与吸附机理。
准一级动力学方程:
Qt=Qe[1-exp(-k1t)]
(3)
h0=k1Qe
(4)
准二级动力学方程:
(5)
(6)
Elovich动力学方程:

(7)
粒子内扩散模型:
(8)
上述式中:Qt和Qe分别为t时刻和平衡时刻粉煤灰基X型沸石对Cu2+的吸附量(mg·g-1);k1为准一级动力学常数(min-1);k2为准二级动力学常数(g·mg-1·min-1);h0为起始吸附速率(mg·g-1·min-1);α为初始吸附速率常数(mg·g-1·min-1);β为初始脱附速率常数(g·mg-1);kd为离子内扩散常数(mg·g-1·min-1/2)。
选择不同的动力学模型确定粉煤灰基X型沸石吸附Cu2+达到平衡所需的时间,进而研究该吸附过程的控速步骤与吸附机理。图6为不同溶液浓度下粉煤灰基X型沸石吸附Cu2+的量随时间变化的准一阶、准二阶以及Elovich模型动力学拟合曲线,拟合结果如表2所示。
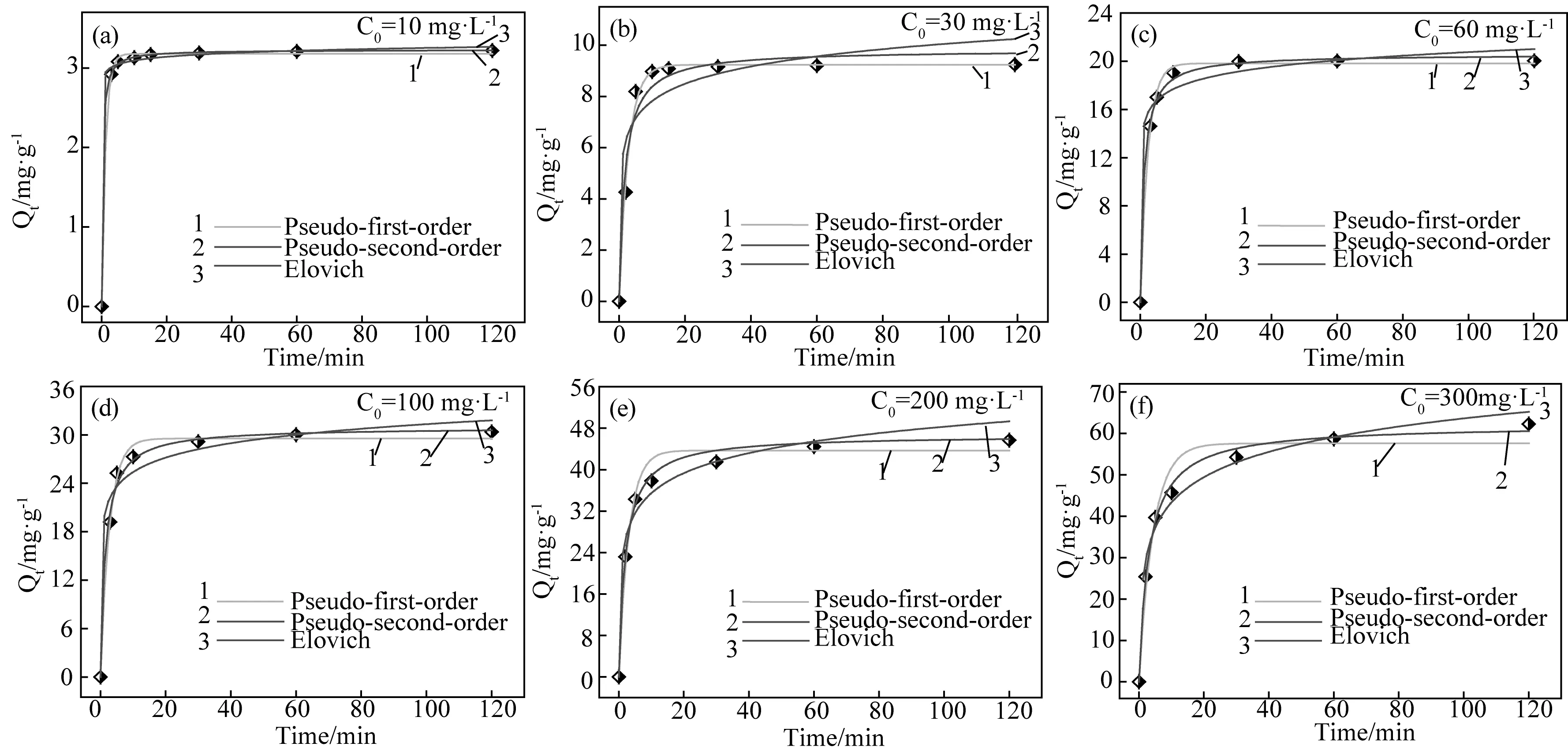
图6 不同废水溶液Cu2+浓度下粉煤灰基X型沸石吸附Cu2+的量随时间变化的准一阶、准二阶以及Elovich模型动力学拟合曲线Fig.6 Non-linear fits of pseudo-first-order, pseudo-second-order and Elovich kinetic models to the Cu2+ adsorption at different concentrations with zeolite X synthesized from coal fly ash

kinetic modeCu2+ concentration in simulated waste water/mg·L-1103060100200300Qe,exp/mg·g-13.229.2420.0430.3645.4862.28Pseudo-first-order kinetic modeQe/mg·g-13.189.2319.8329.5343.6257.60k1/min-10.81790.45530.42210.35630.33990.2781h0/mg·g-1·min-12.60094.20248.370210.521514.826416.0186R20.99960.99950.99760.99400.98430.9594Pseudo-second-order kinetic modeQe/mg·g-13.289.7820.1730.5446.0862.38k2/g·mg-1·min-11.04390.05880.04370.02130.01210.0053h0/mg·g-1·min-1R20.99910.99300.99980.99850.98960.9828Elovich kinetic modeα/mg·g-1·min-11.56×10176.78×1057.38×1044839.86800.80119.78β/g·mg-114.411.32530.74790.38770.14550.1134R20.95790.87870.99460.96830.99890.9992
从图6a及6b中可见,当模拟废水溶液初始浓度(10~30mg·L-1)较低时,吸附达到平衡所需的时间约为15min。分别用准一阶、准二阶及Elovich动力学模型对上述实验数据进行非线性拟合,拟合结果表明准一阶动力学具有更高的相关系数,且平衡吸附量值更接近于实验值。拟合结果说明在此条件下的吸附过程中,由于吸附剂表面的活性位点数目远超于溶液中被吸附的Cu2+的数目,因此,吸附过程符合准一阶动力学方程。从图6(c~f)中可以发现,随着吸附溶液浓度增大(60~300mg·L-1)时,吸附达到平衡所需的时间约为30~50min,非线性拟合结果表明准二阶动力学模型具有较高的相关系数,平衡吸附量值更接近于实验值,这主要是吸附剂表面的活性位点和Cu2+的浓度两者共同作用,进而使化学吸附在该吸附过程中起主导作用,从而影响粉煤灰基X型沸石的吸附平衡时间和平衡吸附量。
在实验浓度范围内,使用Elovich动力学模型研究吸附速率α与脱附速率β,拟合结果均具有较高的相关系数(除C0=30mg·L-1之外),在C0=300mg·L-1时,吸附速率α(119.78)较脱附速率β(0.1134)相差较大,说明粉煤灰基X型沸石再生性能优异,在后续的工程应用中,可有效降低吸附剂使用成本。
图7为粉煤灰基X型沸石吸附不同含Cu2+量的模拟废水溶液离子内扩散模型下线性拟合图。从图中可以看出,在吸附浓度范围内,初级阶段线性拟合结果具有较大的斜率,完成时间较短(约5min),说明在第一线性阶段中,主要是Cu2+快速地通过外扩散吸附在吸附剂的表面。在第二线性阶段中,拟合的斜率较第一阶段明显减小,完成吸附所需时间(约50min)显著变长,说明这一过程主要受粒子内扩散过程速率的影响,导致第二阶段的斜率显著下降,而在C0=30mg·L-1的吸附过程中并未出现,说明高的Cu2+浓度对第二阶段具有显著的影响效果。在第三线性阶段,由于溶液中Cu2+的浓度持续降低,粒子内扩散过程显著衰弱,快速进入吸附平衡阶段。

图7 粉煤灰基X型沸石吸附Cu2+量的粒子内扩散模型线性拟合图Fig.7 Linear fit of intraparticle diffusion for Cu2+ adsorption with zeolite X synthesized from coal fly ash
3.5 吸附等温线
在室温条件(温度为25℃)下,研究粉煤灰基X型沸石吸附模拟废水中Cu2+的过程,可采用描述固-液等温吸附过程的Langmuir方程、Freundlich方程和Redlich-Peterson方程对此进行研究。
Langmuir等温方程式:
(9)
Freundlich等温方程式:
(10)
Redlich-Peterson等温方程:
(11)
以上式中:Qe为平衡吸附量(mg·g-1);KL为Langmuir平衡吸附常数(L·mg-1);Ce为平衡时溶液中Cu2+的质量浓度(mg·L-1);Qmax为饱和吸附量(mg·g-1);KF和n为Freundlich常数;KRP、αRP和g为Redlich-Peterson常数。
通过选择有效的热力学模型对实验数据进行非线性拟合获取的吸附等温线,可以得到吸附材料的最大吸附容量、吸附相关系数等参数来确定其在在吸附单元操作中的应用范畴。图8为粉煤灰基X型沸石等温吸附Cu2+的不同热力学模型拟合曲线,拟合结果如表3所示。

图8 粉煤灰基X型沸石吸附Cu2+的量随废水溶液中的Cu2+浓度变化的Langmuir、Freundlich及Redlich-Peterson模型热力学拟合曲线图Fig.8 Non-linear fits of Langmuir, Freundlich and Redlich-Peterson isotherm models to the Cu2+ adsorption at different concentrations with zeolite X synthesized from coal fly ash

LangmuirFreundlichRedlich-PetersonQm=144.99KF=0.8681KRP=0.4844KL=0.0025nF=1.3315αRP=0.0501RL=0.5714~0.9756g=0.8756R2=0.9957R2=0.9846R2=0.9939
实验结果表明,Langmuir与Redlich-Peterson等温吸附模型较Freundlich等温吸附模型具有更高的拟合相关性,更符合粉煤灰基X型沸石吸附Cu2+的过程。采用Redlich-Peterson等温吸附模型对实验结果进行拟合,发现常数g=0.8756,更加接近与1,说明粉煤灰基X型沸石吸附含Cu2+的模拟废水过程更符合Langmuir等温吸附模型;进一步研究Langmuir模型拟合结果,发现平衡吸附常数RL介于0到1之间(RL=0.5714~0.9756),说明粉煤灰基X型沸石表面分布着不均匀的活性吸附位点,且该非均相吸附过程以物理吸附为主,研究结果说明粉煤灰基X型沸石再生性能优异、工业应用价值较高。
3.6 吸附热力学
粉煤灰基X型沸石吸附溶液中Cu2+的过程,可通过(12)~(14)计算其热力学平衡常数KD、吉布斯自由能变化ΔG、吸附反应的焓变ΔH和熵变ΔS:
ΔG=-RTlnKD
(12)
(13)
ΔG=ΔH-TΔS
(14)
式中:R为理想气体常数(J·mol-1·K-1);T为绝对温度(K)。
粉煤灰基X型沸石对Cu2+吸附过程的热力学参数计算结果见表4。从表中可以发现,KD值随着吸附温度的升高而增大,说明此过程为吸热吸附过程;在实验吸附温度下,ΔG的值为负,说明该吸附过程为自发过程,且在相对较高的温度下有利于吸附过程的自发进行。

表4 粉煤灰基X型沸石吸附Cu2+的热力学参数Table 4 Thermodynamic parameters of Cu2+ adsorption with zeolite X synthesized from coal fly ash
4 结 论
1.以粉煤灰为原料采用碱熔融-离心处理后制备的X型沸石纯度极高,BET比表面积为872.52m2·g-1,总孔容为0.341cm3·g-1,对Cu2+具有优良的吸附效能,且
在pH=6时,对Cu2+的吸附平衡量达到最大值。
2.粉煤灰基X型沸石对Cu2+的吸附过程中,在低Cu2+溶液浓度(10~30mg·L-1)时,吸附平衡所需时间约为15min,吸附过程更符合准一阶动力学方程;在较高Cu2+溶液浓度(60~300mg·L-1)时,吸附平衡时间显著增大,吸附过程遵循准二阶动力学方程;Elovich动力学模型说明粉煤灰基X型沸石再生性能优异。
3.粉煤灰基X型沸石对Cu2+的吸附与Langmuir吸附等温方程更加一致,非线性拟合相关系数最大,说明该等温吸附过程为典型的单分子层吸附。
4.粉煤灰基X型沸石对Cu2+的吸附过程是可自发的吸热过程。
