基于Cre-LoxP系统的条件性定点敲入人源hRas基因小鼠的建立*
2019-01-03刘甦苏周舒雅王辰飞李保文范昌发
刘甦苏 吴 曦 周舒雅 王辰飞 左 琴 李保文 范昌发
(中国食品药品检定研究院,北京 100050)
c-Ha-ras(简称hRas)是人源ras原癌基因家族的一员,编码由189个氨基酸组成的p21蛋白。p21蛋白是细胞内信号传导系统中的重要信号转导因子,对细胞的增殖和分化起着调节作用[1-3]。本实验室在早期利用传统的转基因技术建立了表达人类原癌基因hRas的C57BL/6 -Tg-hRas小鼠模型[4](简称Tg-hRas)并获得了专利批准[5]。目的基因表达分析提示转入hRas基因在小鼠13个主要脏器中均表达[6],阳性致癌物给药实验也表明该模型较野生型小鼠敏感。目前正在推动该模型在药物临床前安全性评价的应用[7-8]。
随着生物技术的发展,近几年出现了条件性基因打靶技术[9]。该方法是在常规基因敲除的基础上,利用重组酶介导的位点特异性重组技术,可对生物基因打靶的范围和时间进行控制,将目的基因在生物特定类型的细胞或发育的特定阶段中进行表达[10-11],其优势在于比传统的转基因技术更加稳定。利用这一新型的条件打靶技术,本实验室又构建了针对hRas基因构建基于Cre-LoxP系统的条件性定点敲入小鼠模型(hRasfl/+小鼠),以期通过新建小鼠模型与不同组织器官表达Cre重组酶的工具小鼠交配,获得hRas基因在特定组织器官条件性表达的一系列小鼠模型,为新药的临床前致癌性安全评价及抗癌药物的研发及癌症机制研究提供新的实验动物模型。本文选取了全身性表达的EIIa-cre小鼠与新建模型进行交配,并对其后代特性进行了分析。
1 材料与方法
1.1 材料
1.1.1实验动物:B6.FVB-Tg(EIIa-cre)C5379Lmgd/J小鼠(以下简称EIIa-cre小鼠)引自美国Jackson实验室,纯合子小鼠引自美国Jackson实验室,本品系EIIa启动子调控Cre基因的表达,在小鼠胚胎早期(特别是1-细胞期)表达Cre重组酶。Cre介导的重组发生在动物发育的所有组织中,并且可以通过生殖细胞将遗传改造传递给后代[12]。小鼠引进后在中国食品药品检定研究院实验动物中心进行繁殖;C57BL/6 J、BALB/C、KM小鼠来自中国食品药品检定研究院实验动物研究所,动物生产许可证号为SCXK(京)2014-0013。繁育环境为SPF级,饲养和实验在清洁级环境中进行,饲喂SPF级小鼠颗粒饲料,其生产许可证号为京饲证(2014)06054,饮用灭菌自来水。本实验在中国食品药品检定研究院实验动物伦理委员会监督下进行。
1.1.2主要仪器及试剂:限制性内切酶、T4DNA 连接酶、Taq酶、TRIzol试剂、RT-PCR 试剂盒、SYBR Premix Ex TaqⅡ荧光定量PCR试剂盒等(大连宝生物公司);琼脂糖及其他生化试剂为进口分装、DMEM高糖培养基、L-谷氨酞胺、非必需氨基酸、青链霉素溶液、巯基乙醇、胎牛血清 (ES细胞认证)、二甲亚枫(DMSO)、PBS缓冲液pH7.2、EDTA等试剂分别购自Gibco、Sigma和HyClone公司。
Roche 480Ⅱ荧光定量PCR仪(Roche);Nano Drop超微量分光光度(Thermo);微量移液器(Eppendorf);引物由诺赛基因公司合成;TE缓冲液、TAE缓冲液自行配置;其他常见生化试剂乙醇、异戊醇、苯、氯仿购自北京化学工业集团有限公司。
1.2 方法
1.2.1基于Cre- LoxP系统的人源hRas基因条件性定点敲入小鼠模型的载体构建:首先从人类cDNA中扩增获得hRas目的基因,该基因包含4个外显子,全长596 bp,扩增引物为Ai3-hRas-F /Ai3-hRas-R,序列及退火温度见(表1)。随后将目的基因cDNA导入改造后的Ai3载体中,该载体包含Rosa26基因的同源重组臂、筛选基因新霉素(Neo),CAG强启动子,并且利用Cre-LoxP系统,在启动子与目的基因之间加入转录终止序列“STOP”,以获得目的基因在特定的组织或细胞中的调控表达。具体打靶载体策略见图1。

表1 小鼠构建及基因型鉴定及QRT-PCR引物序列及退火温度Table 1 Primer and Tm information in hRas and gene identification by PCR and real-time RT-PCR method

图1 人源hRas基因打靶载体Fig.1 The construction of hRas targeting strategy
1.2.2电击转染ES细胞:转染前用XhoI酶将经酶切鉴定成功的载体进行线性化,同时ES 细胞用胰酶消化后重悬于PBS中。取40μg载体DNA与1 mL细胞混匀,加入电穿孔槽中穿电击,电穿孔条件:电压280 V,电容500F,时间10 ms。将电击后的细胞分入已铺好滋养层细胞的培养皿中,置于CO2孵箱中培养,20 h 后换成ES 细胞筛选G418培养液。
1.2.3ES 细胞阳性克隆的筛选和Southern blot鉴定:克隆筛选条件为含有300μg/ mL G418,筛选10 d,每天更换ES 细胞筛选培养液,第10 d挑取ES 细胞克隆。将挑取的单个未分化ES 克隆置于96 孔板中,充分消化后转移至24 孔培养板上扩增并提取基因组DNA,在恒定电压下,将DNA样品放在0.8%琼脂糖凝胶中进行电泳,在转移到尼龙膜和紫外线交联后,预杂交和杂交参考罗氏地高辛试剂盒使用说明操作。
1.2.4囊胚注射制备嵌合体小鼠:
(1)囊胚的收集:选取4 周龄的BALB/c雌鼠,48 h间隔注射孕马血清促性腺激素和人绒毛膜促性腺激素促进排卵,与小鼠合笼后次晨检查阴栓,记为0.5 d。第3.5 d取其胚胎,置37°C、5% CO2培养箱中培养备用。
(2)囊胚显微注射:经鉴定的阳性打靶ES细胞复苏并传代后, 用 0.25%的胰酶消化成单细胞悬液置于冰盒, 用于囊胚显微注射,每个囊胚注射10~15个ES细胞,注射后置37°C、5% CO2培养箱中恢复1~2 h后进行胚胎移植。
(3)囊胚移植: 选用KM小鼠做假孕母鼠,挑选发情前期和发情期雌鼠, 1∶1与结扎雄鼠交配, 次日检栓, 单笼饲养备用, 见栓当天为0.5 d,子宫移植用2.5 d假孕鼠。移植成功等小鼠出生7~10 d后由毛色初步判断是否为嵌合体小鼠。
1.2.5杂合hRasfl/+小鼠的繁育:嵌合小鼠出生后,根据毛色筛选嵌合率在50%及以上的雄鼠,将其与野生的C57BL/6 J小鼠扩繁后代,在其后代中通过PCR、Southern blot方法鉴定后,获得可遗传的杂合子hRasfl/+小鼠。
1.2.6全身细胞表达人源hRas基因的基因敲入小鼠的建立:首先将筛选得到的hRasfl/+杂合小鼠自身交配,获得hRasfl/fl纯合小鼠;再用hRasfl/fl与EIIa-cre纯和小鼠杂交,获得全身细胞表达人源hRas基因敲入纯合子小鼠(简称hRas-EIIa-cre小鼠)。

图2 基于Cre- LoxP系统的全身表达hRas基因敲入小鼠模型繁殖示意图Fig.2 Breeding schematic of hRas gene conditional knock in mouse using the Cre- Loxp strategy
1.2.7hRas-EIIa-cre全身表达敲入小鼠基因表达量测定:分别取E10至E14 d的经基因型鉴定的hRas-EIIa-cre小仔胚胎,E15及E17 d检栓成功hRas-EIIa-cre母鼠的胎盘组织,以及E13 d的Tg-hRas小仔、C57BL/6野生型小仔的胚胎进行荧光定量RT-PCR(qRT-PCR)检测,并比较其表达量。
1.2.8总RNA的提取以及逆转录反应:Trizol法提取总RNA,取等量各组织总RNA,除去基因组DNA进行逆转录反应。逆转录采用宝生物的Prime Script TM RT reagent Kit,逆转录反应体系20 μL其中总RNA 1 μL,具体操作参照说明书。反转录得到c-Ha-ras基因cDNA后,以cDNA为模板进行PCR扩增。
1.2.9荧光定量RT-PCR(qRT-PCR)检测基因表达水平:选用GAPDH 内参基因,设计qRT-PCR 引物,hRas基因特异上游引物为RQ-RAS-F,下游引物为RQ-RAS-R,目的片段长177 bp,序列及退火温度见表1。进行反应时,测定cDNA 溶度,稀释终溶度为50 ng/μL,qPCR反应体系:SYBR Premix Ex Taq II(TliRNase H Plus)10.0 μL,上下游引物(10 μmol/L)各0.3 μL,cDNA模板2 μL,ROX Reference Dye II(50×)0.4 μL,加ddH20至20 μL。反应条件:95 ℃ 30 s 预变性,随后95 ℃ 5 s,62 ℃ 30 s,40个循环。
2 结果
2.1 打靶载体的构建及其中人源hRas基因的鉴定
本研究将hRas基因连接到Ai3打靶载体中,根据打靶载体构建原理设计两对鉴定引物,其中Ai3-hRas-F/R鉴定大小、hRAS-523F及WPRE-R鉴定片段方向(见表1);并通过PCR鉴定目的片段大小及方向,将筛选到的克隆进一步用限制性内切酶酶切后明确片段的正确性。第一次共筛选到8个正确大小的克隆,目的片段为596 bp(图3A),但是通过Ncol内切酶的酶切鉴定后,8个克隆均未能成功酶切,实验结果表明这8个克隆不是正确克隆(图3C);随后又通过菌落PCR鉴定、正确克隆摇菌、提取质粒、酶切检测等步骤,筛选得到3号一个正确克隆,目的片段370 bp(图3B),经过BamHI、HindIII、EcoRI+EcoRV内切酶酶切后结果显示该克隆正确,部分结果见(图3D)。
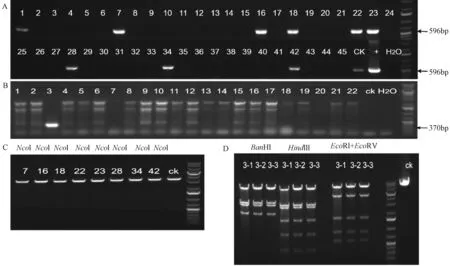
图3 人源hRas基因的鉴定和克隆筛选注:A:hRas基因连接到Ai3打靶载体中第一次筛选到8个正确大小的克隆,目的片段为596 bp;B:hRas基因连接到Ai3打靶载体中第二次筛选到1个正确大小的克隆,目的片段为370 bp; C:将筛选到的第一次8个克隆用Ncol内切酶的酶切结果;D:将筛选到第二次1个克隆用内切酶的酶切结果Fig.3 Identification and cloning of human hRas geneNote: A:The results for the first time of hRas plasmid result; B:The results for the second time of hRas plasmi dresult;C:The results for the first time of Ncol enzyme;D:The results for the second time of BamHI、HindIII、EcoRI+EcoRV enzyme
2.2 同源重组 ES 细胞克隆的Southern blot鉴定
选择3号克隆进行Ai3-hRas-knock-in载体线性化,电转染到 ES 细胞中。经过 G418筛选培养7 d 后发现并挑取 96 个药物抗性 ES 细胞克隆,提取其基因组 DNA 样本并进行Southern blot鉴定。分别从两端各设计一对探针(图4A),Southern blot目的片段分别为3'端为5.5Kb,5'端为12.1Kb,经过初筛和复筛,共获得阳性克隆12个(图4B)。

图4 基因组DNA进行Southern检测注:A:探针设计示意图;B:3′端探针Southern检测结果;C:5′端探针Southern检测结果Fig.4 DNA expressions human hRas gene in ES by Southern blottingNote:A:The modes of Probe design strategy sketch; B:Result of 3′end Southern blot; C:Result of 5′end Southern blot
2.3 阳性ES克隆囊胚注射、嵌合体雄鼠繁育得到hRasfl/+基因敲入小鼠
选择A11号克隆进行显微囊胚注射,移植了48枚胚胎,出生9只小鼠,最终得到6只嵌合鼠,其中4只雄鼠,毛色嵌合率大于50%的有1只;2只雌鼠,毛色嵌合率均小于50%。将嵌合率大于50%嵌合雄鼠与野生型C57BL /6 J雌鼠进行交配获得了21只F1代小鼠,取这些小鼠鼠尾的DNA 进行PCR鉴定,根据打靶载体设计了两对区分基因型的引物,分别为Rosa-GT-F/R,WPRE-F/R,具体引物信息见(表1),最终得到4只hRasfl/+杂合子小鼠,雌雄各半。将自主建立的4只hRasfl/+杂合子小鼠,雌雄比例1∶1,将其两两交配后得到29只F2代小鼠,经剪尾及PCR检测筛选小鼠基因型,仅保留10只hRasfl/fl纯合子小鼠,雌雄各半,基因型鉴定结果见(图5)。

图5 hRasfl/+小鼠基因型鉴定结果注:M:D-2000 marker;hRasfl/+:hRas基因杂合子小鼠;hRasfl/fl :hRas基因纯合子小鼠;WT:野生型小鼠;CK-:阴性对照Fig.5 Analysis of the genotype of hRasfl/+knockin mice.Note: M:D-2000 marker;hRasfl/+:hRas gene Heterozygote mice;hRasfl/fl :hRas gene Homozygote mice;WT:wide type;CK-:negative control
2.4 hRasfl/flEIIa-cre基因敲入小鼠的繁殖及基因表达水平结果
采用1∶1的方式,用8周龄hRasfl/fl雄鼠与EIIa-cre纯合雌鼠共交配3次,每次8只,检栓成功11只母鼠;采用8周龄EIIa-cre纯合雄鼠与hRasfl/fl雌鼠共交配3次,每次5只,检栓成功7只母鼠,观察到18只检栓成功母鼠均有明显腹部怀孕现象,但是到胚胎发育到13 d后母鼠腹部减小,21 d孕期结束未有新生小鼠出生(表2)。重新交配后,待母鼠怀孕13 d进行解剖后均见黑色胎盘以及吸收的胚胎。取未吸收完全的5只剩余胚胎经基因型鉴定为cre基因阳性,记为hRas-EIIa-cre胚胎;采用8周龄hRasfl/fl雄鼠与EIIa-cre纯合雌鼠交配检栓成功后,在E13解剖母鼠,取出胚胎,检测hRas基因表达水平并与同期的Tg-hRas模型比较。结果表明hRas-EIIa-cre敲入小鼠E13的胚胎与Tg-hRas模型目的基因表达水平相当,说明构建的hRasfl/fl小鼠与EIIa-cre工具鼠交配后,转入基因在胚胎中表达(见图6A~D)。

表2 hRasfl/fl EIIa-cre基因敲入小鼠的繁殖情况Table 2 The breeding records of hRasfl/fl EIIa-creknockin mice

图6 与Cre工具鼠交配后仔鼠及胚胎基因型鉴定及表达水平注:A:左侧为正常13 d的小鼠胚胎,右侧为未完全吸收胚胎;B:hRas-EIIa-cre怀孕13 d母鼠子宫,可见黑色胎盘及未完全吸收胎儿;C:hRas-EIIa-cre胚胎的PCR检测结果,500 bp条带为所整合的Cre基因,1-5分别表示5只未吸收的胚胎,CK+及CK-表示阳性、阴性对照;D:小鼠E13 d胚胎qRT-PCR结果图。Fig.6 Analysis of the PCR genotyping and qPCR ofhRas-EIIa-creknockin mice.Note:A:the normal mouse embryos for 13 days(left), not completely absorbed embryo for 13 days (right); B:hRas EIIa-cre 13 days mother’swomb;C:PCR genotyping of hRas knockin mice, Primer pair was designed in Creallele; D:Relative real-time PCR of hRasm RNA in hRas-EIIa-cre mice、Tg- hRas and C57BL/6 control mice at embryos for 15.5 days
2.5 不同日龄hRas-EIIa-cre基因敲入小鼠胚胎期hRas基因表达水平检测
为进一步探讨hRas-EIIa-cre基因敲入小鼠胚胎期死亡原因,随后在母鼠怀孕后E10.5~14.5 d解剖母鼠,取出未吸收胚胎,检测并比较hRas基因表达水平。结果表明hRas-EIIa-cre敲入小鼠E10.5~14.5 d的胚胎目的基因表达水平总体呈现一个上升趋势,13 d后表达水平明显增加,这一现象与观察到的母鼠怀孕13.5 d后腹部减少现象一致。进一步在母鼠怀孕后E15.5 d解剖多只母鼠,观察到子宫内只剩黑色的胎盘,胎儿全部被吸收,取胎盘组织进一步检测hRas基因mRNA表达水平并与母体比较,发现胎盘中表达量是母体的404倍(图7)。

图7 不同日龄hRas-EIIa-cre基因敲入小鼠胚胎期hRas基因表达水平Fig.7 hRas gene mRNA expressed in hRas-EIIa-creembryos for different days by qPCR technology
3 讨论
本研究运用Cre-LoxP系统建立了带有hRas基因敲入的小鼠模型(简称hRasfl/fl),在其hRas靶基因前端的终止子序列两侧插入LoxP序列,表型上等同于野生型,但是当其与不同表达Cre重组酶的转基因小鼠交配后,能删除两个LoxP位点之间的终止子序列,Cre-LoxP位点依赖的重组便会发生在表达Cre酶的细胞中,并导致该特定细胞中靶基因的改变,从而获得了hRas表达的可获得组织特异性基因敲入小鼠,即hRas-cre小鼠。
选用全身组织表达Cre重组酶的EIIa-cre小鼠试图获得全身hRAS基因高效表达的小鼠模型,但交配6批次后依然没有仔鼠出生。小鼠的胚胎发育是一个极为特殊的分化过程,既包括细胞数目的不断增殖,也包括细胞不断地退出细胞周期,分化为具有不同功能的终末细胞。李郦等研究表明p21基因表达信号从 E10.5 d开始参与小鼠胚胎发育,到E13.5 d逐步增强[13],这一结果与本实验观察到的母鼠13 d后腹部变小的现象一致,说明转入基因启动了表达随即影响了胚胎的进一步发育。
本实验室在构建hRasfl/fl小鼠时采用了CAG启动子,它是人工构建的组合启动子,由巨细胞病毒早期增强子和鸡β-肌动蛋白启动子组成,用于驱动基因在哺乳动物载体的高水平表达[14]。早期构建Tg-hRas模型时,采用的是转基因方法且使用了自身启动子,而这次使用了CAG启动子,可实现外源基因在组织中高表达,这可能是导致EIIa-cre小鼠胚胎致死的一个原因。随后本研究进一步检测并比较了hRas-EIIa-cre和Tg-hRas两种模型的hRas基因表达水平,在E13.5 d的胚胎中插入基因差异不明显,但随着时间的增加hRas-EIIa-cre模型中hRas基因表达水平明显逐步增加,特别是在E15.5 d时检测胎盘组织的表达量是母体的404倍。小鼠胎盘最外层为蜕膜层,属于母体来源。其次为成胶质细胞层,成胶质细胞层和蜕膜层中间散在分布着巨细胞[15],各种胚外组织形成一个统一的生命支持系统,在子宫中维持,营养并保护胚胎[16]。胎盘组织是一个融合组织,从实验结果看母体不表达hRas基因而胎盘表达明显,说明其表达组织应该来自退化的胎儿,转入基因的高表达可能是hRas-EIIa-cre小鼠胚胎致死的原因。
另外在胚胎发育过程中,不同日龄及不同器官中的小鼠胚胎中表达强度也不一样。Tg-hRas模型因转基因随机插入的原因,也是经过了首建鼠(founder)的筛选,选择了一个比较稳定且表达量适中的系而成功构建的[17-18]。hRas-EIIa-cre小鼠的构建是定点插入且采用CAG启动子,导致胚胎期不同器官的高表达,可能引起了胚胎期死亡。本实验中转入hRas基因得到全身表达影响了机体的所有细胞,进一步检测不同胚胎期不同器官的表达水平,可能是探讨胚胎致死原因的一个切入点[13]。
