人工血管在血液透析通路中的临床应用
2019-01-03王国胜罗庚晏妮戈小川叶沛强袁振东
王国胜,罗庚,晏妮,戈小川,叶沛强,袁振东
(东莞市中山大学附属东华医院 手足血管外科,广东 东莞 523110)
动静脉内瘘是慢性肾脏病患者维持血液透析最重要的一种方式,对其生存质量有重要影响,但部分患者因前臂动静脉细小,血管条件差,不能完成自体动静脉内瘘术[1],或多次自体内瘘手术后再闭塞,因此人工血管移植建立血液透析通路是合理的解决方案。2012年1月-2017年6月,我院为76例慢性肾脏病Ⅴ期患者进行了人工血管移植动静脉内瘘术,成功地建立血液透析通路,术后科学维护,及时合理地处理术后并发症,获得良好效果,现报道如下。
1 资料与方法
1.1 一般资料
本组76例,男31例,女45例;年龄29~86岁,平均47.8岁。原发病为慢性肾小球肾炎36例,糖尿病肾病19例,结石引起的肾功能衰竭6例,多囊肾5例,狼疮性肾炎8例,其他手术后肾功能衰竭2例。因自身血管条件差未能完成自体血管内瘘而进行人工血管移植35例,曾行自体内瘘术后再闭塞41例。
1.2 术前评估及材料选择
术前评估:生命体征相对平稳,重要器官功能在代尝期,能耐受手术。术前常规行上肢血管彩超检查,测量动静脉内径、血流量,以压脉带加压后评估静脉的走行、管径、弹性,根据上述检查情况决定在前臂或上臂行人工血管移植。
人工血管材料:本组74例选用戈尔公司的锥形聚四氟乙烯ePTFE人工血管,2例选用ACUSEAL硅胶人工血管。聚四氟乙烯人工血管动静脉端口径为4.0~6.0 mm,锥形的结构可以控制动脉端的吻合口大小从而控制吻合口的流量,防止心力衰竭和窃血综合征的发生。ePTFE人工血管管壁无法自己修复针眼,只能靠周围组织压迫止血。术后3~4周皮下组织和人工血管紧密长在一起时,穿刺后才可以在皮肤外面压迫止血。过早的穿刺容易导致皮下血肿和假性动脉瘤形成[1]。ACUSEAL人工血管两端内径均为6.0 mm,有三层结构,外层是膨体聚四氟乙烯,内层是带肝素涂层的聚四氟乙烯,中间是弹性硅胶层。穿刺拔针后硅胶弹性回缩可以起到止血作用,因此可以在术后24 h内进行穿刺。
1.3 手术方法
手术一般在局麻下进行,采用以下两种术式。⑴前臂人工血管移植动静脉内瘘术:取肘下横行切口,约4.0 cm,游离头静脉或肘正中静脉、肱动脉,结扎分支血管,前臂远端横行切口,约1.5 cm,隧道器通过皮下组织后置入人工血管,呈“U”形袢,用戈尔公司的CV-7缝线将人工血管与动脉及静脉端分别行端侧连续外翻吻合[2]。⑵上臂人工血管移植动静脉内瘘术:取肘上横行切口,约3.0 cm,游离肱动脉,取腋部纵行切口,约3.0 cm,游离腋静脉,隧道器通过皮下组织后置入人工血管,呈“C”形袢,用CV-7缝线将人工血管与动脉及静脉端分别行端侧连续外翻吻合。一般先吻合静脉端,再吻合动脉端[3]。
1.4 相关并发症及处理方法
该手术主要并发症包括:吻合口狭窄、血栓形成、感染、假性动脉瘤形成、窃血综合征及心衰、肿胀手综合征等[4]。
血栓形成后闭塞19例。血栓形成是人工血管内瘘术失败的最常见原因,大多数继发于吻合口狭窄,其他可能的原因还有:术中反复钳夹人造血管、术后包扎过紧、透析时反复在同一部位穿刺、压迫时间过长、发生低血压、低血糖等。8例于术后1年内血栓形成,其中5例于闭塞后3 d内行PTA球囊扩张后再通,2例行切开行Fogarty导管取栓,术后再通,1例多次血栓形成,PTA球囊扩张后再闭塞,后再行另一上肢人工血管移植[5]。
感染3例。2例术后1个月内出现人工血管移植区红肿疼痛,局部脱屑,伴发热,经细菌培养、抗菌治疗和局部换药引流,感染无法控制而取出人工血管,静脉端予结扎,取局部静脉血管组织修补动脉端吻合口。1例术后3个月于穿刺部位出现破溃,有脓性分泌物,予清创手术治疗,术后继续根据药敏试验应用抗生素治疗,感染控制。
假性动脉瘤2例。术后反复穿刺行血液透析造成假性动脉瘤,局部搏动包块,红肿、皮温高。均予手术切除瘤体并保留原内瘘血流通路,保留两端正常人工血管,中间移植人工血管,重建血透通路。
人工血管内瘘术后肢体肿胀均较自体内瘘术明显,经抬高患肢、应用消肿药物后肿胀逐渐消退。其中1例肢体明显肿胀,手部浅感觉减退,后造影发现为中心静脉端的狭窄引起。经介入治疗、球囊扩张后症状缓解。
心衰3例。其中2例经药物治疗后好转;1例反复心衰,行动脉吻合口缩窄,术后加强透析,症状缓解。
窃血综合征1例。术后早期有肢端麻木疼痛感,表现为肢端皮温降低,末梢浅感觉减退,经解痉、扩血管对症治疗后症状缓解,未发生缺血性坏死。
2 结果
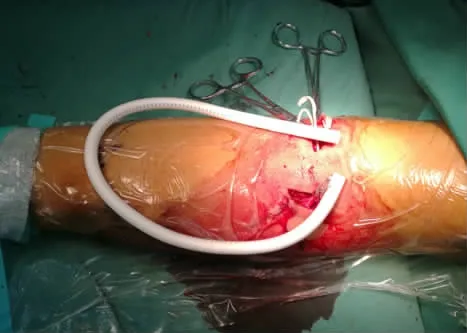
图2 人工血管呈"U"形袢
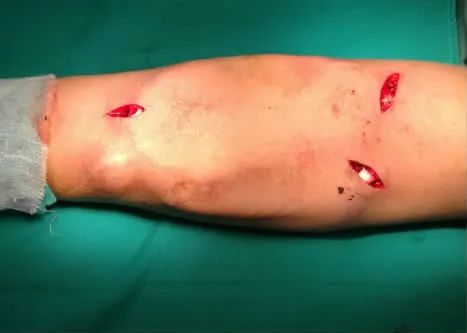
图3 置入人工血管
本组76例均成功行人工血管移植,建立血液透析通路。术后均可扪及震颤或闻及血流杂音,所有病例术后均有不同程度的前臂肿胀,后逐渐消肿。ePTFE人工血管术后1个月进行穿刺,ACUSEAL硅胶人工血管术后24~48 h进行穿刺透析。本组首次穿刺透析血流量均大于200mL/min,血液透析次数每周2~3次,透析完毕后,局部加压包扎4 h[5]。全组病例术后透析均在半年以上,最短6个月,最长5年。平均随访22个月 (6~36个月)。6个月通畅率为94.74%,12个月通畅率为89.47%,24个月通畅率为80.26%。
3 讨论
当肾衰患者血管条件差,无法完成自体动静脉内瘘术时,或多次自体内瘘术后再闭塞时,需寻求新的方法建立血液透析通路。人工血管移植动静脉内瘘术很好地解决了这一难题。人工血管有维护方便、容易穿刺、远期通畅率高、透析流量充足等优点,只要我们不断提升手术熟练程度,术后科学维护,及时合理地处理术后并发症,人工血管移植建立透析通路将成为提高慢性肾脏病患者生存质量的重要方法[6]。
据文献报道,人工血管移植造瘘,内瘘血栓形成是造成内瘘术失败的最常见原因。其原因有以下几种:⑴吻合口狭窄,较常见,血栓形成多数先出现在人工血管静脉端吻合口,多与手术有关,如吻合口过小、血管扭曲、成角,术后出血压迫、内膜增生等。⑵局部穿剌后人工血管内膜组织增生狭窄。⑶其他可能的原因,包括低血压、低血糖,透析后穿刺点压迫不当等[7]。血栓形成应早期发现,及时处理,早期病例可以置管溶栓,失败后可以Fogarty导管取栓,或行狭窄段球囊扩张术,外院有报道行狭窄部位支架置入术。指导患者避免压迫内瘘血管,每天自我检查内瘘是否畅通。血液透析时脱水不要太多,以免发生低血容量、低血压,导致内瘘血流缓慢,血栓形成[8]。
术后感染是人工血管移植建立血液透析通路后的严重并发症,常见原因有:一般情况差、贫血、糖尿病等,透析穿刺时无菌操作不严格。表现为皮肤色素沉着、脱屑、红肿、疼痛、局部有分泌物,还可伴有发热。分泌物送细菌与真菌培养,使用敏感抗生素治疗,勿局部挤压,加强换药,通畅引流,如感染无法控制,则需取出人工血管。控制血糖,围手术期预防性使用抗生素,术中及透析时严格无菌操作,以减少感染率。
假性动脉瘤,透析过程中反复穿剌同一部位,易引起假性动脉瘤。ACUSEAL人工血管由于自身的结构,发生假性动脉瘤几率较ePTFE人工血管低。假性动脉瘤形成后,局部皮肤菲薄,有破裂大出血风险,通常需手术进行修复,以补片修补或局段人工血管置换为主[10],严格无菌操作,防止感染,大部分患者能保留原内瘘进行血液透析。
其他常见的并发症还有:⑴窃血综合征及心衰,与内瘘术后血液分流有关,肢体远端血流量过少及回心血流量过多。因此术前可行上肢血管彩超检查及心脏彩超检查,认真评估前臂远端的血液供应及心脏功能,选用合适的锥型人工血管,术中必要时可缩小血管吻合口。此类症状,经对症处理,药物保守治疗,一般可缓解,如无效可选择手术缩小吻合口或封闭内瘘。⑵肿胀手综合征。一般原因为插管后中心静脉狭窄或闭塞,术前可行彩超或造影检查评估中心静脉情况,尽量避免在长期插管后的一侧肢体行人工血管移植动静脉内瘘术。如术后发现肿胀手综合征,保守治疗无效可行介入治疗、经皮血管成形术、球囊扩张或支架置入。
以人工血管移植建立透析通路,有容易穿刺、透析流量充足、维护方便、远期通畅率高等优点,只要我们不断提升手术熟练程度,术后科学维护,及时合理地处理术后并发症,人工血管移植建立透析通路将成为提高慢性肾脏病患者生存质量的重要方法。
