距肛缘≤8 cm的T1期直肠癌患者经肛门局部切除术的预后及影响因素分析
2019-01-02肖洪伟王艳良苏学良
肖洪伟 陈 升 王艳良 苏学良
全直肠系膜切除术(Total mesorectal excision,TME)目前已成为直肠癌切除术的经典原则,遵循这一原则经腹直肠癌根治术在降低术后局部复发和延长患者生存期方面取得显著效果[1]。但其术后并发症日益引起临床重视,尤其是低位直肠癌,术中可能损伤盆腔自主神经和盆底肌群,影响术后胃肠功能和性功能的恢复[2]。近年来有学者提出,对于仅侵及黏膜下层的T1N0期低位直肠癌可采用局部切除术[3],但目前有关两种术式的效果尚有争议[4],本研究回顾性分析两种术式的效果,并分析局部切除术预后的影响因素,为临床提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2010年3月—2014年3月儋州市人民医院180例直肠癌患者临床病历资料,纳入标准:(1)根据美国癌症联合委员会第7版TNM肿瘤分期标准[5],经术前MRI和手术病理证实为T1N0期直肠癌;(2)肿瘤下缘距肛缘距离≤8 cm;(3)病历资料完整。排除标准:(1)术前接受新辅助放化疗治疗者;(2)合并有严重溃疡性结肠炎、其他原发性恶性肿瘤者。根据手术方式不同分为观察组(经肛门直肠癌局部切除术,90例)和对照组(经腹直肠癌根治术,90例)。两组患者性别、年龄、体重指数(Body mass index,BMI)、肿瘤直径、分化程度、肿瘤距肛缘距离差异均无统计学意义(P>0.05)(表1)。
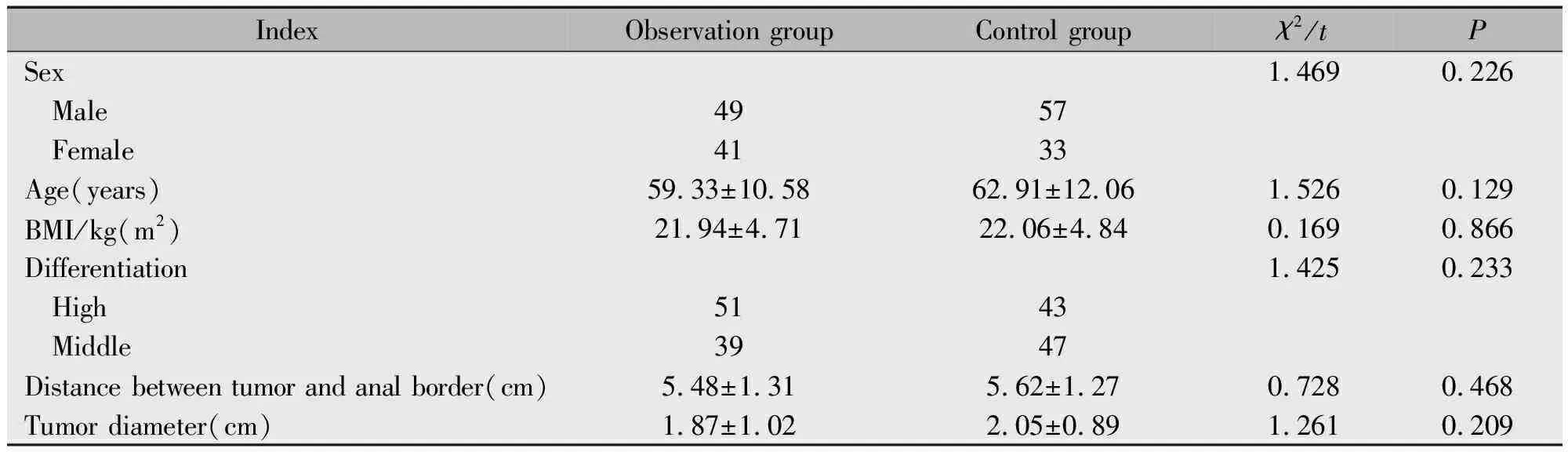
表1 两组基本资料比较
1.2 研究方法
收集并比较两组患者围手术期指标,包括手术时间、术中出血量、术后肛门首次排气时间、术后并发症及术后住院时间。记录术后3年总生存率和无进展生存率,以术后局部复发和远处转移为肿瘤进展。根据预后不同将观察组患者分为存活组(68例)和死亡组(22例),采用多因素分析法分析性别、年龄、BMI、分化程度、肿瘤直径、肿瘤至肛缘距离、切缘性质、术后CEA和CA125、术后并发症及术后辅助治疗等因素对局部切除术直肠癌患者预后的影响,探讨直肠癌经肛局部切除术患者预后的独立影响因素。以固有基层至肿瘤外缘距离<1 mm为环周切缘阳性,对于环周切缘阳性者术后给予三维适形放疗和FOLFOX4化疗各4个周期干预。直肠癌经肛局部切除术方法:患者取截石位(肿瘤位于后壁)或折刀位(肿瘤位于前壁),行骶管麻醉,扩肛满意后,松弛平滑肌,牵拉肛管,暴露肿瘤,在肿瘤外1 cm四周各缝合4针,以此作为标记在肿瘤外1 cm处完整切除肿瘤及全层肠壁,然后进行全层缝合。
1.3 统计学方法
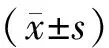
2 结果
2.1 两组围术期指标比较
观察组手术时间、术中出血量、术后肛门首次排气时间、术后住院时间及术后并发症发生率均显著低于对照组,差异有统计学意义(P<0.05)。观察组共6例并发症,其中3例肺部感染,2例尿路感染,1例吻合口渗血。对照组15例并发症,其中5例肺部感染,2例切口感染,3例尿路感染,2例吻合口出血,2例排便困难,1例性功能障碍(表2)。
2.2 两组预后比较
观察组术后3年死亡22例,总生存68例,无进展生存66例,对照组术后3年死亡17例,总生存73例,无进展生存69例。两组总生存期和无进展生存期差异均无统计学意义(Log-rank检验:χ2=0.896,0.358;P=0.344,0.550)(图1)。
2.3 观察组不同预后患者临床资料比较
观察组中死亡与存活患者年龄、肿瘤分化程度、切缘阳性率、术后并发症及术后辅助治疗差异均有统计学意义(P<0.05)(表3)。

表2 两组围术期指标比较

图1 两组生存曲线比较Figure 1 The comparison of prognostic survival function between obsenation and control groupsNote:A.The survival time of two groups in 3 years after operation;B.The no progression survival time after 3 years of the two groups.

IndexSurvival group(n=68)Death group(n=22)χ2/tPSex0.2540.615Male36(73.47)13(26.53)Female32(78.05)9(21.95)Age(years)9.1200.003≥6519(57.58)14(42.42)<6549(85.96)8(14.04)BMI(kg/m2)4.1840.123<18.531(86.11)5(13.89)18.5~24.019(73.08)7(26.92)>24.018(64.29)10(35.71)Differentiation7.2850.026High differentiation44(86.27)7(13.73)Middle differentiation24(61.54)15(38.46)Tumor diameter(cm)1.91±0.782.01±0.850.5110.610Distance between tumor and anal border(cm)2.1660.141<531(68.89)14(31.11)≥537(82.22)8(17.78)Margin positive19.816<0.001Yes4(28.57)10(71.43)No64(84.21)12(15.79)The CA125 after operation(U/mL)120.14±32.56135.91±40.071.8640.066The CEA after operation(ng/mL)254.05±74.13280.34±82.351.4070.163Postoperative complications6.2050.013Yes2(33.33)4(66.67)No66(78.57)18(21.43)Postoperative adjuvant therapy6.3050.012Yes48(84.21)9(15.79)No20(60.61)13(39.39)
2.4 观察组患者预后多因素分析
将单因素分析有统计学意义的指标赋值后纳入Cox回归分析模型,结果显示年龄、分化程度及切缘性质是影响肿瘤距肛缘≤8 cm的T1期直肠癌局部切除术患者预后的独立危险因素(P<0.05)(表4)。

表4 观察组患者预后多因素分析结果
3 讨论
经肛门直肠癌局部切除术较经腹直肠癌根治术显著减小了手术创伤,有助于降低术中出血量,缩短手术时间,王锡山等[6-7]还认为局部切除能减少体液丢失,减小手术创伤对机体免疫功能的影响,同时减轻术后疼痛,缩短术后卧床时间,降低术后坠积性肺炎的发生,这对直肠癌患者术后早期恢复具有重要意义。另外,根治术中遵循TME原则,在游离系膜和肿瘤切除过程中可能损伤盆腔自主神经和盆底肌肉,造成术后性功能障碍[8]。而局部切除可有效保留盆底肌肉和盆腔自主神经,从而避免术后排便和性功能障碍的发生。本研究结果也证实上述观点。
但目前临床对局部切除术后复发及远期预后仍未有定论,本研究显示观察组术后3年无进展生存率和总生存率均低于对照组,但差异无统计学意义,提示局部切除可获得与根治术相似的肿瘤生存效益。笔者认为术中应将直肠壁全层切透,这对提高肿瘤控制率,降低术后复发具有重要意义。目前临床多主张术后配合辅助放化疗以巩固手术效果[9-10],但本研究显示术后辅助治疗对改善患者预后并不具有独立影响,这可能与随访时间短有关。另外,掌握直肠癌局切术适应症对保证较低的术后复发率至关重要,既往有文献报道局部切除术后复发的主要原因是术前肿瘤细胞已浸润至引流的淋巴系统[11],若肿瘤已侵及固有肌层,局部切除术难以达到肿瘤病灶根治效果,因而术前对肿瘤的准确分期和浸润深度的判断是保障手术成功的关键。美国NCCN指南认为局部切除术适用于T1期,肿瘤距肛缘距离在8 cm以内的中低位直肠癌[12],本研究根据指南对肿瘤部位进一步分组,结果显示肿瘤距肛缘距离并不影响患者预后,这对低位直肠癌保肛手术具有一定指导意义。
本研究显示患者年龄、肿瘤分化程度及切缘性质是局部切除术患者预后的独立影响因素,高龄患者基础疾病较多,机体免疫力和心理承受能力较差[13-14],更易发生肿瘤侵袭和增殖,影响预后。肿瘤分化直接影响肿瘤生物学行为[15],分化程度越差,侵袭能力越强,而切缘阳性患者术后有潜在的肿瘤微转移风险,有学者还认为切缘性质是仅次于TNM分期的对直肠癌预后有显著影响的独立危险因素[16-18]。因而对于高龄、分化程度差的患者应慎重考虑局部切除术,同时注意保证手术切缘性质。
综上所述,经肛门局部切除术治疗距肛缘距离≤8 cm的T1N0期直肠癌患者可获得与直肠癌根治术相似的预后,且有助于减少术后并发症,患者年龄、肿瘤分化程度及切缘性质是影响局部切除术患者预后的独立因素,可作为直肠癌局部切除术患者手术适应症的选择依据。
