Nultin-3联合顺铂对口腔鳞状细胞癌细胞的抑制作用及机制研究
2019-01-02倪小兵彭兴春
施 俊 倪小兵 毛 敏 彭兴春
口腔鳞状细胞癌(OSCC)是头颈部肿瘤最常见的类型,约占95%,其发生发展是多基因共同作用的结果,包括原癌基因的激活或抑癌基因的失活[1-2]。大量研究表明,原癌基因鼠双微体基因2(MDM2)在正常口腔黏膜组织中的表达水平明显低于口腔鳞癌组织[3]。MDM2基因定位于人染色体12q13-14区,其编码蛋白能够通过负性调控下游p53蛋白,从而增加肿瘤的发生风险、促进肿瘤的形成和进展[4]。本研究探讨了MDM2抑制剂Nultin-3联合顺铂处理对口腔鳞状细胞癌Tca8113细胞的抑制作用及相关机制,旨在为临床开发口腔鳞状细胞癌的联合化疗方案提供新的理论依据。
1 材料与方法
1.1 材料
人口腔鳞状细胞癌Tca8113细胞株购于上海中科院细胞库,顺铂(冻干型)(山东齐鲁制药有限公司,中国);DMEM培养液(Gibco,美国);胎牛血清(FBS)(Hyclone,美国);胰蛋白酶(Sigma,美国);DMSO(Sigma,美国);MTT(北京碧云天公司,中国);Nultin-3(Selleck chemicals公司,美国);兔抗人(MDM2、p53、Caspase-3、Caspase-9、GAPDH)抗体(Cell signaling公司,美国);辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(北京中杉金桥公司,中国);ECL化学发光试剂盒(Milliore,美国)和PVDF膜(Milliore,美国)。
1.2 方法
1.2.1 细胞培养 Tca8113细胞用含10% FBS的DMEM培养液(100 U/mL青霉素和100 U/mL链霉素),置37℃,5%CO2饱和湿度的恒温培养箱内常规培养,待细胞长满培养皿底壁的80%~90%时,0.25%胰蛋白酶消化,进行传代培养。取对数期的细胞进行加药实验。
1.2.2 实验分组 实验分为四组:对照组、顺铂组、MDM2抑制剂组(Nultin-3组)及Nultin-3联合顺铂组(联合组)。对照组加不含药物的等量DMEM培养液培养细胞48 h;顺铂组用含终浓度4 μg/mL顺铂的培养液培养48 h;Nultin-3组用含终浓度为10 μM Nultin-3的培养液培养细胞48 h;联合组为10 μM的Nultin-3与4 μg/mL的顺铂联用培养细胞48 h。
1.2.3 MTT法检测细胞增殖抑制率 取对数生长期的Tca8113细胞,常规消化离心,计数后按照4×103个/孔细胞接种于96孔板培养板中,每孔100 μL培养液,置37℃恒温培养箱中培养24 h,待细胞贴壁后加药处理,每组至少设置9个平行孔,各组细胞药物作用48 h后,加入5 mg/mL MTT,20 μL/孔,室温孵育4 h后弃上清,滴加二甲基亚砜(DMSO)150 μL/孔,轻微震荡溶解结晶后用酶标仪于490 nm波长处检测各孔吸光度(OD)值。重复实验3次,计算各组肿瘤细胞生长的增殖率(%)。
肿瘤细胞增殖率(%)=(用药组细胞OD值/对照组细胞OD值)×100%
1.2.4 Western blot分析 分别消化并收集各组细胞后用PBS液洗涤3次,加入预冷的蛋白裂解液,冰上裂解30 min,然后将细胞转移至1.5 mL EP管中,4℃,12 000 rpm离心5 min,取上清即为提取的总蛋白。BCA法检测蛋白浓度后加2×SDS上样缓冲液,95℃高温煮5 min使蛋白变性。各泳道加入100 μg蛋白,10% SDS-PAGE电泳后将电泳产物转移至硝酸纤维素膜上。用封闭液(5%脱脂奶粉)室温封闭2 h,加入兔抗人MDM2(1∶1 000)、p53(1∶1 000)、Caspase-3(1∶1 000)、Caspase-9(1∶1 000)及GAPDH抗体(1∶1 000),4℃孵育过夜。预冷TBST洗膜5 min×3次,HRP标记的二抗置室温下混摇孵育2 h(1∶2 000),TBST洗膜5 min×3次,ECL化学显色。
1.3 统计方法
2 结果
2.1 Nultin-3和顺铂单独或联合作用后Tca8113细胞增殖率
析因设计方差分析显示,Nultin-3和顺铂两种药物之间交互作用有统计学意义(F=6.482,P=0.035)。LSD-t检验提示,与对照组相比,Nultin-3组、顺铂组和联合组的细胞增殖率明显降低(P<0.05),与Nultin-3组、顺铂组比较,联合组细胞增殖率明显降低(P<0.05)(图1)。
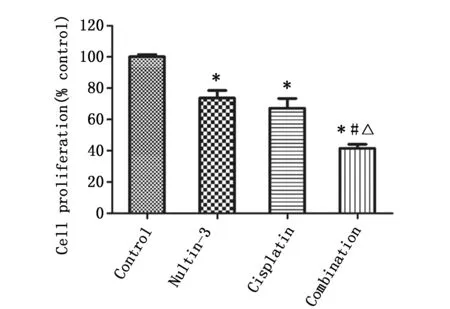
图1 Nultin-3和顺铂单独或联合用药后Tca8113细胞增殖率Figure 1 The proliferative rates of Tca8113 cells treated with Nultin-3,cisplatin,Nultin-3 combinatined with cisplatin or control groupsNote:Compared with the control group,* P<0.05;Compared with the Nultin-3 group,# P<0.05;Compared with the Cisplatin group,△P<0.05.
2.2 Western blot法检测各组凋亡相关蛋白的表达水平
Nultin-3和顺铂两种药物对凋亡相关蛋白Caspase-9和Caspase-3表达水平影响的交互作用有统计学意义(F=6.458,P=0.034;F=5.826,P=0.041),LSD-t检验显示与对照组比较,Nultin-3组、顺铂组和联合组的凋亡相关蛋白Caspase-9和Caspase-3的表达水平均明显升高(P<0.05),其中联合组表达水平最高,联合组Caspase-9和Caspase-3的表达水平高于Nultin-3组和顺铂组(P<0.05)(图2)。
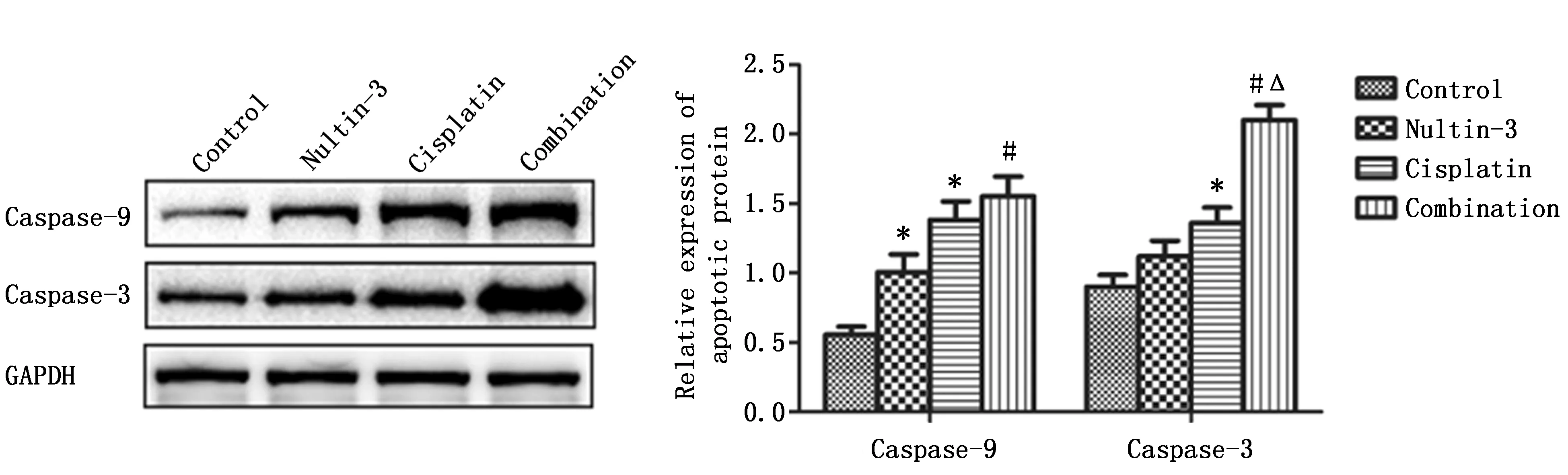
图2 Western blot法检测各组凋亡相关蛋白Caspase-9及Caspase-3相对表达量Figure 2 The relative expression of Caspase-9 and Caspase-3 in Tca8113 cells treated with Nultin-3,cisplatin,Nultin-3 combinatined with cisplatin or control groupsNote:Compared with the control group,*P<0.05;Compared with the Nultin-3 group,# P<0.05;Compared with the Cisplatin group,ΔP<0.05.
2.3 Nultin-3和顺铂单独或联合用药后对MDM2-p53通路的影响
Nultin-3和顺铂两种药物对MDM2蛋白、p53蛋白表达量影响的交互作用有统计学意义(F=6.077,P=0.039;F=7.823,P=0.021),与对照组相比,Nultin-3组、顺铂组的MDM2蛋白表达量均降低(P<0.05),联合组较单独用药组进一步降低,相反,Nultin-3组、顺铂组的p53蛋白表达量较对照组明显升高,联合组蛋白表达量较单独用药组进一步升高(图3)。

图3 各组细胞药物处理后MDM2-p53信号通路相关蛋白的表达水平Figure 3 The expression of MDM2-p53 signaling pathway related proteins in Tca8113 cells treated with Nultin-3,cisplatin,Nultin-3 combinatined with cisplatin or control groupsNote:Compared with the control group,*P<0.05;Compared with the Nultin-3 group,# P<0.05;Compared with the Cisplatin group,ΔP<0.05.
3 讨论
口腔鳞癌为头颈部常见肿瘤,预后相对较差,死亡率居高不下,5年生存率维持在60%左右[5]。目前治疗这类疾病临床上最常采用的治疗方法包括手术、放疗和化疗。其中,铂类药物(如顺铂)化疗已成为当前口腔鳞癌综合治疗的重要组成部分,化疗的成功与否直接关系着患者的生存质量[6]。口腔鳞癌在化疗初期对顺铂的应答性很高,但随着化疗的进行,出现了肿瘤细胞对化疗药物产生耐药的现象,继而影响了化疗效果[7-8]。因此,深入研究口腔鳞癌化疗抵抗的主要分子机制,进一步探寻更为有效的临床治疗手段是本课题的主旨。
MDM2是与双微体相关的DNA扩增基因,该基因可以调节细胞的生长发育,增强细胞的生存活力,从而使细胞发生转化、增殖和恶变的能力增强[9]。Agarwal等研究表明在口腔正常黏膜组织中MDM2蛋白的表达水平低于口腔鳞癌组织[10]。MDM2的过表达不仅能促进肿瘤的快速生长,还与肿瘤的侵袭、转移、化疗敏感性差和预后不良有关[11-12]。MDM2抑制剂Nultin-3是一种顺式咪唑啉类小分子,可以竞争性结合MDM2,阻断其对下游信号的调控作用。研究表明,Nultin-3能特异性的作用于肿瘤细胞,但不能诱导正常的非肿瘤细胞及肿瘤组织的凋亡[13];同时,Nultin-3与抗有丝分裂药、基因毒性药物以及放疗有协同作用[14]。本研究通过体外单独使用MDM2抑制剂Nultin-3,顺铂或联合使用两药处理口腔鳞癌Tca8113细胞后,实验结果显示,Nultin-3及顺铂单独使用均能抑制Tca8113细胞的生长,两药联合使用后较单药组抑制增殖效果更为明显,表明联合组对肿瘤细胞的抑制作用进一步增强。通过析因设计方差分析结果发现,Nultin-3与顺铂联合用药后具有协同增效作用。由此可见,MDM2抑制剂在口腔鳞癌治疗中抑制鳞癌细胞生长并逆转铂类化疗药物耐药性方面表现出潜在的应用前景。
当前药物抗肿瘤的主要机制是诱导肿瘤细胞的凋亡,其中线粒体凋亡是细胞凋亡的主要途径之一[15]。半胱氨酸蛋白酶(Caspase)家族是线粒体凋亡途径中最重要的蛋白酶,线粒体通过释放细胞色素C进入胞质,激活凋亡途径中的必须始动子pro-Caspase-9形成Caspase-9,进而激活Caspase-3,形成活性片段Cleaved caspase-3,后者是线粒体凋亡途径的核心效应器,一旦被激活细胞将进入不可逆的凋亡阶段,最终诱导细胞凋亡[16-17]。本实验通过Western blot法检测结果显示,Nultin-3和顺铂单独作用Tca8113细胞后,促凋亡蛋白Caspase-9和Caspase-3相对表达量均上调,两药联合作用后上调两种凋亡蛋白表达的作用更明显。从而推测Nultin-3和顺铂可能是通过线粒体途径调控Caspase家族蛋白诱导细胞凋亡从而发挥协同抗口腔鳞癌细胞作用。
MDM2具有调节抑癌基因p53的作用。MDM2蛋白通过抑制p53的转录活化功能和抗肿瘤活性,促进肿瘤的形成[18]。MDM2基因明显扩增和表达时,其表达产物可与p53蛋白结合,使p53功能受到抑制或完全失活[19]。研究表明,Nultin-3能拮抗MDM2解除MDM2对p53的抑制,从而增强p53介导的凋亡作用,改善顺铂抵抗的肿瘤的治疗效果。这说明MDM2具有p53依赖性的致瘤作用[20-21]。在p53突变型套细胞淋巴瘤中使用Nultin-3能够增强硼替佐米的线粒体凋亡作用[22]。因此,在肿瘤细胞中,特异性针对MDM2的泛素连接酶活性的小分子抑制剂能够激活p53信号通路、诱导p53依赖性的细胞凋亡。本研究通过Western blot检测各组MDM2及p53蛋白的相对表达量,结果显示,与对照组相比,Nultin-3组和顺铂组的MDM2蛋白表达量均显著降低,联合组较单独用药组进一步降低;相反,Nultin-3组和顺铂组的p53蛋白表达量较对照组明显升高,联合组蛋白表达量较单独用药组进一步升高。由此可见,药物处理口腔鳞癌细胞后,MDM2与p53蛋白的表达呈负相关。MDM2是泛素-蛋白酶的重要组成部分,属于E3泛素连接酶。MDM2一方面可以通过泛素化p53,然后由蛋白酶体降解p53;另一方面MDM2还能够直接结合并抑制p53的转录活性[23]。Nultin-3联合顺铂调控下游p53蛋白表达的更深入机制将是我们下一步研究的方向。
综上所述,本研究证实Nultin-3和顺铂联合应用对口腔鳞癌Tca8113细胞的生长抑制和凋亡效应均明显优于单药治疗组。因此,本研究认为Nultin-3可以作为一种铂类化疗药的辅助药物,能够和顺铂共同抑制口腔鳞癌细胞,降低化疗药物的毒副作用,从而增强其抗肿瘤效果。Nultin-3可以考虑作为一种辅助用药,与化疗药物顺铂协同作用,在产生同等治疗效果的前提下,以减少顺铂的用量,从而减轻顺铂的毒副作用;同时为临床开发新的口腔鳞癌治疗方案提供坚实的理论及实验基础。
