间充质干细胞在抗炎治疗中的应用进展
2018-12-28薛鑫淼陈学敏邓森林王小成
薛鑫淼,蒋 军,陈学敏,徐 瑾,邓森林,李 鑫,王小成
1空军军医大学 基础医学院,陕西西安 710032;2天水四零七医院 耳鼻喉科,甘肃天水 741000;3空军军医大学 航空航天医学系,教育部航空航天医学重点实验室,陕西西安 710032;4解放军94587部队,江苏连云港 222300
间充质干细胞(mesenchymal stem cells,MSCs)属于全能干细胞,主要来源于中胚层,在人体内主要分布于骨髓、脐带、脂肪等组织和器官间质中[1]。在不同诱导条件下,它能够分化为脂肪、骨、软骨、等多种组织细胞。MSCs具有较强的多向分化潜能及自我更新和增殖的能力[2]。此外,它还具有低免疫原性和免疫调节特性,在炎症环境中能抑制免疫系统,发挥抗炎作用[3]。近年来,随着对MSCs免疫调节作用机制的深入研究,其在治疗炎性疾病方面已显示出很好的潜力。
1 MSCs的免疫学特性
国际干细胞治疗学会(International Society of Cellular Therapy,ISCT)提出MSCs细胞至少具有以下3个特征:1)在特定条件下,细胞可以在体外分化为骨细胞、脂肪细胞以及软骨细胞等多种结缔组织;2)表达CD73、CD90、CD105等表面分子,但造血细胞的表面标记如CD34、CD45和CD14等却呈阴性表达;3)在正常细胞培养条件下能贴壁生长[4]。
MSCs除了具备自我更新和多向分化潜能外,还具有特殊的低免疫原性和免疫调节功能。MSCs表面主要组织相容性体-1类分子(major histocompatibility complexⅠ,MHC-Ⅰ)表达阳性,而MHC-Ⅱ类分子以及共刺激分子,如CD40、CD80、CD86和CD40L等表达阴性,这些特性使MSCs能免于NK细胞的识别和杀伤,并逃避同种异体T细胞的识别。
伏能士DeltaSpot电阻点焊工艺是针对铝焊而开发的新技术。它的创新在于配备了独特的电极带。电极带的发明带来了前所未有的优势:
2 MSCs对免疫细胞的调节及其机制
目前的研究表明MSCs的免疫调节作用主要是通过细胞间的接触和分泌细胞因子两种途径,通过固有免疫细胞和适应性免疫细胞发挥调节作用[5-6]。其主要机制如图1所示。
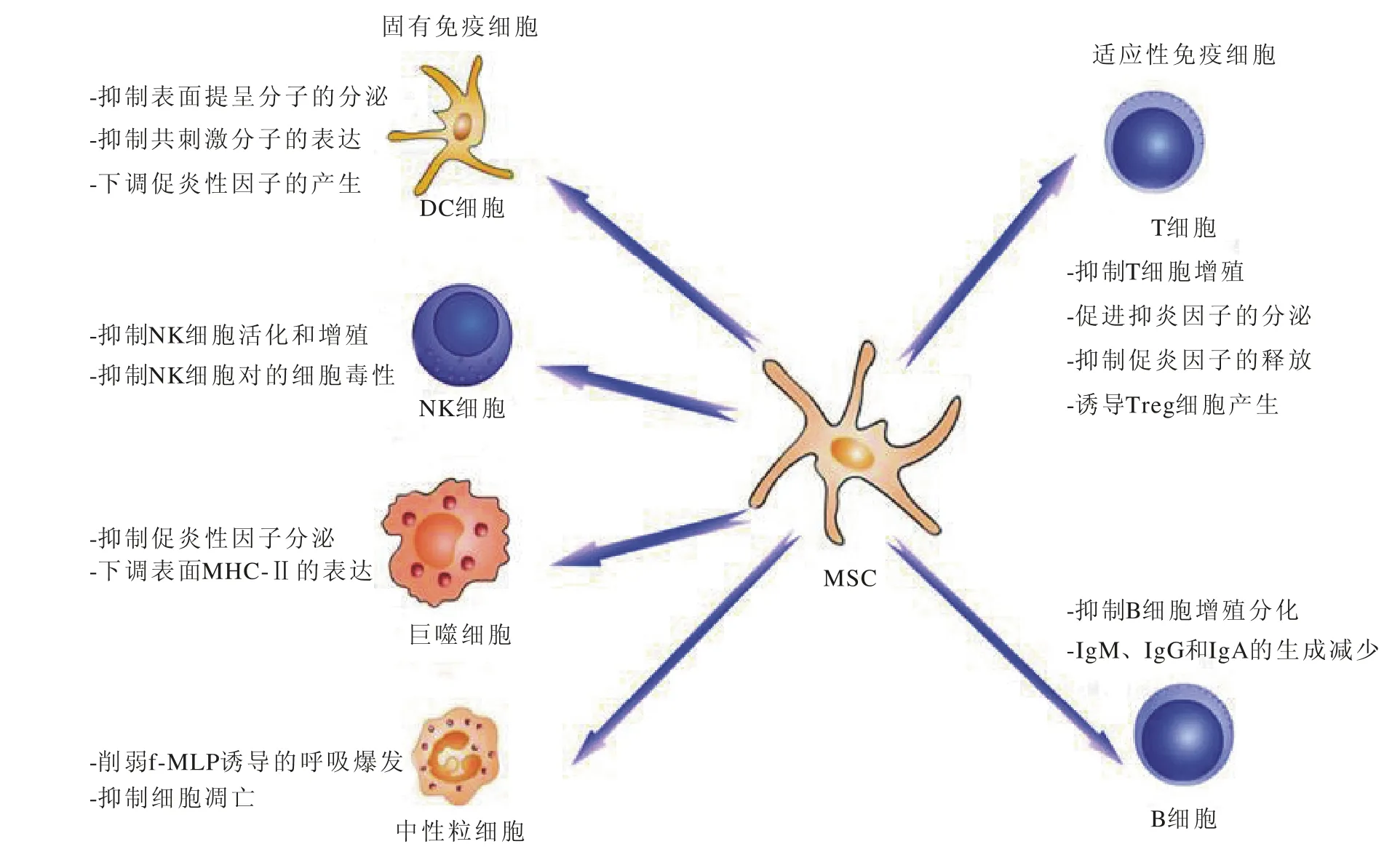
图1 间充质干细胞的免疫调节机制示意图
MSCs对B淋巴细胞的调节作用在于能抑制B淋巴细胞的增殖和分化,阻止B淋巴细胞分化为浆细胞,降低其表面趋化因子受体4(CXCR4)、CXCR5、和CXCR7及其相应配体CXCL12、CXCL13的表达,IgM、IgG和IgA的生成减少[20]。Krampera等[21]发现,IFN-γ对B淋巴细胞的抑制作用可能是通过诱导MSCs表达IDO,IDO能通过色氨酸途径抑制B淋巴细胞增殖。
DC是最重要的激活初始T细胞的抗原提呈细胞,MSCs与DC细胞接触后可通过影响其细胞形态、表型、刺激淋巴细胞增殖以及细胞因子分泌4个方面抑制DC的成熟。同时MSCs还可抑制多能造血干细胞向树突状细胞的分化[7]。成熟DC与MSCs共培养后,抑制了DC表面提呈分子HLADR和CD1a、IL-12的分泌,共刺激分子CD83、CD80/86表达也显著下调[8]。MSCs还能通过和DC细胞间的直接接触,上调IL-10的分泌,下调促炎性因子IFN-γ、IL-12和TNF-α的产生[9]。MSCs还可抑制NK细胞分泌细胞因子IFN-γ、IL-10等[10]。另外,MSCs通过其表面的HLA-Ⅰ类分子下调NKG2D和NKp30相应配体PVR和ULBP的数量,以此来抑制NK细胞活化的功能。MSCs主要诱导巨噬细胞向M2型分化,上调IL-10的表达,并下调IL-12和TNF-α的表达,从而减轻炎症反应[11-12]。MSCs也可分泌PGE2,下调巨噬细胞表面MHC-Ⅱ的表达,影响其抗原提呈功能[13]。MSCs还能够抑制巨噬细胞的趋化能力,抑制巨噬细胞分泌MCP-1,从而减少巨噬细胞浸润[14]。MSCs对中性粒细胞的保护作用,主要是削弱f-MLP(N-formyl-L-methionin-L-leucyl-L-phenylalanine)诱导的呼吸爆发反应来实现[15]。通过这种方式,使中性粒细胞的自发性凋亡延迟,过度氧化新陈代谢被抑制。MSCs对固有淋巴样细胞也具有免疫调节作用:一方面,MSCs分泌PGE2抑制NK T细胞的增殖[16];另一方面,也可直接抑制唑来膦酸和IL-2扩增的γδT细胞的增殖但并不抑制其细胞毒功能[17]。
3.2 系统性红斑狼疮(systemic lupus erythematosus,SLE)SLE是一种原因不明的多系统受累为特征的器官非特异性自身免疫病,其基本病理变化是结缔组织黏液样水肿、纤维蛋白样变性和坏死性血管炎。肾受累、继发感染、神经系统损伤、动脉硬化和心血管损伤是主要死因。Wang等[24]首次对1例难治性SLE患者进行MSCs和造血干细胞(HSCs)联合自体移植治疗,患者在接受治疗后抗DNA抗体呈阴性,外周血白细胞指数、血红蛋白含量等恢复正常,SLE疾病活动指数(SLEDAI)由治疗前的10 ~ 16降至7,并且发现了移植治疗后长期的T、B细胞群的重建,尤其是调节性T细胞比例显著升高,这对自身免疫性疾病的治疗有重要意义。近年来,Wang等[25]对30位SLE患者进行MSCs移植(MSCT),分别在MSCT前以及MSCT后1周、1个月、3个月、6个月和1年对外周血中的Treg和Th17的比例进行测定,发现Treg细胞比例上升,而Th17细胞比例下降。同时他们将病人外周血单核细胞与MSCs共培养,考虑到MSCs对上述两种细胞的调节方式可能是通过细胞因子调控的,因此通过加入细胞因子抗体的方式筛选证明TGF-β参与Treg细胞数量上调,而PGE2则参与下调Th17数量,两种作用相互协调,从而对SLE患者的症状有所缓解。近年,他们又对81例难治性SLE患者进行同种异体MSCs治疗,5年存活率高达84%(68/81),其中完全恢复的患者比例达到27%(22/81),足以证明同种异体的MSCs治疗有明确的安全性和疗效[26]。
MSCs对T淋巴细胞的调节作用表现在可抑制T淋巴细胞[包括辅助性T淋巴细胞1(Th1)、Th17和细胞毒性T淋巴细胞]的增殖和活化[18]。通过抑制细胞分裂使T淋巴细胞阻滞于G0/G1期。主要的抑制方式有两种:1)通过细胞间相互作用;2)通过可溶性细胞因子实现,MSCs分泌的可溶性细胞因子(TGF-β、HGF、IL-6、IL-10、PGE2、NO、IDO等)作用于T淋巴细胞间抑制其增殖能力与活性[19]。
2.1 MSCs对固有免疫细胞的调节作用 固有免疫是生物在长期进化过程中逐渐形成的免疫功能,是机体抵御病原体入侵的第一道防线。机体内参与固有免疫反应的细胞主要包括树突状细胞(dendritic cell,DC)、自然杀伤细胞(natural killer cells,NK),以及巨噬细胞、中性粒细胞、NK T细胞和γδT细胞等。MSCs可影响固有免疫细胞的增殖、凋亡、免疫功能和迁移能力进行免疫调节。
试验选取液固比601,浸取温度55 ℃,测定浸取时间对Ba2+、OH-浓度以及水溶性钡存在形式的影响,试验结果如图6、图7。
3.4 多发性硬化症(multiple sclerosis,MS) MS是一种慢性的以中枢神经系统炎性脱髓鞘为特点的自身免疫性疾病,主要涉及组织免疫和神经细胞凋亡。Anderson等[30]研究发现MSCs通过抑制树突状细胞和效应性T细胞的功能从而减缓MS实验模型EAE模型小鼠的症状,EAE小鼠模型与MS具有相同的免疫学和病理学特征。他们在体外低氧条件下获得大量有免疫抑制能力的低传代MSCs,对EAE小鼠注射治疗后发现同种异体MSCs能够减少中枢神经系统脱髓鞘和炎症浸润。Harris等[31]率先对6例传统治疗方法无效的MS患者进行鞘内注射自体MSCs诱导分化的神经祖细胞(MSCNP)治疗,将适量的MSC-NP与腰穿得到的脑脊液混匀后注射回鞘内,并且在2 ~ 5次治疗中逐渐增多MSC-NP用量,当MSC-NP用量达到2×106~ 10×106数量时患者未出现明显的不良反应。并且6例患者的病情都得到了缓解。因此初步确定了鞘内注射MSC-NP治疗MS的耐受性和安全性。
3 MSCs在抗炎治疗中的应用研究
3.3 狼疮性肾炎(lupus nephritis,LN) LN是SLE患者最常见的并发症之一。Bukulmez等[27]用BXSB大鼠模型进行试验,该模型与人类SLE有相似的免疫学异常和病理表现,他们对17周龄BXSB(n=4)通过颈内动脉注射106数量的MSCs,在9周后与未经MSCs治疗的同窝BXSB同时处死取材,发现MSCs组肾病变明显较轻;同时他们对20周龄BXSB(n=2)通过左肾被膜下注射106数量的MSCs,6周后处死取材,染色观察其肾病变缓解程度优于颈内动脉注射组,提示MSCs肾被膜下注射比颈内动脉注射对LN治疗效果更好。此外,PCR检测到MSCs组IL-17、CTLA-4表达均下降,推测MSCs治疗狼疮性肾炎可能会有较好的效果。曾雯[28]临床对22例经肾穿确诊为LN的患者分为对照组、MSCs联合治疗组和吗替麦考酚酯(MMF)组,发现MSCs联合治疗组蛋白尿浓度在治疗前为2.80±0.20 g/d,治疗后3个月降为0.93±0.08 g/d,治疗后1年降为0.41±0.11 g/d。证明MSCs联合MMF治疗狼疮性肾炎在短期内能够快速降低尿蛋白,可明显改善病情,降低复发率。Gu等[29]对81例难治性LN病人进行同种异体MSCs移植治疗,他们将捐赠者提供的MSCs体外培养至足量,然后按照106数量的MSCs/kg进行静脉注射,并在随后1年内定期对患者肾恢复情况进行评定,治疗后若患者血清肌酸酐浓度低于106μmol/L,并且蛋白尿浓度低于0.3 g/24 h,则认为该患者LN得到痊愈;若所有肾病变检测数据改善均不少于基础病变时数据的50%,并且没有任何一项指标发生恶化,则认为该患者病情得到部分改善和控制。结果显示,在治疗后1年内痊愈和病情得到改善的患者达到60.5%(49/81)。证明MSCs治疗对LN效果极为明显。
2.2 MSCs对适应性免疫细胞的调节作用 适应性免疫是指免疫系统中T、B淋巴细胞受到“非己”物质刺激而获得的免疫。与固有免疫不同在于它具有特异性、耐受性和记忆性的特点。
可通过免疫调节和免疫重建等机制缓解黏膜炎症。李欣[33]用葡聚糖硫酸钠诱导的IBD小鼠模型进行ICAM-1修饰的MSCs鼠尾静脉注射实验,将小鼠分为6组,包括对照组、PBS组、MSCs组、C3组、C3-MIGRI细胞组和C3-ICAM-1细胞组,发现PBS组小肠绒毛和固有层炎性细胞浸润,浸润深度可达肌层;而治疗组则以固有层、黏膜下层为主要病理改变,已过表达ICAM-1的MSCs组损伤最轻,病理评分也显著低于其他各组。证明过表达ICAM-1的MSCs治疗可有效减轻IBD小鼠模型的病理变化,提高生存率。尽管MSCs临床治疗IBD的应用还不是很广泛,但其应用前景是值得继续探索的。
3.1 类风湿关节炎(rheumatoid Arthritis,RA) RA是一类以慢性多关节滑膜炎,骨及软骨破坏为主的全身性自身免疫性疾病。传统药物治疗和近年兴起的生物治疗存在明显的不良反应,且对损伤的关节和受损的免疫耐受无显著修复能力,因而疗效欠佳。治疗RA的关键是抗炎和修复耐受机制缺陷,而MSCs具有抗炎和调节免疫系统的双重功能。边振宇[22]在RA大鼠模型实验分别进行关节内、经静脉全身性注射MSCs以及关节内注射联合静脉全身注射MSCs治疗,结果表明3种方式均可降低实验性RA模型的关节炎指数,联合治疗效果更佳。ELISA检测其通过下调促炎因子TNF-α,上调抑炎因子IL-10起到免疫抑制作用。临床研究方面,Shadmanfar等[23]对自体MSCs移植治疗RA的患者进行安全性和耐受性的三盲实验,将符合标准的30例患者随机分为两组,即MSCs治疗组和安慰剂组,MSCs组进行膝关节内注射MSCs治疗,安慰剂组注射等量的0.9%氯化钠注射液,分别在注射后1个月、3个月、6个月和1年对两组患者进行骨关节炎指数(WOMAC)评定,发现MSCs治疗组WOMAC均低于对照组,并且治疗组没有明显的不良反应,因此对于自体MSCs移植治疗RA的安全性和耐受性得到了肯定。但由于本实验的样本数量较小,因此需对MSCs治疗RA的临床应用进行进一步研究。
(2)完善的固定资产管理。通过资产卡片的建立,院领导能随时查询和掌握全院的固定资产情况,在建立设备资产卡片时,记录与关联和设备相关的配件、操作手册、技术文档等;同时通过对企业注册证、经营许可证、企业许可证等“三证”的管理,提醒各证的到期时间,从而有效地控制风险。除此之外,还针对需要“强检”的设备进行计量管理功能,可有效配合计量管理部门的工作,并能快速地完成台账处理。
在临床上,与多发性硬化症同属中枢神经系统脱髓鞘疾病的还有视神经脊髓炎(neuromyelilits optica,NMO),又称Devic病,是视神经和脊髓同时或相继受累的急性或亚急性脱髓鞘病变。Dulamea等[32]对多次复发的患者进行MSCs治疗,他们将自体骨髓来源的MSCs用生物敷料固定在患者下肢压疮上,8 d后,患者压疮面积减小,行动能力有了一定的恢复,并在1年后可以自行行走,初步证明MSCs对治疗NMO有一定效果。但具体的作用机制及临床应用还有待进一步研究。
3.5 炎症性肠病(inflammatory bowel disease,IBD) IBD是一种自身免疫性疾病,其发病机制主要与非致病性肠抗原作用于遗传易感者引起的免疫应答失调有关,分为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)。现有的IBD治疗主要是药物治疗,主要包括氨基水杨酸制剂,糖皮质激素和免疫抑制剂3类,目前没有彻底的治疗手段[29]。MSCs治疗是一种新兴的IBD的治疗手段,
毛子:在公共场所吸烟是本人最不能容忍的现象之一。记得有一次坐公共汽车回家,车上的一个小伙子旁若无人般陶醉在云雾中,虽然有人已经做出了掩鼻的动作以示抗议,但丝毫不影响他的吞云吐雾。无言以对,我只好代言所有被迫吸二手烟的乘客向售票员求救,在售票员的监督下,这位男子才结束了他的“缺德”行为。
3.6 急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS) ARDS主要特征是伴有严重的低氧血症和肺水肿,死亡率高达50%。MSCs可通过抗氧化和抗细胞凋亡作用减轻肺泡炎性损伤,还可辅助修复或归巢至损伤部位定向分化并替代凋亡、坏死的细胞[34]。陈进玲等[35]将30只大鼠随机分为正常组、模型组和实验组,模型组与实验组气管内滴注LPS建立ARDS模型,造模1 h后实验组滴注人脐带来源的MSCs 1 ml,其余两组滴注0.9%氯化钠注射液,发现与模型组相比实验组大鼠体内炎性因子(IL-1、IL-8)水平明显降低,肺损伤症状减轻。Cai等[36]利用LPS诱导的ARDS模型,研究受体ROR2(尚未发现其配体)在MSCs过表达对于MSCs治疗ARDS的影响,他们将小鼠分为4组,包括正常组、模型组、LPS+MSCs组和LPS+ROR2-MSCs组,行HE染色观察肺组织损伤情况,发现过表达ROR2的MSCs能够更有效地修复ARDS引起的肺泡上皮细胞的损伤,与正常的MSCs组相比能更好地抑制肺的纤维化,证明在动物模型上MSCs治疗ARDS的有效性。
3.7 炎症性心肌病(inflammatory cardiomyopathy,ICM)ICM是由各种病原微生物感染及其他理化因素使炎症细胞浸润心脏,导致心肌细胞变性坏死所产生的疾病。ICM病因也存在免疫功能紊乱的因素,因此传统的药物治疗并不能有效控制病情。Van Linthout等[37]将MSCs与柯萨奇病毒B3诱导的炎症性心肌细胞进行共培养,发现MSCs可以减轻柯萨奇病毒B3诱导的心肌细胞的凋亡。此后对柯萨奇病毒B3诱导的ICM小鼠进行试验,实验组注射106数量的MSCs,对照组注射PBS缓冲液,7 d后对小鼠左心室收缩力参数dP/dTmax和dP/dTmin进行测定,实验组收缩力参数高于对照组,证明MSCs对柯萨奇病毒B3诱导的ICM小鼠模型有治疗效果。Quevedo等[38]应用活体猪来制造心梗模型,实验组(n=6)心内膜注射同种异体MSCs,对照组(n=4)注射安慰剂,MRI发现实验组MSCs在梗死区和交界区移植分化为心肌细胞,单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)含量增加,这提示MSCs也可能是通过“归巢”机制保护受损心肌。
何良诸相信了,在北大坎矿区,掀起过寻宝狂潮。盗墓者的手,才会那么粗野贪婪;常年在荒郊野外死人堆里干活,声音才会这么沙哑沧桑。另一位呢?
3.8 过敏性鼻炎(allergic rhinitis,AR) AR属于上呼吸道炎症疾病的一种,主要机制是由空气中的过敏原引起机体的超敏反应,全世界30%的人罹患此病,其对患者的生活质量影响很大,因此将MSCs应用于治疗AR也受到大家的关注。Li等[39]利用卵清蛋白(OVA)诱导AR小鼠模型来研究MSCs的治疗是否对AR有效。首先将60只小鼠随机分为5组(n=12),包括正常组、模型组和3个实验组。实验组在不同时间将5×106MSCs与0.5 ml 0.9%氯化钠注射液混匀注射到AR小鼠腹腔内,A组在诱导模型前1周注射MSCs,B组在模型制作1 d后注射MSCs,而C组在模型制作之后连续4周每周注射1次MSCs。至注射后1个月,对5组小鼠用OVA吸入刺激半小时后,记录10 min内小鼠打喷嚏和挠鼻子的次数,从而评估AR小鼠的症状轻重程度,发现实验组小鼠打喷嚏和挠鼻子的次数较其余两组都明显减少,其中C组症状缓解最明显。然后将小鼠处死取材,HE染色观察到MSCs治疗组小鼠鼻粘膜的损伤程度明显低于模型组,并且利用ELISA技术还观察到MSCs能够减少AR小鼠血清中的IL-4、TNF-α和Ig-E含量,上述结果证明MSCs治疗AR也有一定的作用。
图1中,Ui和Ii分别为第i个变流器输出的直流电压和电流;Ri和Iri分别为第i条线路的线路电阻和流过线路电阻的电流;IRi和IR分别为流过局部负载和公共负载的电流;Udc为公共母线电压。
3.9 其他炎性疾病 除了上述的炎症性疾病以外,还有很多疾病都在进行MSCs移植治疗的研究。张泽宇等[40]首先分离出5只大鼠的MSCs并对其进行体外培养,然后将60只SD大鼠随机分为3组,分别是假手术组(n=20)、模型对照组和MSCs治疗组,采用40 min短暂结扎冠状动脉前降支建立心肌缺血再灌注模型,48 h后进行TTC-偶氮蓝染色观察梗死面积,还采用流式细胞学分析免疫细胞比例,发现MSCs治疗组与模型对照组相比不仅心梗区面积明显较小,而且白细胞和中性粒细胞比例也明显减少,炎症反应较轻,表明MSCs移植可减轻大鼠心肌缺血再灌注后炎症反应。此外MSCs移植对治疗骨性关节炎也具有积极作用,其具体治疗效果还需更多的临床研究[41]。其次,对于免疫性脑脊髓炎、肝缺血再灌注、脑梗死免疫炎性反应、糖尿病视网膜病变炎症和急性胰腺炎等许多常规疗法治疗效果不理想的炎症性疾病,MSCs因为具有特殊的低免疫原性和免疫调节功能,在这些炎症性疾病的治疗中均有明显的治疗效果和缓解作用[42]。
4 展望
大量的实验研究和少部分临床研究结果都表明,MSCs的免疫调节机制在抗炎治疗中具有很重要的潜在应用前景。但现阶段仍存在许多问题亟待解决,如MSCs在活体内的免疫作用机制是否会导致感染与肿瘤还未阐明;对其他多种难以治疗的炎症疾病如中耳炎、脑炎等是否也会有理想的治疗效果;在治疗时如何把握MSCs剂量和使用次数还有待研究;MSCs的移植治疗还缺乏长期的安全性及有效性研究证据等。尽管MSCs距离临床大规模应用还有相当长的路要走,但我们相信,随着更多更全面深入的实验研究,MSCs必将在抗炎治疗方面发挥更重要的作用。
