苯基吡唑缩氨基胍衍生物的合成及其抗菌活性研究
2018-12-28陈华斌李程程宋明霞
罗 辉,陈华斌,梁 焯,李程程,宋明霞
苯基吡唑缩氨基胍衍生物的合成及其抗菌活性研究
罗辉,陈华斌,梁焯,李程程,*宋明霞
(井冈山大学医学部基础医学与药学学院,江西,吉安 343009)
设计合成一系列苯基吡唑缩氨基胍衍生物,用于抗菌活性的筛选。以苯乙酮与盐酸氨基脲为原料,经亲核加成反应、Vilsmeier-Haack反应、亲核取代反应和缩合反应得最终产物4a~4j和5a~5c。采用连续稀释法评价13个化合物对革兰氏阳性菌和革兰氏阴性菌的抑制活性。部分化合物对革兰氏阳性菌和阴性菌显示出一定的抑制活性,其中化合物5c对各种测定菌株均显示出抑制活性,对枯草芽孢杆菌(CMCC 63501)的抑菌活性MIC值达到16 µg/mL。本研究合成的苯基吡唑缩氨基胍衍生物对所选择的革兰氏阳性菌和阴性菌具有一定的抑制活性,虽然活性强度未能达到预期目的,但该研究进一步丰富了缩氨基胍衍生物的抗菌构效关系,为新的抗菌活性化合物乃至候选药物的发现奠定了基础。
缩氨基胍;苯基吡唑;合成;抗菌活性
基于细菌耐药性的快速发展,细菌耐药性成为21世纪全球关注的热点。“今天不采取行动,明天就无药可用”已成为全球的共识。本世纪初以来,在各国政府政策引导推动下,以及学术界和工业界的共同努力下,新上市的抗生素数量和质量都有所提升。在生命科学和生物技术的发展和引领下,新的抗菌药物和治疗方式呈现着强劲的发展态势[1]。然而,任何一种抗生素,伴随着其使用都不可避免的会出现耐药菌株[2-3]。因此,大力研发新结构、新靶点和新机制的新型广谱抗菌药物仍然是药物化学界关注的核心[4]。
研究发现含有吡唑环结构的化合物具有不同的生物活性,如杀虫、除草、杀菌、杀螨等。基于吡唑化合物低毒、高效等优良的生物活性, 吡唑类化合物的分子设计、合成与生物活性研究成为当今绿色农药及医药创制的一个热点[5-7]。N-芳基吡唑是化学合成中常用的中间体,其衍生物常常具有广泛的生物活性,如抗菌[8]、止痛和抗炎[9]等。氨基胍富含电子对,是一个优良的金属配位基,在金属配合物抗癌抗病毒药物研究中表现突出[10-11]。近年来, 有研究报道氨基胍衍生物具有抗菌活性,其抗菌活性与氨基胍的配位作用和氢键结合能力相关[12]。
基于这些发现,本研究尝试将N-芳基吡唑与氨基胍片段进行拼合,设计合成了一系列苯基吡唑缩氨基胍衍生物(图1),并对这些新化合物进行了多种菌株包括革兰氏阴性菌和革兰氏阳性菌的体外抑菌活性评价,期望得到具有广谱抗菌活性的新化学实体。具体合成路线见图2。
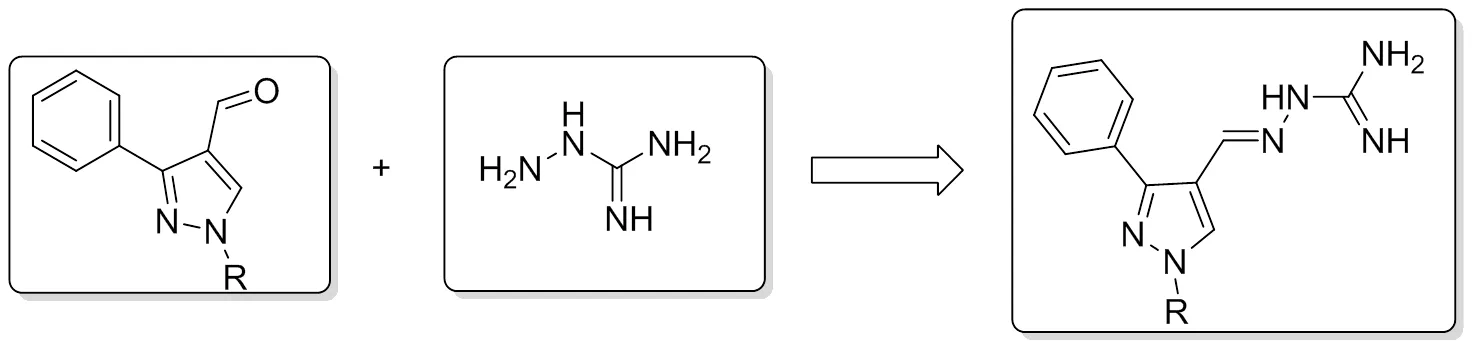
图1 目标化合物的设计

4a R1= H; 4b R1= 4-F; 4c R1= 4-Cl; 4d R1= 2-Cl; 4e R1= 2,4-2Cl; 4f R1= 4-Br; 4g R1= 4-NO2; 4h R1= 4-OH; 4i R1= 4-CH3; 4j R1= 4-OCH3; 5a R1= H, R2 = CH3; 5b R1= H, R2 = C3H7; 5c R1= H, R2 = CH2C6H5;
1 实验部分
1.1 仪器与试剂
核磁共振分析采用BURKER AV-300 型核磁共振仪,四甲基硅(TMS)为内标,溶剂用DMSO-d(Bruker, Switzerland);高分辨质谱采用UltrafleXtreme MALDI-TOF/TOF 质谱仪 (Bruker Daltonik GmbH, Leipzig, Germany)测定;熔点采用毛细管法测定(温度计未经校正)。实验所用试剂包括苯乙酮 (99%,阿拉丁试剂公司)、盐酸氨基脲(99%,阿拉丁试剂公司)、氨基胍碳酸氢盐(99%,阿拉丁试剂公司)、醋酸钠(分析纯,阿拉丁试剂公司)、N,N-二甲基甲酰胺(DMF,分析纯,阿拉丁试剂公司)、三氯氧磷(POCl3,分析纯,阿拉丁试剂公司),和其他常规溶剂(分析纯,国药基团化工试剂有限公司)。所测菌株购自中国科学院微生物研究所。
1.2 化合物合成
1.2.1 化合物1的合成
称取1.12 g(0.01 mol)盐酸氨基脲和1.64 g(0.02 mol)醋酸钠置于装有20 mL水的100 mL圆底烧瓶中,50 °C下搅拌溶解。称取一种取代苯乙酮(0.01 mol)溶解于10 mL无水乙醇中,然后用恒压滴液漏斗缓慢加至圆底烧瓶中,立即产生白色固体,保持温度继续反应2 h。冷却,抽滤,干燥得白色固体化合物1。
1.2.2化合物2的合成
取 8.76 g (0.12 mol) DMF置于50 mL圆底烧瓶中,冰浴下向反应瓶中缓慢滴加6.13 g (0.04 mol) POCl3,并不断搅拌。大约15 min滴加完毕后继续冷却数分钟,然后向反应瓶中分批加入0.01mol化合物1,升温至70 °C反应2~5 h。TLC检测,反应完毕后冷却反应液,搅拌下将反应液倒入30 mL冰水中,用20%氢氧化钠溶液调至pH值为6~7,抽滤,干燥,得到3-取代苯基-4-醛基吡唑(化合物2)。
1.2.3化合物3的合成
称取0.005 mol化合物2和0.83 g (0.006 mol)碳酸钾置于含20 mL乙腈的圆底烧瓶中。90 ℃加热搅拌30 min后,加入0.006 mol硫酸二甲酯(或溴丙烷或氯苄),90 °C回流反应3-5 h。TLC检测,待反应完成后,蒸除反应溶剂,加入20 mL水,用二氯甲烷萃取(20 mL ×3),合并有机层,加无水硫酸镁干燥,静置过夜后抽滤,蒸除溶剂得化合物3粗品,直接用于下一步。
1.2.4化合物4a~4j和5a~5c的合成
取0.004 mol中间体2或3置于含15 mL无水乙醇的圆底烧瓶中,加入0.54 g(0.004 mol)氨基胍碳酸氢盐和5 d浓盐酸。将混合物加热至90 ℃回流反应2~6 h。TLC检测,待反应完成后,减压蒸除溶剂,柱层析纯化(洗脱液为CHCl2: CH3OH = 10 : 1),得到目标化合物。
目标化合物4a~4j和5a~5c的产率、熔点和波谱数据如下:
3-苯基-1-吡唑-4-甲醛缩氨基胍 (4a)
产率 78%; 熔点189~192℃.1H-NMR (DMSO-6, 300 MHz):7.45-7.60 (m, 5H, Ph-H), 7.73 (br.s, 4H, guanidyl-H), 8.21 (s, 1H, N-CH), 8.31 (s, 1H, CH=N), 11.92 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.53, 146.32, 140.70, 134.85, 130.70, 129.40, 129.13, 128.58, 113.84. ESI-HRMS calcd for C11H13N6+([M + H]+): 229.1196; found: 229.1191.
3-(4-氟苯基)-1-吡唑-4-甲醛缩氨基胍(4b)
产率64%; 熔点218~222℃.1H-NMR (DMSO-6, 300 MHz):7.32-7.65 (m, 4H, Ph-H), 7.70 (br.s, 4H, guanidyl-H), 8.19 (s, 1H, N-CH), 8.30 (s, 1H, CH=N), 11.86 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):162.72 (d,1c-f= 246.0 Hz), 155.47, 140.79, 132.20, 130.74 (d,3c-f= 8.3 Hz), 129.71, 129.23, 116.32 (d,2c-f= 21.6 Hz), 113.80. ESI-HRMS calcd for C11H12FN6+([M + H]+): 247.1102; found: 247.1096.
3-(4-氯苯基)-1-吡唑-4-甲醛缩氨基胍(4c)
产率58%; 熔点143~146℃.1H-NMR (DMSO-6, 300 MHz):7.59 (q, 4H,= 8.5 Hz, Ph-H), 7.72 (br.s, 4H, guanidyl-H), 8.22 (s, 1H, N-CH), 8.33 (s, 1H, CH=N), 11.87 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.48, 145.93, 140.63, 134.11, 133.76, 130.28, 130.17, 129.36, 114.00. ESI-HRMS calcd for C11H12ClN6+([M + H]+): 263.0806; found: 263.0802.
3-(2-氯苯基)-1-吡唑-4-甲醛缩氨基胍(4d)
产率38%; 熔点141~144℃.1H-NMR (DMSO-6, 300 MHz):7.48-7.62 (m, 4H, Ph-H), 7.64 (br.s, 4H, guanidyl-H), 7.85 (s, 1H, N-CH), 8.29 (s, 1H, CH=N), 11.79 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.53, 140.46, 140.34, 138.73, 133.10, 132.85, 130.28, 130.21, 130.14, 127.85, 115.27. ESI-HRMS calcd for C11H12ClN6+([M + H]+): 263.0806; found: 263.0800.
3-(2,4-二氯苯基)-1-吡唑-4-甲醛缩氨基胍(4e)
产率71%; 熔点121~123 ℃.1H-NMR (DMSO-6, 300 MHz):7.49-7.56 (m, 2H, Ph-H), 7.62 (br.s, 4H, guanidyl-H), 7.82 (s, 1H, Ph-H), 7.86 (s, 1H, N-CH), 8.36 (s, 1H, CH=N), 11.70 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.49, 155.33, 140.33, 140.28, 134.18, 134.06, 133.99, 129.73, 129.68, 128.06, 115.42. ESI-HRMS calcd for C11H11Cl2N6+([M + H]+): 297.0417; found: 297.0406.
3-(4-溴苯基)-1-吡唑-4-甲醛缩氨基胍(4f)
产率81%; 熔点119~121 ℃.1H-NMR (DMSO-6, 300 MHz):7.55 (d, 2H,= 7.8 Hz, Ph-H), 7.70 (d, 2H,= 7.8 Hz, Ph-H), 7.77 (br.s, 4H, guanidyl-H), 8.21 (s, 1H, N-CH), 8.32 (s, 1H, CH=N), 11.88 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.55, 155.50, 145.94, 140.63, 134.09, 132.27, 130.56, 122.38, 114.00. ESI-HRMS calcd for C11H12BrN6+([M + H]+): 307.0301; found: 307.0294.
3-(4-硝基苯基)-1-吡唑-4-甲醛缩氨基胍(4g)
产率46%; 熔点302~307℃.1H-NMR (DMSO-6, 300 MHz):7.77 (br.s, 4H, guanidyl-H), 7.92 (d, 2H,= 8.7 Hz, Ph-H), 8.31 (d, 2H,= 8.7 Hz, Ph-H), 8.32 (s, 1H, CH=N), 8.44 (s, 1H, N-CH), 12.04 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.64, 154.48, 147.44, 140.35, 138.76, 133.14, 129.49, 122.38, 114.00. ESI-HRMS calcd for C11H12N7O2+([M + H]+): 274.1047; found: 274.1039.
3-(4-羟基苯基)-1-吡唑-4-甲醛缩氨基胍(4h)
产率55%; 熔点266~270℃.1H-NMR (DMSO-6, 300 MHz):6.93 (d, 2H,= 8.3 Hz, Ph-H), 7.21 (s, 1H, OH), 7.38 (d, 2H,= 8.3 Hz, Ph-H), 7.70 (br.s, 4H, guanidyl-H), 8.17 (s, 1H, N-CH), 8.23 (s, 1H, CH=N), 11.84 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):158.75, 155.45, 145.74, 140.94, 135.75, 129.95, 120.50, 116.27, 113.15. ESI-HRMS calcd for C11H13N6O+([M + H]+): 245.1145; found: 245.1141.
3-(4-甲基苯基)-1-吡唑-4-甲醛缩氨基胍(4i)
产率79%; 熔点158~162℃.1H-NMR (DMSO-6, 300 MHz):2.36 (s, 3H, CH3), 7.33 (d, 2H,= 6.7 Hz, Ph-H), 7.46 (d, 2H,= 6.7 Hz, Ph-H), 7.70 (br.s, 4H, guanidyl-H), 8.19 (s, 1H, N-CH), 8.25 (s, 1H, CH=N), 11.87 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):155.48, 146.08, 140.90, 138.71, 135.27, 129.97, 128.45, 127.70, 113.61, 21.31. ESI-HRMS calcd for C12H15N6+([M + H]+): 243.1353; found: 243.1344.
3-(4-甲氧基苯基)-1-吡唑-4-甲醛缩氨基胍(4j)
产率59%; 熔点108~111℃.1H-NMR (DMSO-6, 300 MHz):3.80 (s, 3H, CH3), 7.06 (d, 2H,= 7.5 Hz, Ph-H), 7.51 (d, 2H,= 7.5 Hz, Ph-H), 7.71 (br.s, 4H, guanidyl-H), 8.18 (s, 2H, N-CH, CH=N), 11.92 (s, 1H, pyrazol-NH).13C-NMR (DMSO-6,75 MHz):160.07, 159.68, 155.51, 140.92, 130.08, 129.91, 114.86, 113.81, 113.32, 55.78. ESI-HRMS calcd for C12H15N6O+([M + H]+): 259.1302; found: 259.1295.
1-甲基-3-苯基-1-吡唑-4-甲醛缩氨基胍(5a)
产率50%; 熔点109~111℃.1H-NMR (DMSO-6, 300 MHz):3.94 (s, 3H, CH3), 7.42-7.58 (m, 5H, Ph-H), 7.61 (br.s, 4H, guanidyl-H), 8.19 (s, 1H, N-CH), 8.36 (s, 1H, CH=N).13C-NMR (DMSO-6,75 MHz):159.69, 149.00, 137.13, 133.93, 130.72, 130.27, 128.87, 128.31, 117.23, 37.43. ESI-HRMS calcd for C12H15N6+([M + H]+): 243.1353; found: 243.1361.
1-丙基-3-苯基-1-吡唑-4-甲醛缩氨基胍(5b)
产率60%; 熔点115~117℃.1H-NMR (DMSO-6, 300 MHz):0.89 (t, 3H,= 7.2 Hz, CH3), 1.70-2.10 (m, 2H, CH2CH3), 4.15 (t, 2H,= 6.6 Hz, NCH2), 7.42-7.59 (m, 5H, Ph-H), 7.66 (br.s, 4H, guanidyl-H), 8.20 (s, 1H, N-CH), 8.41 (s, 1H, CH=N).13C-NMR (DMSO-6,75 MHz):158.38, 149.30, 130.28, 129.86, 129.35, 128.93, 128.37, 116.11, 114.47, 53.71, 23.50, 11.45. ESI-HRMS calcd for C14H19N6+([M + H]+): 271.1666; found: 271.1660.
1-苯甲基-3-苯基-1-吡唑-4-甲醛缩氨基胍(5c)
产率65%; 熔点95~97℃.1H-NMR (DMSO-6, 300 MHz):5.43 (s, 2H, NCH2), 7.33-7.59 (m, 10H, Ph-H), 7.69 (br.s, 4H, guanidyl-H), 8.21 (s, 1H, N-CH), 8.47 (s, 1H, CH=N).13C-NMR (DMSO-6,75 MHz):159.39, 149.48, 137.60, 137.21, 133.73, 130.25, 129.28, 129.09, 128.91, 128.40, 128.20, 127.11, 117.36, 55.67. ESI-HRMS calcd for C18H19N6+([M + H]+): 319.1666; found: 319.1662.
1.3 化合物体外抑菌活性实验
测试用细菌先于相应的培养基培养至对数期,将培养好的细菌用培养基稀释成105CFU/mL 浓度接种于96孔细胞培养板中(最终体积为200 μL)。样品和对照药溶解于二甲基亚砜(DMSO)中,DMSO的最终浓度不得高于0.05%。采用连续稀释法获得一系列样品浓度为128~0.5 μg/mL,37 ℃下培养24 h。用酶标仪在630 nm测培养前后吸光度,根据吸光度的变化计算得到最低抑菌浓度即MIC值。所有实验平行进行3次。化合物4a~4j和5a~5c与阳性对照药的体外抗菌活性见表1和表2。
2 结果与讨论
2. 1 合成部分
本实验以氨基脲和苯乙酮为原料,经过Vilsmeier-Haack反应制备了中间体3-醛基-5-取代苯基吡唑,然后与盐酸氨基脲进行缩合得到了目标化合物。目标产物的结构通过核磁共振氢谱、碳谱和质谱得到了确证。结构解析以化合物4a为例:在1H-NMR 中,苄基中亚甲基两个氢受到苯基和氧原子的影响,其吸收峰出现在较高化学位移δ 5.26处,但与苯环的吸收峰可以较好的区分;芳香氢区域在δ 7.45~7.60范围内出现多个吸收峰,是苯环上5个氢的吸收,δ 7.73处有一个钝峰,是胍基氮原子上四个氢的吸收峰,胍基在这里之所以是一个单峰是因为其结构发生了互变使共轭链延长,末端形成了两个相同的NH2;吡唑环上氮氢受吡唑环和氮原子的影响出现在高化学位移δ 11.92处。13C NMR谱也准确的给出了该化合物结构的各种信息,恰好是9种不同化学环境的碳。高分辨质谱分析中,化合物4a理论分子量为229.1196,实际测定值为229.1191,结合氢谱和碳谱可以确证其分子结构。
2.2 药理实验部分
对所合成的目标化合物进行了体外抗菌活性评价,所测菌株包括:4种革兰氏阳性菌(金黄色葡萄球菌CMCC(B)26003、金黄色葡萄球菌CMCC 25923、粪肠球菌CMCC 29212、枯草芽孢杆菌CMCC 63501)、四种革兰氏阴性菌(大肠杆菌CMCC 25922、大肠杆菌CMCC 44568、铜绿假单胞菌CMCC 27853、铜绿假单胞菌CMCC 10104)。采用微量肉汤法测定化合物对所选细菌生长的最低抑菌浓度(Minimal inhibitory concentration , MIC)。本实验选取加替沙星、莫西沙星、苯唑西林、青霉素和诺氟沙星为阳性对照药。实验结果如表1和表2所示。结果表明化合物4c、4f、5c对4种革兰氏阳性菌和4种革兰氏阴性菌均显示出较好的抑菌活性(其MIC值= 16、32、64或128 μg/mL)。其中化合物5c活性最好,其对抗枯草芽孢杆菌(CMCC 63501)的MIC值为16μg/mL。然而,化合物4a、4d、4h和4j却显示对4种革兰氏阳性菌没有抑制活性(其MIC值都 > 128 μg/mL),化合物4a、4b、4d、4g、4h、4j和5a对4种革兰氏阴性菌没有抑制活性(其MIC值都 > 128 μg/mL)。其他化合物对所选的2种或3种菌株显示出一定的抑菌效力,MIC大都为64或128 μg/mL。总的来说,该系列苯基吡唑缩氨基胍衍生物对革兰氏阳性菌比革兰氏阴性菌表现出更强的抑菌效果。
分析不同的化合物结构对所选菌株抑制活性的影响,可以得到一些简单的构效关系。化合物4c和4f对4种阳性菌抑制活性优于化合物4a、4b、4d、4e、4g-4j,说明4位引入氯原子或溴原子对抗菌活性有明显改善。吡唑氮原子上引入取代基,尤其是体积较大的取代基,有利于提高抗菌活性。如表1,表2所示,苯甲基取代较甲基、丙基取代具有更好、更广谱的抑菌活性,推测其原因是亲脂性基团的引入使得分子整体极性降低,易透过细菌细胞膜,进而增强其活性。

表1 化合物4a~4j和5a~5c对所选临床革兰氏阳性菌株的抑制活性 (MIC, μg/mL)

表2 化合物4a~4j和5a~5c对所选临床革兰氏阴性菌株的抑制活性 (MIC, μg/mL)
aStaphylococcus aureus CMCC (B) 26003;bStaphylococcus aureus CMCC 25923;cEnterococcus faecalis CMCC 29212;dBacillus subtilis CMCC 63501;eEscherichia coli CMCC 25922;fEscherichia coli CMCC 44568;gPseudomonas aeruginosa CMCC 27853;hPseudomonas aeruginosa CMCC 10104.
3 小结
本研究设计合成了未见文献报道的 13 个苯基吡唑缩氨基胍衍生物,部分化合物对所选的8种革兰氏阳性菌和阴性菌显示出广谱的抗菌活性,其中化合物5c活性最好,对抗枯草芽孢杆菌(CMCC 63501)的MIC值为16μg/mL。本研究进一步丰富了吡唑类衍生物的抗菌构效关系,为新的抗菌活性化合物乃至候选药物的发现奠定了一定的基础。
[1] 陈代杰. 新世纪以来全球新型抗菌药物研发及前沿研究进展[J].中国抗生素杂志,2017,42(3): 161-168.
[2] 方清,苏丹虹,曾晓军. 584 株铜绿假单胞菌的耐药性分析与研究[J]. 井冈山大学学报:自然科学版,2008,29(8): 79-83.
[3] 许秀珍,张杰,周璐. 标本中铜绿假单胞菌的临床分布及耐药情况[J]. 井冈山大学学报:自然科学版,2008,29(8): 76-77.
[4] 康悦,赵明,张菁. 抗菌新药研发立题的新思考[J].中国抗生素杂志,2017,42(3): 169-175.
[5] Shim J S, Lee J Y, Park H J, et al. A new curcumin derivative, hbc, interferes with the cell cycle progression of colon cancer cells via antagonization of the ca2+/calmodulin function[J]. Chem. Biol., 2004, 11(10): 1455-1463.
[6] Akbas E, Berber I. Antibacterial and antifungal activities of new pyrazolo[3,4-d]pyridazin derivatives[J]. Eur. J. Med. Chem., 2005, 40(4): 401-405.
[7] Ishida J, Ohtsu H, Tachibana Y, et al. Antitumor agents. Part 214: synthesis and evaluation of curcumin analogues as cytotoxic agents[J]. Bioorg. Med. Chem., 2002, 10(11): 3481-3487.
[8] Sangani C B, Mungra D C, Patel M P, et al. Synthesis and antimicrobial screening of pyrano[3,2-c]chromene derivatives of 1H-pyrazoles[J]. Cent Eur J Chem, 2011, 9(4): 635-647.
[9] Girisha K S, Kalluraya B, Padmashree. Synthesis, characterisation and pharmacological activities of1-acetyl/propyl-3-aryl-5-(5-aryloxy-3-methyl-1-phenyl-1H-pyrazol-4-yl)-2-pyraz olines[J].Der Pharma Chemica., 2011, 3(4): 18-27.
[10] Ferreira E G, Wilke D V, Jimenez P C, et al. Guanidine alkaloids from monanchora arbuscula: Chemistry and antitumor potential[J]. Chem. Biodiversity, 2011, 8(8): 1433.
[11] Ren S, Wang R, Komatsu K, et al. Synthesis, biological evaluation, and quantitative structure-activity relationship analysis of new Schiff bases of hydroxysemicarbazide as potential antitumor agents[J]. J. Med. Chem., 2002, 45(2): 410-419.
[12] Mourer M, Dibama H M, Fontanay S,et al. p-Guanidinoethyl calixarene and parent phenol derivatives exhibiting antibacterial activities. Synthesis and biological evaluation[J]. Bioorg. Med. Chem., 2009, 17(15): 5496-5509.
THE SYNTHESIS AND ANTIBACTERIAL ACTIVITY EVALUATION OF ALKYLENE AMINOGUANIDINE DERIVATIVES BEARING PHENYL PARAZOLE
LUO Hui,CHEN Hua-bin, LIANG Zhuo, LI Cheng-cheng,*SONG Ming-xia
(Basic Medical and Pharmacy College, Health Science Center of Jinggangshan University, Ji'an, Jiangxi 343009, China)
To design and synthesize a series of alkylene aminoguanidine derivatives bearing phenyl parazole moiety and evaluate their antibacterial activity.Through nucleophilic addition reaction, Vilsmeier-Haack reaction and condensation reaction, 13 alkylene aminoguanidine derivatives bearing phenyl parazole moiety were synthesized usingsemicarbazlde hydrochloride and substituted acetophenones as starting materials. The inhibition activity of 13 compounds on gram-positive bacteria and gram-negative bacteria was evaluated by continuous dilution method.Part of target compounds showed inhibitory activity against Gram-positive and Gram-negative strains chosen. Among which, compound 5c showed broad-spectrum antibacterial activity and good inhibitory activity againstCMCC 63501 with the minimal inhibitory concentration (MIC) of 16 µg/mL.In the study,alkylene aminoguanidine derivatives bearing phenyl parazole moiety were found with certain antibacterial activity. This found further enrich the structure-activity relationship of alkylene aminoguanidine derivatives, and lay the foundation for the development of new antibacterials.
alkylene aminoguanidine; phenyl parazole; synthesis; antibacterial activity
1674-8085(2018)05-0001-05
R914.3
A
10.3969/j.issn.1674-8085.2018.05.014
2018-05-06;
2018-08-09
国家自然科学基金项目(81560561,31460488);江西省自然科学基金项目(20161BAB215207)
罗辉(1971-),男,江西吉安人,副教授,硕士,主要从事生物学、分子生物学及生物化学研究(E-mail: luohui9898@163.com);
陈华斌(1997-),男,河南驻马店人,井冈山大学医学部药学专业2016级本科生(E-mail: 2052524255@qq.com);
梁焯(1998-),男,甘肃平凉人,井冈山大学医学部药学专业2016级本科生(E-mail:674225920@qq.com);
李程程(1998-),女,云南昆明人,井冈山大学医学部药学专业2016级本科生(E-mail: 1906849028@qq.com);
*宋明霞(1983-),女,山西介休人,副教授,博士,主要从事抗菌化合物的设计、合成及其活性研究(E-mail: freexiaoxiao83@aliyun.com).
