肺原始神经外胚层瘤2例并文献复习
2018-12-20汪庚明张雷周燕孙谦汪朝歌陈丽丽朱博
汪庚明,张雷,周燕,孙谦,汪朝歌,陈丽丽,朱博
(1.蚌埠医学院第一附属医院肿瘤放疗科,安徽 蚌埠 233000;2.胸外科;3.病理科)
原始神经外胚层瘤(primitive neuroectodermal tumor,PNET)的概念由Hart等[1]于1973年首先提出,为神经嵴衍生的较原始肿瘤,发生于中枢神经系统和周围肌肉、骨骼等组织的小圆细胞恶性肿瘤,具有多向分化的潜能。按照发病部位的不同,可分为中枢性(central PNET,cPNET)和外周性(peripheral PNET,pPNET)。pPNET的发病部位很广,以软组织和骨较为多见,主要分布在脊柱旁和四肢[2],发生于肺部者较为罕见。本文报道2例肺PNET,并复习相关文献,旨在提高对该病的认识水平。
1 临床资料
例1,男,66岁,于2017年3月6日入院,患者1个月前无明显诱因出现持续性右侧胸背部疼痛,程度逐渐加剧,活动耐量明显下降,伴胸闷、气促,无咳嗽、咳痰,无咯血。体格检查:右侧胸背部可触及一边缘不规则包块,直径约3 cm,质地较软,触痛(+),活动度较差。右肺呼吸音稍粗,右下肺可闻及少许干啰音,余正常。辅助检查:血常规、生化常规无明显异常。胸部CT示右下肺占位。全身骨扫描示右侧第8、9后肋放射性浓聚,肿瘤侵犯待排。腹部彩超示肝囊肿。例2,女,12岁,于2017年7月25日入院,2016年8月发现左锁骨上肿块伴压痛。1个月前肿块渐增大,伴有左上肢感觉运动障碍。体格检查:发育正常,营养不良,贫血貌,左锁骨上可及一质硬肿块,直径约3.5 cm,边界不清,触痛(+)。胸廓不对称,左侧胸部膨隆,左侧呼吸音消失,右侧呼吸音稍粗,可闻及湿啰音。辅助检查:血常规示白细胞计数15.70×109/L,中性粒细胞计数13.38×109/L,红细胞计数2.52×1012/L,血红蛋白72 g/L;生化常规示白蛋白22.7 g/L。胸腹部CT示纵隔占位,左侧第二、三肋骨、胸腰椎多发转移;纵隔淋巴结转移;左下肺炎症;右肾结石。
例1给予右下肺组织穿刺活检取组织,呈灰白色。例2给予左锁骨上穿刺活检取组织,呈灰白色。标本均经10%中性福尔马林固定,常规石蜡包埋、切片,行HE和免疫组化染色(SP法,所用抗体为CD99、Syn、Vim、EMA等抗体,均购于北京中杉金桥生物技术有限公司),操作步骤严格按试剂盒说明书进行。2例HE染色示肿瘤细胞体积小,大小较均一,圆形或卵圆形,呈片状、条索状分布;细胞界限不清,胞质少,核圆,染色质呈粗颗粒状,核分裂象多见,未见Homer-Wright菊形团结构或假菊形团状排列,见图1。免疫组化结果示2例肿瘤细胞CD99、Vim均阳性,见图2、图3,CK、EMA、Syn、CD34均阴性。例1 Ki-67指数为30%~50%,见图4;例2 Ki-67指数为95%。2例病理诊断为PNET。
例1就诊我科后,病情迅速恶化,出现呼吸困难、意识丧失,遂出院,于出院后1周内死亡。例2先后行全身化疗8周期,化疗方案为VadrC(环磷酰胺 1 350 mg d1,阿霉素42 mg d1-2,长春地辛3.4 mg d1)及IE(依托泊甙115 mg d1-5,异环磷酰胺2 000 mg d1-5),交替使用。肿瘤曾一度有所缩小,目前疾病进展,出现呼吸困难,行对症支持治疗。目前存活,但一般情况较差。
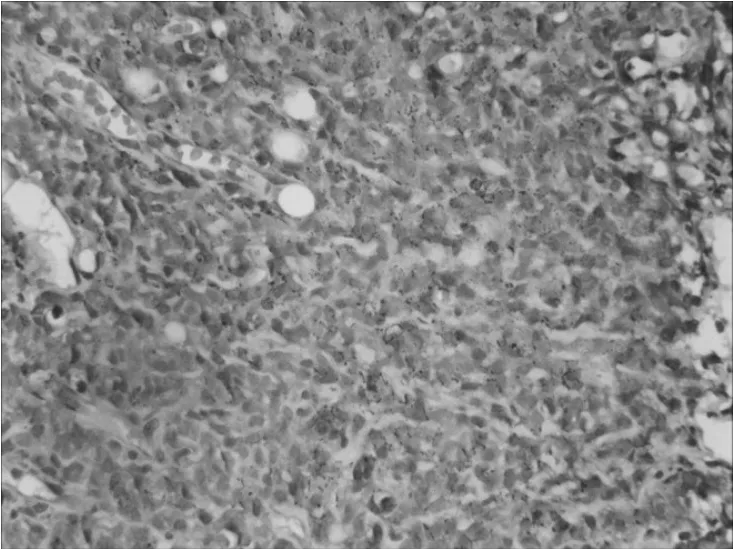
图1 PNET患者1组织标本HE染色(×400)
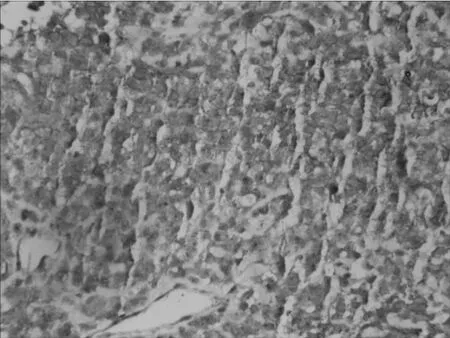
图2 PNET患者1组织标本免疫组化染色(×400)
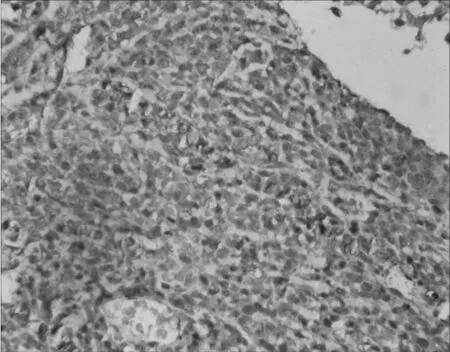
图3 PNET患者2组织标本免疫组化染色(×400)
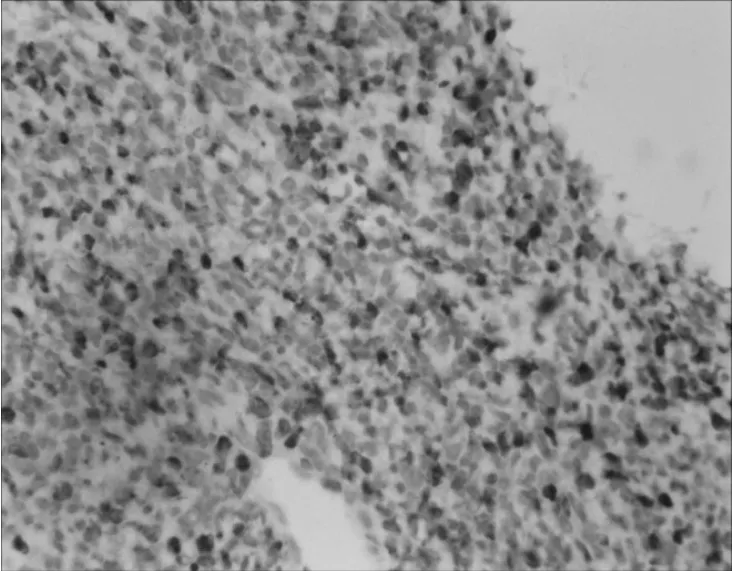
图4 PNET患者1肺组织标本免疫组化染色(×400)
2 讨论
PNET是一种具有多向分化潜能的小圆细胞性肿瘤,发生于肺部者较为少见。pPNET细胞分子遗传学表现为EWS基因和ETS转录因子家族发生的融合。其中,约85%的患者为染色体易位t(11;22)(q24;q12),及由此而产生独特的嵌合基因EWS/FLI1 mRNA表达。另外10%~15%患者为染色体易位t(21;22)(q22;q12),发生EWS基因和ERG基因间的框内融合[3]。但是在cPNET中尚未发现上述染色体易位的现象。
2.1 临床特点 Askin等[4]于1979年报道了一组位于胸肺区的儿童恶性小圆细胞肿瘤,其中75%为女性,预后不良,中位生存期仅为8个月。后来将发生在青少年胸肺部位的PNET称为Askin瘤。而本报道中,1例为老年男性,1例为12岁女性。肺PNET较为少见[5],以胸闷、胸痛、咳嗽、胸壁肿块为常见症状,有时可出现全身症状,如发热、体重下降等。肿块往往迅速生长,可侵及周围脏器。查体甚至可触及胸壁肿块,本报道中,例1即为就诊时可触及胸背部肿块。
2.2 病理组织学特点 肺PNET一般瘤体较大,多呈分叶状或结节状,质地较软,切面灰白色,鱼肉状,因瘤体较大,往往伴有出血和坏死。本文2例均符合上述表现。肿瘤由大小较为一致的小圆细胞构成,胞质少,胞核呈圆形或卵圆形,核深染,核分裂象数目多。部分肿瘤区域可见特征性的Homer-Wright菊形团结构或假菊形团状排列,可作为诊断PNET的重要结构,但并非所有的PNET都可见到该结构[6-7]。PNET肿瘤细胞多表达CD99和Vim,对其它神经内分泌标志物,如NSE、CD56、Syn、S-100等表达并不一致。其中,CD99在pPNET中具有较高的诊断价值[7-8],本文2例CD99均为阳性。细胞遗传学可发现染色体易位或基因融合[9],具有诊断意义。
2.3 诊断与鉴别诊断 肺PNET临床表现和影像学检查均无特异性表现,其诊断及鉴别诊断均较困难。肺PNET临床表现一般为局部肿块。胸部CT可表现为胸腔内软组织影或巨大的囊实性占位,增强扫描时瘤体可显示不均匀强化或者是不强化。本报道中,2例患者胸部CT均显示胸部/纵隔巨大占位。因此,常被误诊为其它恶性肿瘤,如恶性淋巴瘤、小细胞肺癌、神经母细胞瘤等。其确诊主要依据病理组织学检查。
2.4 治疗与预后 肺PNET较为少见,其侵袭性高,病死率高。目前尚无较为有效的治疗方案,推荐采取综合治疗模式,最佳的治疗可能是早期手术切除,术后行放疗、化疗。有文献报道,早期诊断、完全肿瘤切除联合放化疗、瘤内钙化及Ki67指数<30%是预后良好因素[10-11]。本报道中2例患者Ki67指数均较高,预后不佳。肺PNET常用化疗方案有VAC、IE等。大多数研究认为,PNET对化疗较为敏感[12]。本报道中,例2先后行全身化疗8周期,在前3周期化疗后,患者肿瘤一度缩小,说明化疗药物有效。
综上所述,肺PNET临床较为罕见,其症状与肿瘤所在部位密切有关。确诊依赖于病理组织学和免疫组织化学检查,细胞遗传学也有助于确诊。能够早期诊断并采取合理的综合治疗措施可能使患者获得较好的预后。但肺PNET恶性度较高,疾病进展快,总体预后较差。
