人脂肪干细胞的分离、培养及鉴定
2018-12-20李玉秋张雷雷黄飞
李玉秋,张雷雷,黄飞
(山东华思生物科技有限公司,山东 烟台 264003)
脂肪干细胞(adipose-derived stem cells,ADSCs)是2001年Zuk等[1]从真空吸脂术抽出的脂肪中发现的一种间充质干细胞(mesenchymal stem cells,MSCs),其含量约占脂肪组织的10%~20%[2]。ADSCs同其他 MSCs一样,具有自我更新和多向分化的潜能,是成体干细胞的一种,在疾病治疗领域有巨大的潜力。但ADSCs较骨髓干细胞有更高的提取率,其提取率可高达1%~2%,是骨髓干细胞的1 000倍[3]。ADSCs已成为研究者们青睐的种子细胞,本文就ADSCs的提取、培养和鉴定进行研究。
1 材料与方法
1.1 材料
1.1.1 脂肪组织 选取滨州医学院附属医院产科剖宫产产妇皮下脂肪组织,产妇无其他基础疾病,未经过特殊药物治疗,取材前均获得医院伦理委员会批准和产妇知情同意。
1.1.2 试 剂 低 糖 DMEM 培 养 基(Gibco,美国)、胎牛血清(FBS,Hyclone,美国)、Ⅰ型胶原酶(索莱宝,中国)、胰蛋白酶(Gibco,美国)、磷酸盐缓冲液(PBS,Hyclone,美国)、青霉素-链霉素(索莱宝,中国)、CD44-FITC抗体(eBioscience,美国)、CD105-PE(eBioscience,美国)、CD34-APC抗体(eBioscience,美国)、CD45-PerCPCyanine5.5抗体(eBioscience,美国)。
1.1.3 仪器 CO2培养箱(Thermo Scientific,美国)、生物安全柜(香港力康,中国)、低速多管大容量离心机(上海安亭,中国)、手术器械(新华,中国)、70 μm细胞筛网(索莱宝,中国)、细胞培养皿(Corning,美国)、超低温冰箱(Thermo Scientific,美国)、流式细胞仪(BD,美国)等。
1.2 方法
1.2.1 ADSCs提取 (1)将无菌条件下用真空抽脂术提取的腹部皮下脂肪,在生物安全柜内取约5 g,用含有500 U/ml双抗的PBS充分漂洗3遍,剔除肉眼可见的血管及结缔组织,用眼科剪将其充分剪碎,再用PBS反复冲洗,尽量除去红细胞。(2)加入2倍体积的0.2%Ⅰ型胶原酶,振荡混匀后,于37℃的恒温水浴箱消化60 min。(3)加入等体积的含有10%FBS的低糖DMEM培养基终止消化。(4)1 800 r/min离心10 min(离心后分为3层,上层为油脂及未消化完全的脂肪组织,中层为上清液,下层为脂肪干细胞和红细胞等混合细胞的沉淀)。(5)弃上层和中层,加入2 ml完全培养基(低糖DMEM+10%FBS+100 U/ml青霉素-链霉素)重悬细胞沉淀,70 μm细胞筛网过滤,将滤过后的滤液调整细胞浓度为1×108/L接种至60 mm细胞培养皿中,于37℃5%CO2细胞培养箱中培养。
1.2.2 ADSCs培养、传代 将提取的原代ADSCs培养24 h后进行半量换液,48 h后进行全量换液,去除残存的红细胞、细胞碎片等。之后每2 d换液1次,获得纯化后的ADSCs,培养7~9 d后,原代ADSCs可生长融合达到90%,用0.25%胰蛋白酶(含有0.2%EDTA)常规消化后,1∶3传代接种到新的细胞培养皿中持续体外扩增培养。
1.2.3 流式细胞术鉴定ADSCs标志物 取第3代ADSCs鉴定细胞表面特异性标志物CD34、CD44、CD45、CD105,实验步骤:(1)ADSCs用胰酶消化后,1 000 r/min离心4 min,用PBS重悬,计数,每个2 ml EP管取细胞3×105个细胞,1 000 r/min离心 4 min,弃上清,加入 50 µl或100 µl PBS重悬。(2)细胞与抗体孵育:a.空白细胞对照组:加入50 µl PBS;b.加入1 µl CD44-FITC抗体+99µl PBS;c.加入2.5µl CD105-PE抗体+47.5µl PBS;d.加入2.5µl CD34-APC抗体+47.5 µl PBS;e.加入 2.5 µl CD45-PerCPCyanine5.5抗体+47.5 µl PBS;f.将上述4种抗体分别取1 µl、5 µl、5 µl、5 µl加入细胞中+84 µl PBS。4℃避光孵育45 min(每隔15 min摇晃1次)。(3)孵育完后,加入1 ml PBS重悬,1 000 r/min离心4 min,弃上清,加入1 ml PBS再洗一遍,最终加入200µl PBS重悬。(4)应用流式细胞仪进行检测。
2 结果
2.1 ADSCs提取 通过胶原酶法提取得到了ADSCs,提取过程见图1A。提取的原代ADSCs生长状况见图1B-F。ADSCs呈贴壁生长,随着培养时间的增加,其呈现出纤长的纤维细胞样。
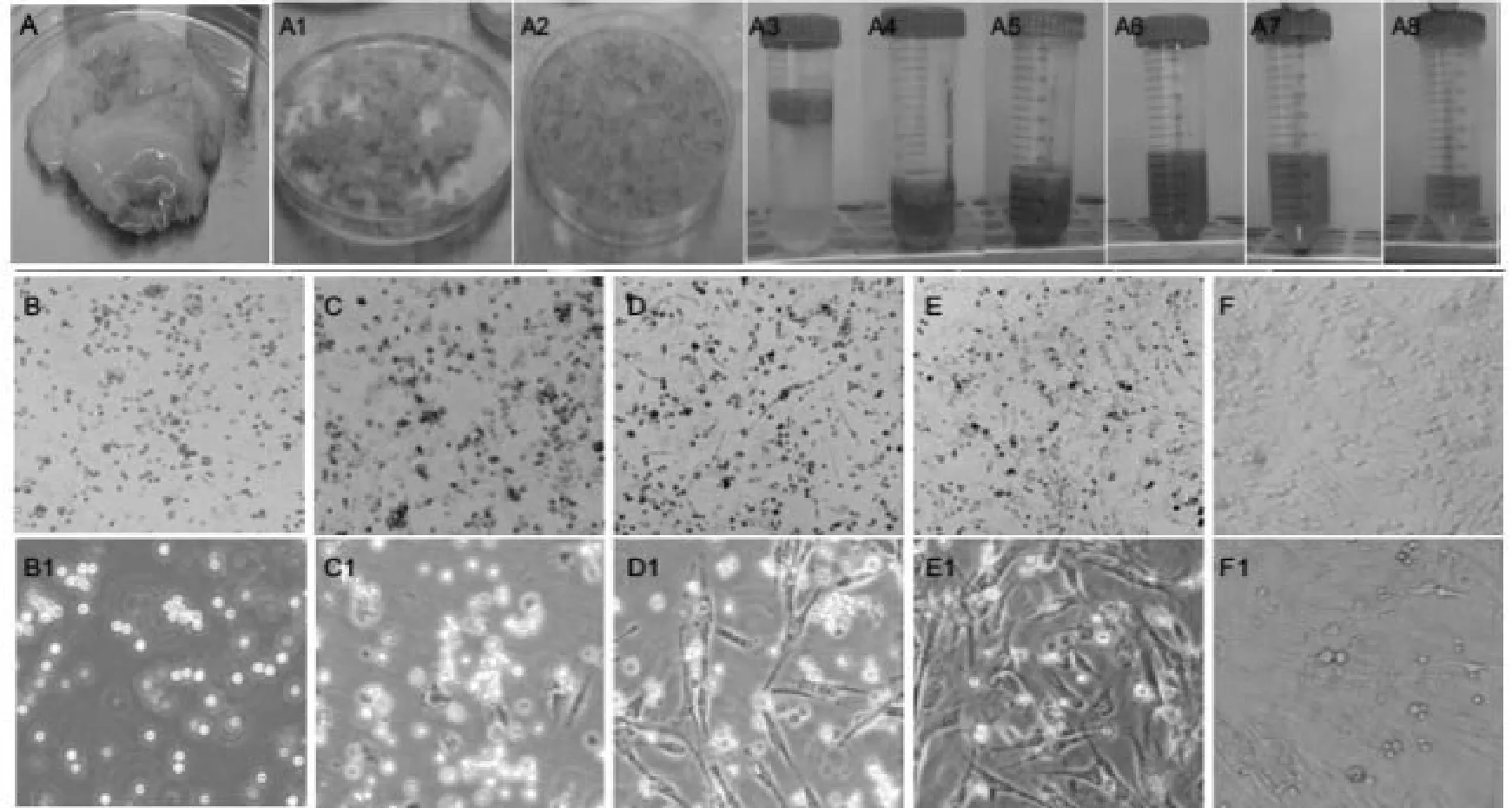
图1 原代ADSCs的提取
2.2 ADSCs培养 传代后的ADSCs接种24 h后,细胞已贴壁,呈圆形、短梭形或者多角形,大小不一;待细胞进入增殖期时,ADSCs逐渐伸展呈现长梭形,排列紧密,呈漩涡状生长,细胞形态与成纤维细胞相似,大小均一,多角形及圆形细胞少见,见图2。

图2 光镜下观察原代ADSCs的培养(×100)
2.3 ADSCs鉴定 成熟后的ADSCs,用流式细胞术鉴定ADSCs的细胞表面特异性标记物,发现CD44和CD105表达阳性,CD34为低表达,CD45表达为阴性,见图3。
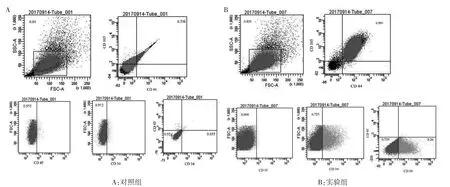
图3 流式细胞术鉴定ADSCs的特异性标记物
3 讨论
ADSCs是从脂肪组织中提取出来的具有多能分化潜能的成体干细胞,拥有来源充足、取材方便、操作简单、体外易培养、生物学性状稳定、免疫原性低、不受伦理学限制等优点,因此是组织工程学应用较为广泛的的种子细胞[4]。随着细胞治疗的发展,ADSCs在治疗、康复、美容等领域均具有较大的应用潜力。ADSCs作为人体组织工程中最大的成体干细胞库,将成为干细胞应用领域中理想的细胞来源[5]。
ADSCs提取方法有很多,刘琴等[6]对其提取分离方法进行总结,主要包括了组织块贴壁法、胶原酶消化法、机械分离法(直接离心法、震荡离心法、旋涡离心法、吸附柱法、超声处理法)、胶原酶结合组织块贴壁法、悬浮培养法等,其中胶原酶消化法提取的ADSCs,其转化成骨的的能力更强[7]。采用胶原酶法消化离心脂肪组织所获得的沉淀称为基质血管成分(stromal vascular fraction,SVF),SVF中除了需要的ADSCs外,还有脂肪前体细胞、成纤维细胞、周细胞、基质细胞、内皮细胞、内皮祖细胞、造血干细胞、血管平滑肌细胞、免疫细胞等[3]。因为SVF中大多数细胞在培养液中处于漂浮状态无法贴壁[8],所以胶原酶法提取的SVF原代培养48 h,再经换液后,获得的所有的贴壁活细胞均为ADSCs[9]。为了进一步鉴定ADSCs,特异性的标记物是最理想的条件,但是由于各种因素的影响,目前尚未明确ADSCs的特异性标记物[10]。2013年,国际脂肪治疗科学联合会(IFATS)和国际细胞治疗学会(ISCT)联合宣布:ADSCs新分离的表型为CD31-/CD34+/CD45-/CD235a-,而体外培养表型为CD31-/CD44+/CD45-/CD73+/CD90+/CD105+[11],也有研究发现CD34为低表达[12-13]。本研究发现,采用胶原酶法可以很好地提取ADSCs,经过原代培养换液,可以获得较纯的ADSCs,且经过流式细胞术鉴定后,发现其表面标志物为CD34+/CD44+/CD45-/CD105+,其中CD34为低表达。
通过本研究发现,采用消化酶法可以成功提取ADSCs,且其性状相对稳定,易于培养。通过流式细胞术鉴定其表面标记物,可证明本研究提取的细胞为ADSCs。用此方法可以较便捷地提取ADSCs,便于后续的转化分析的研究。
(致谢:感谢滨州医学院附属医院产科提供正常产妇来源的腹壁皮下脂肪)
