I型组蛋白去乙酰化酶抑制剂在阻断软骨退化中的作用
2018-12-20顾霄鹏巢海潮顾岳全
顾霄鹏,巢海潮,顾岳全
(1.浙江大学舟山医院 骨科,浙江 舟山 316101;2.江西省人民医院 分子生物实验室,江西 南昌330006;3.舟山顾鹤传骨伤医院 正骨科,浙江 舟山 316101)
关节炎(osteoarthritis,OA)是骨科最常见的疾病之一,也是多种骨关节疾病常见的共同病理表现,其发病机制复杂,治疗缺乏特异并行之有效的办法,治疗效果难以把控。现有研究证实OA的病因主要是软骨细胞被破坏。软骨破坏是基质金属蛋白酶(matrix metalloproteinase,MMP)和聚集蛋白聚糖酶(aggrecanase,ADAMTS)家族中蛋白酶共同介导的结果[1]。软骨细胞是OA关节内MMP表达的主要来源,MMP的增多是通过组蛋白乙酰基转移酶和组蛋白脱乙酰化酶(histone deacetylase,HDAC)家族中的酶催化蛋白乙酰化反应产生的[2]。这些酶不仅可以调节DNA和组蛋白核小体的相互作用,同时也能使细胞核和胞质蛋白都逆乙酰化,最终导致关节功能发生改变[3]。提示组蛋白乙酰化修饰在OA关节软骨退化过程中发挥了关键作用,但其具体机制不明。
本研究通过内侧半月板不稳术(destabilization of the medial meniscus,DMM)构建SD大鼠OA模型,选取广谱性HDAC抑制剂曲古抑菌素A(trichostatin A,TSA)进行体内干预,观察TSA对软骨退化的影响。选取TSA及选择性HDAC抑制剂丙戊酸(valproic acid,VPA)和MS-275,并验证各抑制剂的活性;体外培养人源性关节软骨细胞(human articular chondrocyte,HACs)及软骨肉瘤细胞SW-1353,采用以上HDAC抑制剂及I型HDAC各亚型特异性siRNA,并结合MMP诱导剂白细胞介素-1α(IL-1α)干预,观察各HDAC亚型抑制对细胞MMP表达的影响。进一步利用外植体软骨退化(PNC外植体)试验,验证各HDAC亚型抑制剂对软骨退化的影响。探讨I型HDAC抑制剂在阻断软骨退化中的作用,并初步揭示其可能作用机制,为OA关节软骨退化的治疗及相关研究提供理论基础和思路。
1 材料和方法
1.1 材料 SD大鼠购自长沙天勤生物技术有限公司,动物许可证号:SCXK(湘)2014-0011。HDAC抑制剂(TSA、VPA、MS-275)均购自美国圣克鲁斯生物技术公司。重组IL-1α和制瘤素M(oncostatin M,OSM)购自上海拜力生物科技有限公司。抗总组蛋白H3、抗乙酰化组蛋白H3、抗总组蛋白H4和抗乙酰化组蛋白H4均购自上海研生实业有限公司。抗总α-微管蛋白和抗乙酰化的α-微管蛋白购自美国Abcam公司。人软骨肉瘤细胞系SW-1353购自美国模式培养物集存库。GlutaMAX和链霉素购自美国Gibco Invitrogen公司。莫洛尼鼠白血病病毒反转录酶购自美国Invitrogen公司。核糖核酸酶抑制剂购自美国Promega公司。
1.2 方法
1.2.1 OA模型制备及TSA干预:10只9周龄大小的SD大鼠在正常饮食标准笼中饲养,随机分为2组,手术组和假手术组,每组5只。手术组大鼠行DMM,构建OA模型[4];假手术组大鼠亦行手术干预,但不破坏内侧半月板稳定性,其他均同手术组。术后常规饲养大鼠,并以1 mg·kg-1·d-1的TSA剂量全身给药,给药途径为皮下植入渗透泵注入。8周后处死大鼠,对其膝关节行组织学检查和评估。
1.2.2 细胞培养:从舟山顾鹤传骨伤医院骨科收治的并接受膝关节置换手术的OA患者中提取HACs,这一试验获舟山顾鹤传骨伤医院伦理委员会批准,并经患者签署知情同意书。HACs及人软骨肉瘤细胞系SW-1353分别在含有10%胎牛血清的GlutaMAX培养基及DMEM培养基中培养,培养基中常规加100 IU/mL青霉素和100 μg/mL链霉素,培养条件为37 ℃、5%CO2、恒湿培养箱。
1.2.3 Western blot检测核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平:SW-1353细胞铺于6孔板(1.5×105细胞/孔)并黏附过夜,随后去血清饥饿12 h,再分别行不同浓度的TSA、VPA、MS-275处理6 h。其后,冰上用PBS洗涤2次,收集各组细胞,加入裂解液冰上充分裂解0.5 h,制备细胞总蛋白。采用BCA法测定各样本蛋白浓度。按照说明书及目的蛋白分子量配置相应浓度的SDS-PAGE电泳凝胶,其后依次进行电泳、转膜、封闭、一抗(抗总组蛋白H3、抗乙酰化组蛋白H3、抗总组蛋白H4和抗乙酰化组蛋白H4、抗总α-微管蛋白和抗乙酰化的α-微管蛋白)孵育,4 ℃摇床过夜;次日回收一抗后进行二抗孵育1 h;再用TBST洗膜5次,每次5 min;洗膜后采用ECL法显影定影。根据各条带灰度值,分别计算目的蛋白的相对表达量,设置3次重复实验。
1.2.4 HDAC抑制剂干预试验:体外培养SW-1353细胞系和HACs,细胞铺于6孔板(1.5×105细胞/孔)并黏附过夜,去血清饥饿24 h。根据伴或不伴IL-1α(5 ng/mL)处理,分别加不同浓度的HDAC抑制剂(TSA、VPA及MS-275)干预进行分组,均干预处理6 h。其后,细胞在冰上用PBS洗涤2次,并用TRIzol试剂提取出各组细胞总RNA,备用。
1.2.5 siRNA特异性干扰I型HDAC各亚型的表达:体外培养SW-1353细胞系,细胞铺于6孔板(1.5×105细胞/孔)并黏附过夜,去血清饥饿24 h。根据伴或不伴IL-1α(5 ng/mL)处理设置实验组和对照组;根据I型HDAC各亚型(HDAC-1、HDAC-2、HDAC-3、HDAC-8)特异性siRNA(siH1、siH2、siH3、siH8)再进行亚分组。根据siRNA说明书进行细胞转染,以非靶向控制的siRNA为阴性对照,所采用的引物序列见表1。细胞转染后,通过RT-PCR验证I型HDAC

表1 I型HDAC各亚型siRNA引物序列

表2 RT-PCR实验中I型HDAC各亚型引物序列
1.3 统计学处理方法 采用GraphPad Prism4.0软件进行统计学分析。计量资料以±s表示,2组比较采用t检验,多组比较采用单因素方差分析、Bonferroni校正多重比较等。P<0.05为差异有统计学意义。
2 结果
2.1 TSA对OA关节软骨退化的影响 通过DMM构建SD大鼠OA模型,术后8周处死大鼠,通过组织学评分进行OA评估,结果显示手术组OA大鼠较假手术组大鼠软骨病变主要集中在胫骨内侧平台的中央承重区域,较小部分在股骨内侧髁[14],提示造模成功,符合实验要求。以1 mg·kg-1·d-1剂量的TSA全身给药,关节软骨番红O染色结果显示:给药干预后的OA大鼠较干预前其胫骨内侧平台及股骨内侧髁的软骨损伤有所减轻(见图1A);组织学评分结果显示胫骨内侧平台的软骨损伤较干预前有所减轻,差异具有统计学意义(P=0.015),见图1B。
2.2 Western blot检测核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平 TSA、VPA及MS-275可显著提高核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平(P<0.05),并呈浓度依赖性,即TSA、VPA及MS-275干预各亚型表达干扰情况,引物序列见表2。
1.2.6 外植体软骨退化试验:将软骨盘孵育于37 ℃,5% CO2的湿润空气中24 h,之后将培养基更换为含有细胞因子和(或)HDAC抑制剂无血清DMEM,实验重复4次。在第7天收集上清液,并且将外植体培养直到第14天,收集剩余的软骨和培养基。剩余的软骨外植体在65 ℃木瓜蛋白酶中消化过夜,检测羟脯氨酸的释放量作为胶原降解[5]的测度量,检测糖胺聚糖(glycosaminoglycan,GAG)的释放量作为蛋白多糖降解[6]的测度量。于当天、第1天、第3天、第8天和第10天收集上清液和软骨样本,提取软骨RNA,储存于RNAlater置于-80 ℃备用。
1.2.7 RNA提取及cDNA合成:使用TRIzol纯化收集细胞或组织的总RNA,测定RNA浓度及纯度。使用RNeasy Mini试剂盒进行cDNA合成,根据试剂盒说明合成cDNA。将合成物存储于-20 ℃备用。以cDNA为模板,PCR试剂盒说明步骤进行PCR扩增,反应程序设定如下:预变性95 ℃ 30 s,循环参数:95 ℃30 s,59 ℃ 30 s,72 ℃ 30 min,40个循环,72 ℃延伸8 min。采用相对定量2-ΔCt法计算各基因的相对表达量。浓度越高,组蛋白乙酰化水平越高,HDAC抑制剂的活性越高。见图2。

图1 关节软骨番红O染色(A)及组织学评分(B)观察TSA对OA关节软骨退化的影响
2.3 RT-PCR检测MMP1及MMP13 mRNA的表达 TSA、VPA及MS-275可显著抑制HACs细胞中IL-1α诱导的MMP1及MMP13 mRNA的表达(P<0.05),并亦呈一定程度的浓度依赖性,即TSA、VPA及MS-275干预浓度越高,MMP1及MMP13 mRNA的表达越被抑制。见图3。
2.4 采用siRNA特异性干扰I型HDAC各亚型的表达siRNA特异性干扰处理后,I型HDAC各亚型mRNA表达水平表达下调率为HDAC-1 83%,HDAC-2 89%,HDAC-3 63%,HDAC-8 77%。HDAC-1、HDAC-2基因表达被干扰后,SW-1353细胞中基础的MMP13表达水平较未干扰组细胞明显下降,差异有统计学意义(P<0.01),见图4A;HDAC-1、HDAC-2、HDAC-3及HDAC-8基因表达被干扰后,SW-1353细胞中IL-1α诱导的MMP13的表达水平较未干扰组细胞明显下降,差异有统计学意义(P<0.01),见图4B。
2.5 HDAC抑制剂对OSM诱导的GAG和胶原蛋白产生的影响 以不同浓度HDAC抑制剂处理细胞,检测GAG和胶原蛋白。结果显示:TSA、VPA及MS-275可显著抑制软骨细胞中GAG和胶原蛋白的产生(P<0.05),并亦呈一定程度的浓度依赖性,即TSA、VPA及MS-275干预浓度越高,其抑制作用越强。见图5。

图2 Western blot检测核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平
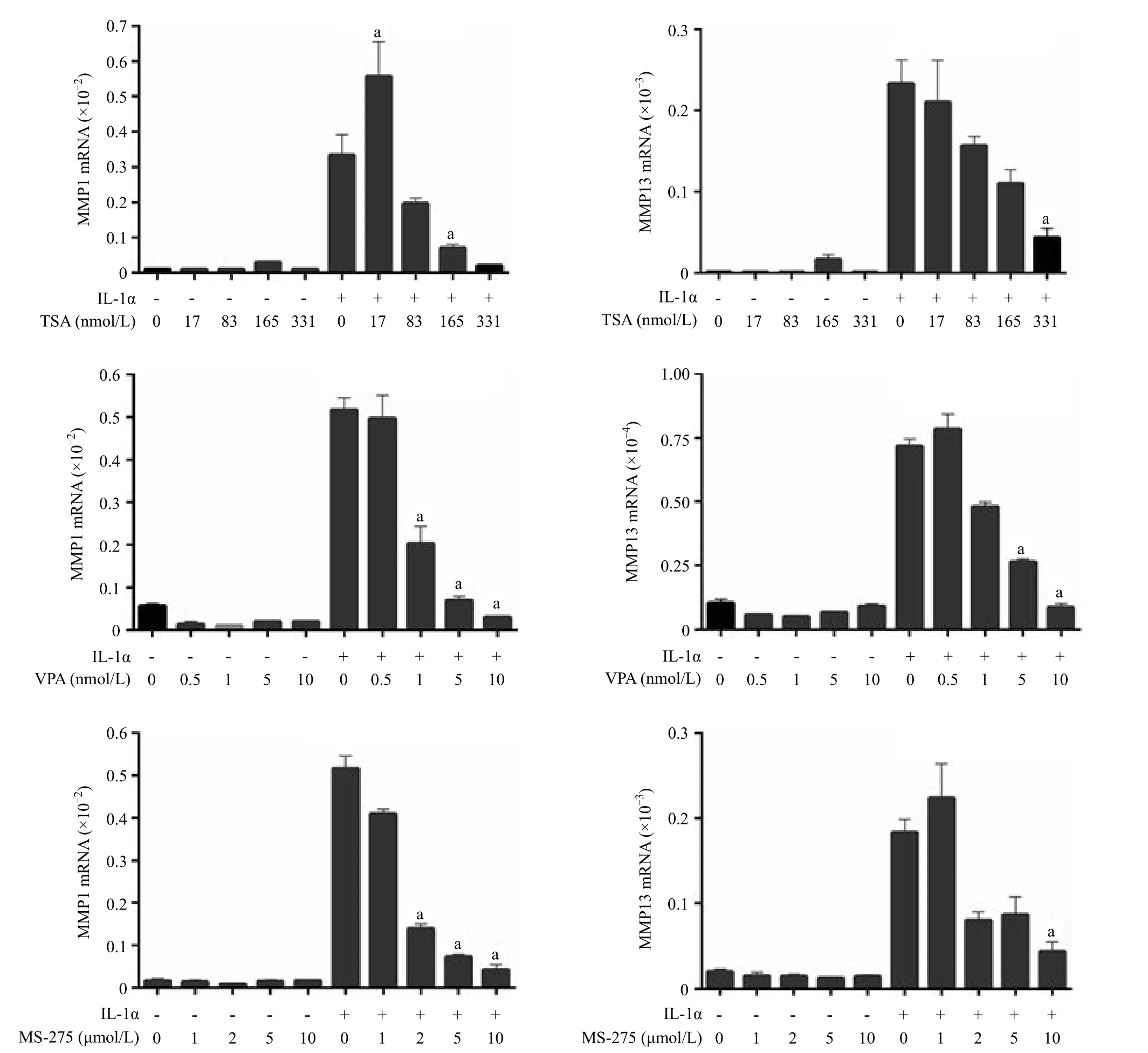
图3 RT-PCR检测MMP1及MMP13 mRNA的表达

图4 siRNA特异性干扰SW-1353细胞中I型HDAC各亚型表达对MMP13 mRNA表达的影响
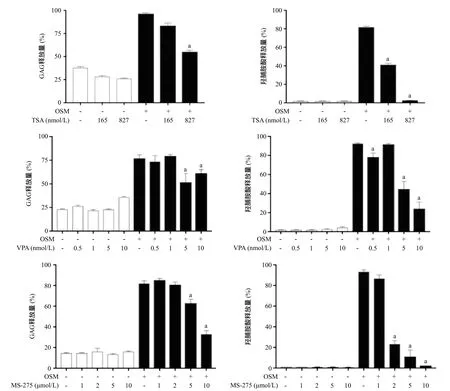
图5 HDAC抑制剂对软骨细胞中OSM诱导的GAG和胶原蛋白生成的影响
3 讨论
TSA为一种广谱HDAC抑制剂,在炎症性OA模型中具有抗关节退化作用。使用TSA干预后可观察到动物模型关节损伤减少与细胞因子表达降低,细胞周期调节子p16INK4a和p21WAF/Cip1表达增加,这与IL-1和(或)肿瘤坏死因子α的表达减少相关[2,7]。此外,在胶原诱导的OA软骨中,TSA通过差动调节Th1和Th2细胞[8]并减少关键MMP的表达,如MMP-3和MMP-13,阻遏疾病进展并改善疾病状况[9]。在关节腔内注射TSA,可减少前交叉韧带切断的兔OA模型的关节损伤,同时伴有MMP1、MMP3、和MMP13表达降低[2]。说明HDAC抑制剂在OA关节中发挥了重要的调控作用。本研究通过DMM构建SD大鼠OA模型,选取TSA进行体内干预,观察TSA对软骨退化的影响;结果显示TSA可明显减轻OA模型SD大鼠胫骨内侧平台及股骨内侧髁的软骨退化程度,验证了HDAC抑制剂在OA中具有抗软骨退化的作用。
软骨细胞是OA关节内MMP表达的主要来源, MMP的增多是通过组蛋白乙酰基转移酶和HDAC家族中的酶催化蛋白乙酰化反应产生的[2]。为了进一步探究HDAC抑制剂抗软骨退化的作用机制,本研究选取广谱HDAC抑制剂TSA及选择性HDAC抑制剂VPA和MS-275进行干预软骨肉瘤细胞SW-1353,采用Western blot检测核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平,验证各HDAC抑制剂的活性。有研究表明,在哺乳动物胶原诱导的关节炎模型中,MS-275能阻止疾病进展和关节破坏[10]。然而,这个HDAC抑制剂尚未在OA的模型中进行测试。本研究结果发现TSA、VPA及MS-275可显著提高核心组蛋白(H3、H4)和α-微管蛋白乙酰化水平,并呈一定程度的浓度依赖性,即TSA、VPA及MS-275干预浓度越高,组蛋白乙酰化水平越高,HDAC抑制剂的活性越高。TSA可以剂量依赖性地诱导α-微管蛋白的乙酰化,而丙戊酸和MS-275不会,这表明只有前者能抑制软骨细胞中HDAC-5和(或)HDAC-6的活性[11-12],说明各HDAC抑制剂可能是通过抑制不同的HDAC亚型发挥药理作用的。
MMP1及MMP13是人关节软骨细胞中参与软骨破坏的关键胶原酶。本研究进一步采用外源性IL-1α诱导HACs细胞MMP1及MMP13表达,结合不同浓度的TSA、VPA及MS-275处理,发现各HDAC抑制剂可显著抑制HACs细胞中MMP1及MMP13的表达,并亦呈浓度依赖性;即TSA、VPA及MS-275干预浓度越高,MMP1及MMP13的表达越被抑制。提示各HDAC抑制剂可能是通过抑制HDAC乙酰化,减少MMP1及MMP13的表达,进而发挥保护软骨退化的药理作用的。
HDAC抑制剂也能调节很多软骨基质分子的表达,但调节机制比较复杂,因为软骨细胞的HDAC抑制剂短期治疗(<24 h)会诱导基因表达的合成代谢[13],而延长治疗会抑制许多转录样本[14]。早期的影响可能是HDAC抑制作用的直接后果,因为HDAC-1、HDAC-2的过表达能抑制ACAN和COL2A1的表达[13]。表明这种抑制是由HDAC的C-末端结构域介导的。本研究采用siRNA特异性干扰I型HDAC各亚型的表达,发现HDAC-1、HDAC-2基因表达被干扰后,软骨肉瘤细胞SW-1353中基础的MMP13表达明显下降;HDAC-1、HDAC-2、HDAC-3及HDAC-8基因表达被干扰后,SW-1353细胞中IL-1诱导的MMP13的表达水平明显下降。提示HDAC各亚型中发挥关节炎调控作用的主要是I型。
HDAC抑制剂的软骨保护特性,可通过在OA体内模型中观察到的关节损伤减少来支持,并且可作为HDAC抑制剂治疗的结果[15]。现鲜有明确的HDAC抑制剂介导的细胞因子诱导MMP表达的报道。虽有研究表明TSA和丁酸钠复合物可抑制HDAC的大部分家族经典成员(除丁酸钠对HDAC-6外),但目前尚不明确哪种HDACs与MMP表达及OA的进展有关[16]。能有效缓解OA的治疗药物较少,疾病末期患者唯一有效的治疗方法是全关节置换[17]。广谱HDAC抑制剂的软骨保护作用表明,经典的HDACs在MMP表达的调
控中发挥重要作用,在OA中也可能如此。虽然广谱HDAC抑制剂对人类的毒性作用没有化疗药物大,但仍不适合用于治疗慢性疾病[18-19]。为了表明哪种HDACs是广谱抑制剂软骨保护作用的主要目标,本研究采用2种已知的选择性抑制剂:VPA和MS-275,与TSA在细胞单层和猪的鼻软骨外植体试验中进行比较。结果证实I型HDAC(HDAC-1、HDAC-2、HDAC-3、HDAC-8)被抑制剂抑制或I型HDACs特异性消耗均能抑制软骨细胞MMP1及MMP13的表达,抑制PNC外植体GAG和胶原蛋白水平,说明I型HDAC抑制剂可能是通过抑制MMP、GAG和胶原蛋白的表达而发挥对软骨退化的保护作用。
