紫铆因对骨肉瘤细胞凋亡和转移的影响及其机制
2018-12-20林增潘天龙吴登颖康晓雕蔡宁宇潘骏
林增,潘天龙,吴登颖,康晓雕,蔡宁宇,潘骏
(温州医科大学附属第二医院育英儿童医院 创伤骨科,浙江 温州 325027)
骨肉瘤是一种以高度恶性和转移为特点的疾病,是青少年和青年人最常见的骨肿瘤之一[1]。尽管化疗和外科手术治疗已有一定的进展,但其5年生存率仅为60%~70%[2]。大多数肿瘤患者的死亡原因为肿瘤的远处转移[3]。通过药物或手术的方式抑制肿瘤细胞的转移和侵袭,可以显著地提高肿瘤患者的长期生存率[4]。
目前常用的化疗药物为阿霉素、顺铂、甲氨蝶呤等,但长期使用有较大的不良反应甚至导致诸多并发症[5]。紫铆因是一种化学名为2’,3,4,4’-四羟基查尔酮(2’,3,4,4’-Tetrahydroxychalcone)的多酚类化合物,具有抗肿瘤、抗氧化及抗血管生成等多种生物活性。紫铆因的抗肿瘤作用在多种肿瘤细胞中通过了验证[6-8],但是在骨肉瘤细胞方面的作用报道较少,因此本研究观察紫铆因对骨肉瘤细胞凋亡和转移的影响及其机制。
1 材料和方法
1.1 材料 U2OS骨肉瘤细胞株购自中国科学院生命科学研究院细胞库。紫铆因购自美国Sigma公司;胎牛血清、DMEM培养基购自美国Gibco公司;CCK-8检测试剂盒、BCA蛋白浓度测定试剂盒购自上海碧云天公司;Tunel试剂盒购自瑞士Roche公司;Bax、Bcl-2、基质金属蛋白水解酶(matrix metallo proteinases,MMP)-2、MMP-9抗体均购自美国CST公司;p-PI3K、p-Akt、GAPDH抗体、山羊抗兔抗体、山羊抗鼠抗体均购自美国Bioworld公司。
1.2 方法
1.2.1 肿瘤细胞培养: U2OS骨肉瘤细胞培养于含10%胎牛血清,1%青霉素、链霉素双抗的DMEM完全培养基。培养条件为37 ℃,CO2含量为5%的恒温培养箱。
1.2.2 细胞活性检测:以0、5、10、25、50和100 μmol/L紫铆因作用于骨肉瘤细胞24 h。使用CCK-8细胞活性试剂盒检测U2OS骨肉瘤细胞活性变化。
1.2.3 Western blot法检测相关蛋白的表达:使用0、25、50、100 μmol/L浓度的紫铆因试剂处理U2OS骨肉瘤细胞24 h后提取细胞总蛋白,使用BCA蛋白浓度测定试剂盒测定总蛋白浓度。SDS-PAGE凝胶电泳、转膜,5% BSA封闭2 h,随后加入相应的一抗稀释液在4 ℃摇床冰箱孵育过夜。次日使用相应的二抗室温摇床孵育2 h,加入ECL显影液,化学发光显像仪上曝光分析。
1.2.4 Tunel染色检测凋亡:以0、25、50、100 μmol/L紫铆因处理骨肉瘤细24 h,4%多聚甲醛固定,3% H2O2封闭,1.5% TritonX-100通透。根据试剂盒说明书进行染色,37 ℃避光孵育30 min后DAPI染色60 s,PBS洗涤后使用滤纸吸干,滴加荧光防淬灭剂,透明指甲油封片,显微镜下观察。
1.3 统计学处理方法 使用SPSS19.0统计软件进行处理。数据以±s表示,每组实验均重复进行3次,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 紫铆因对U2OS骨肉瘤细胞活性的影响 经0、5、10、25、50和100 μmol/L紫铆因处理24 h,U2OS骨肉瘤细胞活性呈剂量依赖性地下降,25、50、100 μmol/L紫铆因处理组与0 μmol/L紫铆因组比,细胞活性差异均有统计学意义(P<0.05)。见图1。
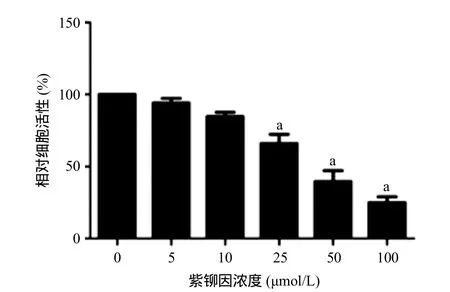
图1 不同浓度紫铆因对U2OS骨肉瘤细胞活性的影响
2.2 紫铆因对U2OS骨肉瘤细胞凋亡的影响 经25、50、100 μmol/L紫铆因处理U2OS骨肉瘤细胞24 h后,Bcl-2相对表达量下降,Bax相对表达量升高,并呈浓度依赖性,50、100 μmol/L紫铆因处理组与0 μmol/L紫铆因组比,Bcl-2、Bax表达差异有统计学意义(P<0.05),见图2;U2OS骨肉瘤细胞的凋亡率随着紫铆因浓度的增加而增强,50、100 μmol/L紫铆因处理组与0 μmol/L紫铆因组比,细胞凋亡百分比差异有统计学意义(P<0.05),见图3-4。
2.3 紫铆因对U2OS骨肉瘤细胞侵袭转移作用的影响 0、25、50、100 μmol/L紫铆因处理U2OS骨肉
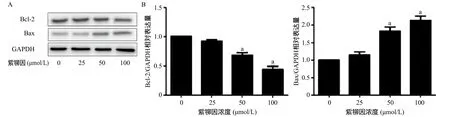
图2 不同浓度紫铆因对U2OS骨肉瘤细胞凋亡相关蛋白表达的影响

图3 不同浓度紫铆因对U2OS骨肉瘤细胞凋亡的影响(Tunel法)
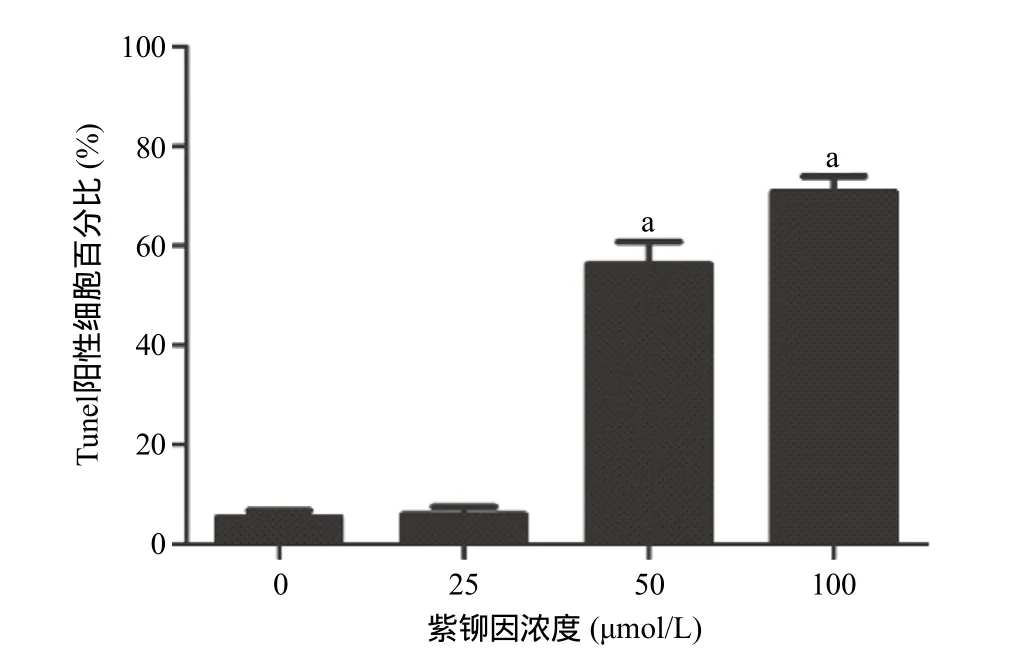
图4 不同浓度紫铆因对U2OS骨肉瘤细胞凋亡百分比的影响
瘤细胞24 h后,U2OS骨肉瘤细胞中MMP-2、MMP-9的相对表达量下降,50、100 μmol/L紫铆因处理组与0 μmol/L紫铆因组比,MMP-2、MMP-9表达量差异均有统计学意义(P<0.05),见图5。
2.4 紫铆因对U2OS骨肉瘤中PI3K-Akt信号通路的影响 通过使用0、25、50、100 μmol/L紫铆因处理U2OS骨肉瘤细胞24 h后,U2OS骨肉瘤细胞中磷酸化PI3K、Akt的相对表达量下降,50、100 μmol/L紫铆因处理组与0 μmol/L紫铆因组比,p-PI3K、p-Akt表达量差异均有统计学意义(P<0.05),见图6。
3 讨论
本实验中,紫铆因在浓度达到50 μmol/L以上时,可呈剂量依赖性地抑制Bcl-2蛋白的表达,并提高Bax蛋白的表达,从而促进骨肉瘤细胞的凋亡反应,Tunel实验中阳性细胞百分比明显升高,起到抗肿瘤的作用。MMPs是一种通过降解细胞外基质并降低细胞之间黏附性的蛋白水解酶。研究表明,MMP-2、MMP-9与肿瘤细胞的侵袭和转移的关系最为密切[9-10],降低肿瘤细胞中MMP-2、MMP-9蛋白的表达水平,可以减弱肿瘤的侵袭和转移[11-12]。在本实验中,紫铆因在浓度达到50 μmol/L以上时,可呈剂量依赖性地抑制MMP-2、MMP-9蛋白的表达,进而起到一定的抑制肿瘤细胞侵袭和转移的作用。
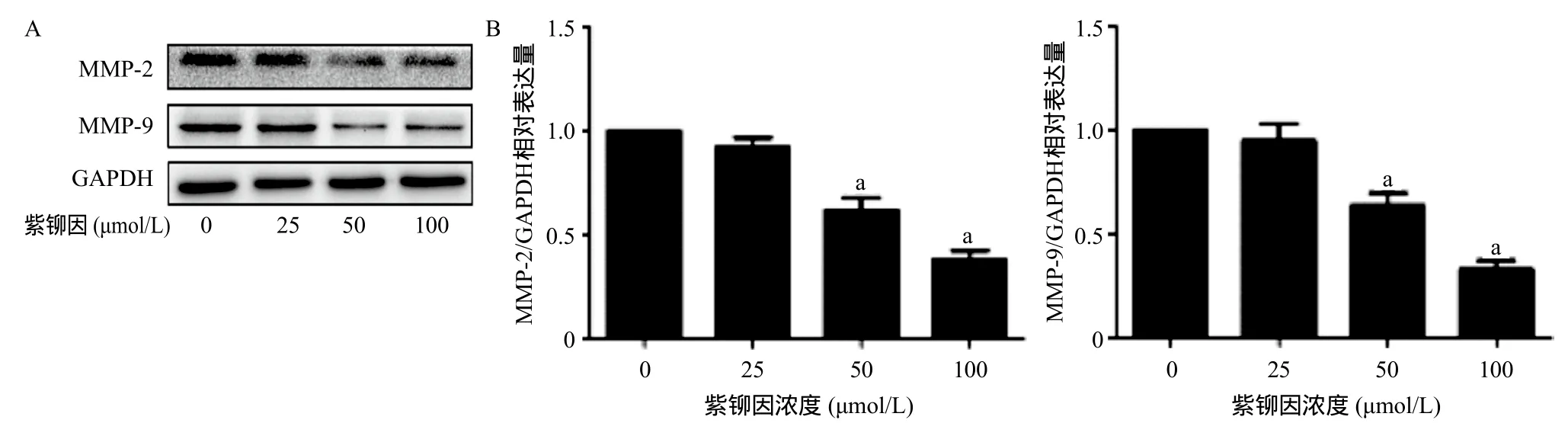
图5 不同浓度紫铆因对U2OS骨肉瘤细胞侵袭转移的影响
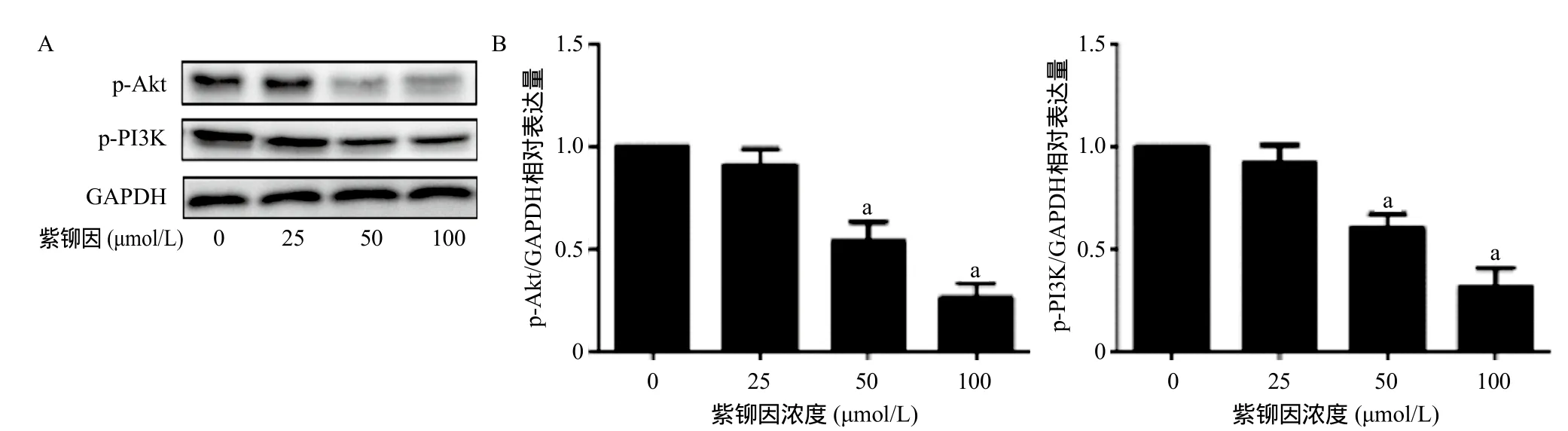
图6 不同浓度紫铆因对U2OS骨肉瘤细胞中PI3K-Akt信号通路磷酸化的影响
有研究表明,骨肉瘤的发生、发展涉及多种细胞内信号通路的激活或抑制,其中PI3K-Akt信号通路最具代表性[13]。在骨肉瘤患者的大多数癌细胞中,均可以发现PI3K-Akt信号通路的相关蛋白被大量激活[14-15]。抑制肿瘤细胞内PI3K-Akt信号通路相关蛋白的激活,可以达到促进骨肉瘤细胞凋亡、抑制细胞内MMPs表达的作用[16]。本实验检测了骨肉瘤细胞中PI3K-Akt信号通路相关蛋白的表达情况,结果显示,在浓度达到50 μmol/L以上时,紫铆因呈剂量依赖性地抑制PI3K-Akt信号通路的磷酸化,表明紫铆因可能是通过抑制PI3K-Akt信号通路的激活来发挥抗肿瘤的作用。但是否有其他的信号通路参与其中,且各种通路之间是否具有一定的交互作用,仍需进一步研究验证。
