黄芪多糖对棕榈酸损伤的人脐静脉内皮细胞内一氧化氮水平的影响
2018-12-20胡兰兰陈佳君陈君第霞潘晓琼胡臻
胡兰兰,陈佳君,陈君第霞,潘晓琼,胡臻
(温州医科大学附属第二医院 中医科,浙江 温州 325027)
血管内皮功能障碍是血管内皮损伤的早期表现与始动因素,在动脉粥样硬化(atherosclerosis,AS)的发生与发展中起着促进作用[1],防治血管内皮功能障碍成为了目前防治AS的研究热点。黄芪多糖(astragalus polysaccharides,APS)是中药黄芪中的活性成分之一,研究表明APS可以促进一氧化氮(nitric oxide,NO)的生成,改善血管内皮功能障碍[2-3],然而其相关机制尚未完全清楚。NO的生成主要受一氧化氮合酶(endothelial nitric oxide synthase,eNOS)和NADPH氧化酶(NADPH oxidase,Nox)的活性影响。研究证实磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)以及Akt为eNOS的上游激酶,可以激活eNOS,产生NO[4],目前许多研究发现APS可以活化AMPK以及Akt蛋白[5-7],而当上调Nox活性,可以增加NO的灭活[8]。本研究以棕榈酸诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立内皮细胞损伤模型,探讨APS对内皮细胞内NO生成的影响。
1 材料和方法
1.1 材料 APS购于美国ATCC公司,HUVECs株购于中国科学院上海生命科学研究院细胞资源中心,胎牛血清、DMEM高糖培养基及棕榈酸购于美国Sigma公司,NO试剂盒购于南京建成科技有限公司,Trizol、反转录试剂盒、荧光定量试剂盒购于美国Inritrogen公司,RNA提取试剂盒购于美国Ambion公司,Nox4、eNOS、β-actin引物合成于美国Invitrogen公司,人Nox4、AMPK、P-AMPK抗体购于美国Proteintech公司,人eNOS、p-eNOS抗体购于上海ABclonal公司,p-Akt、GAPDH抗体购于德国CST公司,所有二抗均购于美国Santa Cruz公司,ECL曝光液试剂盒购于上海碧云天生物公司。
1.2 细胞生存率检测 选取对数生长期的细胞,通过计数板技术,按每孔5×103个细胞将HUVECs种植到96孔板中,每组设置个6个副孔,实验组分别加入400 mg/L(A组)、800 mg/L(B组)、1 600 mg/L(C组)APS溶液,对照组加入等体积PBS溶液,培养24 h。每孔加入10 μL MTT溶液,继续放置在37 ℃恒温箱培养4 h后,吸干每孔溶液,加入100 μL的二甲基亚砜(DMSO)溶液,于酶标仪下检测460 nm波长的吸光度。细胞生存率(%)=实验组吸光度/对照组吸光度×100%。
1.3 建立内皮细胞损伤模型及实验分组 HUVECs用DMEM高糖培养基加10%胎牛血清及100 U/mL青霉素G在37 ℃、5% CO2培养箱中培养。取4~8代HUVECs用于实验。待细胞生长到70%~80%融合时,加入250 mmol/L的棕榈酸共同孵育,建立HUVECs损伤模型,并将细胞随机分为对照组、模型组、APS 400(加入400 mg/L APS)组、APS 800(加入800 mg/L APS)组、APS 1600(加入1 600 mg/L APS)组,按不同浓度要求依次加入等体积的APS溶液共同孵育24 h。
1.4 MTT试验检测APS的细胞毒性 选取对数生长期的细胞,通过计数板技术,按每孔5 000个细胞将HUVECs种植到96孔板中,每组设置个6个副孔,实验组分别加入不同浓度APS溶液,对照组加入等体积的PBS溶液,培养24 h。每孔按要求加入10 μL MTT溶液,继续放置在37 ℃恒温箱培养4 h后,吸干每孔的溶液,加入100 μL的DMSO溶液,于酶标仪下检测460 nm波长的吸光度。
1.5 Western blot检测 收集各组细胞,弃去上清液,PBS溶液清洗3遍,加入细胞裂解液后,12 000 r/min、4 ℃条件下离心10 min,采用考马斯亮蓝法测定蛋白含量,酶标仪595 nm处测定蛋白浓度,取样加入上样缓冲液,沸水中煮10 min,取70 μg上样量进行SDS-PAGE实验,电转至PVDF膜,待电转结束后,用含有5%脱脂奶粉的TBS溶液常温摇床封闭1.5 h,1×TBST溶液清洗3次/5 min后,加入相应一抗溶液,冰箱摇床孵育过夜,1×TBST溶液清洗3次/7 min,加入相应二抗溶液,孵育1 h,1×TBST溶液清洗3次/5 min,biorad凝胶成像系统下ECL孵育显影,检测指标为:AMPK、p-AMPK、p-Akt、eNOS、p-eNOS、Nox4、GAPDH。
1.6 Q-PCR检测eNOS、NOX4 mRNA的表达 取各组细胞,提取RNA:①弃去上清,加入1 mL Trizol充分裂解细胞;②加入200 μL氯仿,静置3 min,12 000 r/min、4 ℃下离心10 min;③溶液静置10 min后,加入500 μL异丙醇,颠倒混匀,12 000 r/min、4 ℃下离心15 min;④弃去上清,加入1 mL无水乙醇,洗涤沉淀,7 500 r/min、4 ℃下离心5 min。合成cDNA:①酶标仪260、280 nm双波长下测定RNA浓度与纯度,灭菌水配平;②按反转录试剂盒说明书进行操作,依次加入Oligo(dT)试剂、dNTP试剂、提取的RNA、DTT试剂及M-MLV酶反转录得到cDNA。PCR定量及分析:方法参照荧光定量试剂盒说明书,加入合成DNA、SYBR染料、引物以及灭菌水,设置好PCR仪的温度与循环,进行PCR定量,最后采用Mastercyler ep realplex检测系统进行定量分析。检测指标为:eNOS、NOX-4及β-actin。
1.7 硝酸酶还原法检验细胞内NO含量 NO化学性质非常活泼,在人体内很快转化为NO2-,再转化为NO3-,本实验利用硝酸酶的还原特异性将NO3-还原成NO2-,通过显色深浅来间接测定NO浓度的高低。收集以上各组细胞悬液,按NO试剂盒说明书进行具体操作,采用酶标仪测定各组550 nm,0.5 cm光径处的吸光度值。按照以下公式计算NO含量:NO含量(μmol/L)=(测定管吸光度-空白管吸光度)/(标准吸光度-空白吸光度)×标准品浓度(100 μmol/L)×样品测试前稀释前倍数。
1.8 统计学处理方法 采用Graphpad7.0和SPSS 22.0统计软件进行统计学分析,计量资料用±s表示,多组间比较用单因素方差分析,组间比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同溶度APS对HUVECs相对生存率的影响 各浓度APS(400 mg/L、800 mg/L)细胞生存率均高于对照组,差异有统计学意义(P<0.05);且相对生存率均大于100%;黄芪多糖在一定浓度范围内(<1 600 mg/L)能促进HUVECs增殖并无明显细胞毒性。见表1。
表1 不同浓度的APS溶液对HUVECs相对生存率的影响(每组n=6,±s)

表1 不同浓度的APS溶液对HUVECs相对生存率的影响(每组n=6,±s)
与对照组比:aP<0.05
组别 细胞相对生存率(%)对照组 95.07±1.31 A组 102.80±2.40a B组 106.20±4.21a C组 102.40±5.49
2.2 APS对HUVECs内AMPK、p-AMPK、p-Akt、eNOS、p-eNOS、Nox4蛋白表达的影响 棕榈酸可以抑制HUVECs内p-AMPK、p-Akt、p-eNOS蛋白表达,上调Nox4蛋白的生成,差异有统计学意义(P<0.05);
NO是维持血管内皮正常生理功能的重要因子,其生物活性下降会导致内皮依赖性血管舒张功能损害,促进AS的形成[9],目前被认为是机体对抗AS的第一道防线。NO主要由细胞内eNOS合成,p-eNOS的Ser1177位点可以激活eNOS,产生NO。而最新的研究表明AMPK作为细胞内能量感受器,是eNOS的上游激酶,能够促进eNOS Ser1177位点的磷酸化,活化eNOS,促进NO的生成[10]。另外,Akt蛋白也被认为是调节eNOS活性功能的酶,p-Akt的Ser/Thr位点可以激活eNOS,促进NO的产生[11]。而NO的灭活主要与Nox的活性有关,Nox4是Nox表达在内皮细胞上的一种主要亚型,是血管内皮细胞O2-的主要来源,Nox4表达上调或活性增加可以使O2-产生增多,O2-而加入APS干预后,HUVECs内p-AMPK、p-Akt、p-eNOS蛋白表达较模型组上调,且APS 1600组与比,差异有统计学意义(P<0.05);eNOS蛋白表达量升高,Nox4蛋白表达量降低,且APS 800组和APS 1600组与模型组比差异有统计学意义(P<0.05)。见图1-2。
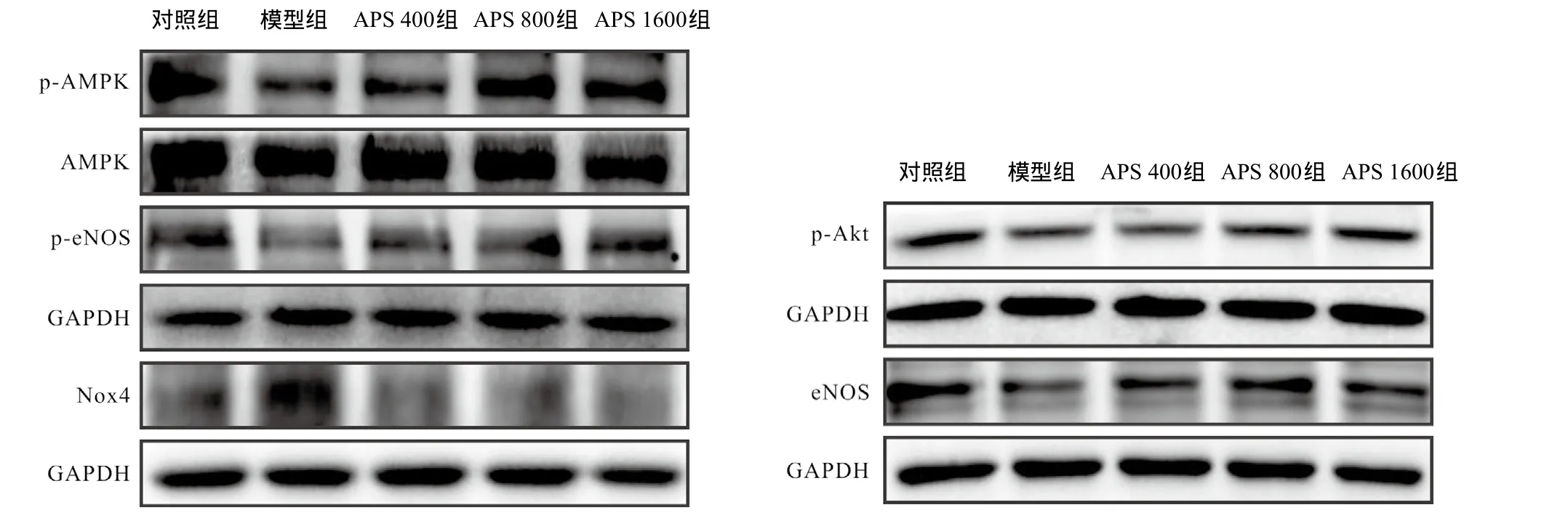
图1 不同浓度的APS溶液对棕榈酸损伤的HUVECs内p-AMPK、p-Akt、eNOS、p-eNOS、Nox4蛋白表达的影响
2.3 APS对HUVECs的eNOS、Nox4 mRNA表达的影响
用棕榈酸刺激HUVECs后,与对照组相比模型组细胞内eNOS mRNA表达下降、Nox4 mRNA的表达上升,差异有统计学意义(P<0.05)。而用APS干预后,与模型组相比3个APS组细胞内eNOS mRNA的表达上升、Nox4 mRNA的表达下降,差异有统计学意义(P<0.05)。见表2。
2.4 APS对HUVECs内NO含量的影响 用棕榈酸刺激HU-VECs后,模型组HUVECs内的NO含量较对照组下降,差异有统计学意义(P<0.05);而与模型组比,用不同浓度的APS干预作用后,HUVECs内的NO含量随着APS的浓度增加而增加,差异有统计学意义(P<0.05)。见表3。
3 讨论

图2 不同浓度的APS溶液对棕榈酸损伤的HUVECs内p-AMPK、p-Akt、p-eNOS、eNOS、Nox4蛋白相对光 密度的影响
表2 APS对棕榈酸损伤的HUVECs内eNOS、Nox4 mRNA表达的影响(每组n=6,±s,%)

表2 APS对棕榈酸损伤的HUVECs内eNOS、Nox4 mRNA表达的影响(每组n=6,±s,%)
与对照组比:aP<0.05;与模型组比:bP<0.05
组别 eNOS mRNA Nox4 mRNA对照组 100 100模型组 46.74± 5.71a 273.0±17.28a APS 400组 93.08±10.43b 207.2±20.33b APS 800组 126.50±12.74b 153.1±21.38b APS 1600组 214.90±26.87b 136.8±19.44b
表3 APS对棕榈酸诱导的HUVECs上清液中NO含量的影响(每组n=6,±s)

表3 APS对棕榈酸诱导的HUVECs上清液中NO含量的影响(每组n=6,±s)
与对照组比:aP<0.05;与模型组比:bP<0.05
组别 NO(μmol/L)对照组 77.97±4.97模型组 38.02±6.69a APS 400组 55.67±1.25b APS 800组 62.41±1.90b APS 1600组 70.98±4.09b
可迅速与NO结合生成氧化能力更强的ONOO-,导致NO灭活增多,引起其生物活性下降,因此,Nox4的活性在内皮细胞氧化损伤中也起决定性作用。
APS是从中药黄芪中提取的一种有效活性成分,目前研究发现APS可以提高异丙肾上腺素诱导的肥厚大鼠内皮细胞内NO的含量,起到保护内皮功能障碍的作用[12],APS可以促进人心脏微血管内皮细胞内NO的生成,改善内皮细胞的缺氧状态和缺氧损伤,保护内皮细胞[13]。然而APS影响NO生成的调控机制目前并未完全阐明。而目前许多研究证实APS可以活化AMPK以及Akt蛋白,因此APS是否可以促进AMPK、Akt蛋白的活化、激活eNOS,产生NO以及APS是否可以通过调节Nox活性,减少NO灭活来达到其防治内皮功能障碍的作用,是本研究的主要内容。
本研究以棕榈酸诱导HUVECs来建立血管内皮损伤细胞模型。棕榈酸作为一种饱和游离脂肪酸,可以通过诱导细胞凋亡与炎症因子释放,造成内皮损伤,并且促进AS的发展[14-16]。因此,实验采用棕榈酸诱导内皮细胞损伤,从细胞层面上观察APS对AMPK、Akt、eNOS及Nox4蛋白活性表达以及细胞内NO含量的影响,探索其改善血管内皮功能障碍、保护内皮细胞损伤的可能机制。
实验结果表明用棕榈酸刺激HUVECs后,细胞内p-AMPK、p-Akt、p-eNOS蛋白以及eNOS mRNA表达下降,Nox4蛋白及Nox4 mRNA的表达上升,细胞内NO的含量降低,这些可以证明血管内皮细胞损伤模型诱导成功。而用APS干预后,能够促进细胞内Akt以及AMPK蛋白的磷酸化,缓解棕榈酸对细胞内eNOS活性的抑制,激活eNOS,促进NO的生成,并且下调Nox4的表达,减少NO的灭活,提高其生物活性。
综上,APS可以上调榈酸诱导HUVECs内p-AMPK、p-Akt、p-eNOS蛋白以及eNOS mRNA的表达,下调Nox4蛋白及Nox4 mRNA的表达,增加细胞内NO的生成,达到缓解内皮细胞损伤的作用,其相关的调控机制可能与其能活化细胞内AMPK及Akt蛋白,激活eNOS,降低Nox4的表达有关。
