急性和慢性低O2高CO2大鼠海马线粒体生物合成改变及其与认知障碍的关系
2018-12-20闵晶晶顾群陈琪王小同
闵晶晶,顾群,陈琪,王小同
(1.湖州市第一人民医院 神经内科,浙江 湖州 313000; 2.湖州市第一人民医院 肾内科,浙江 湖州313000;3.温州医科大学附属第二医院 康复科,浙江 温州 325027)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的呼吸系统疾病。研究显示COPD患者在表现肺功能障碍的同时,还存在着不同程度的认知功能障碍[1-2]。慢性低O2高CO2是COPD发生发展的重要病理机制之一,我们在前期的研究中也发现慢性低O2高CO2模型大鼠存在着不同程度的学习记忆障碍,且与氧化应激、炎症、凋亡和线粒体损伤等密切相关[3-6]。线粒体生物合成是指在核DNA和线粒体DNA两大基因组的协同作用下,细胞内新的线粒体的合成过程。其过程非常复杂:除了合成mtDNA编码的蛋白外,还包括合成新的细胞器结构(包括合成和输入核编码的蛋白),组装双基因来源的衍生蛋白和mtDNA的复制[7]。过氧化物酶增殖激活受体辅助激活物1α(peroxisome proliferator-acti-vated re-ceptor γ coactivator-1α,PGC-1α)在线粒体生物合成中起着主导作用,它可以辅助激活核呼吸因子1/2(nuclear respiratory factors 1/2,NRF1/2)的转录,并作为线粒体转录因子A(mitochondrial transcription factor A,TFAM)的启动子,启动线粒体生物合成,调控mtDNA的复制和转录[8-9]。研究发现神经元退行性疾病的发生与线粒体合成障碍密切相关,在阿尔茨海默病患者的神经元细胞中存在着mtDNA的缺陷,并可导致线粒体电子传递链复合体COX的功能障碍[10]。本研究通过建立急慢性低O2高CO2大鼠模型,观察大鼠学习记忆能力变化及海马区线粒体形态改变,检测PGC-1α、NRF-1、TFAM线粒体生物合成蛋白表达情况及mtDNA的含量,进一步探讨急慢性暴露方式对大鼠学习记忆及线粒体生物合成水平的影响及可能相关性。
1 材料和方法
1.1 材料
1.1.1 试剂和仪器:低O2高CO2氧舱(长沙华曦电子科技有限公司),Morris水迷宫(北京硕林苑科技有限公司),压缩性高纯度N2、压缩性高纯度CO2(温州申鹿公司),透射电镜(日本Hitachi公司),PGC-1α抗体、NRF-1抗体、TFAM(美国Santa Cruz Biotechnology公司),PVDF膜(德国Millipore公司),实时荧光定量PCR仪、SYBR Green染料(德国Roche公司)。ECL发光液、HRP标记的山羊抗兔二抗、HRP标记的山羊抗鼠二抗(杭州自弗德生物科技有限公司)。BCA蛋白浓度试剂盒(上海碧云天生物技术有限公司)。Solution I配置:取0.5 mol/L EDTA 2 mL,1 mol/L Tris-HCl 2.5 mL,20%葡萄糖4.5 mL,用DDW定容为100 mL,高温高压灭菌后,4 ℃保存;每次使用前每50 mL的Solution I中加入2 mL的RNase A(20 mg/mL)。
1.1.2 实验动物:48只SPF级雄性SD大鼠,体质量200~230 g,购自上海斯莱克公司,动物许可证号:SCXX(沪)2007-0005。按随机数字表法随机分为3组:对照组、急性组、慢性组,每组各16只。
1.2 方法
1.2.1 动物造模:急性组、慢性组大鼠置于常压低O2高CO2氧舱内进行造模(O2浓度为9.0%~11.0%,CO2浓度为5.0%~6.0%),每天8 h,急性组造模3 d,慢性组造模4周,每周6 d;其余时间同对照组,于正常环境中(室温20~23 ℃,相对湿度50%~70%)饲养,自然光照,大鼠可自由获得食物和饮水。
1.2.2 Morris水迷宫实验:连续进行5 d,每天3次。水迷宫由一个直径1.7 m、深40 cm的圆形水池组成,分为4个象限,水池里面有约36 cm深的黑色墨汁水,水温维持在26 ℃左右。将大鼠头朝池壁,分别从4个象限任选一个放入水中,若60 s后仍不能找到平台,则系统自动默认潜伏期为60 s,在第1、第2天若未找到则将其引导至平台停留10 s,第3天开始不再引导。第6天进行平台搜索实验,将平台撤去,任选一个象限将大鼠放入水,其后2组大鼠均从该象限入水,观察并记录60 s内大鼠穿越平台的次数。
1.2.3 动物取材:将大鼠经6%水合氯醛腹腔麻醉,0.9%氯化钠溶液快速心脏灌注将血液冲净后,置于冰盘上取脑,快速分离海马-80 ℃冰箱保存。电镜标本经0.9%氯化钠溶液快速灌注后需4 ℃的4%多聚甲醛灌注固定再取海马。
1.2.4 透射电镜观察线粒体:取大鼠海马切成1 mm3的小块,戊二醛磷酸缓冲液固定,常规脱水、浸透、包埋、染色,制成超薄的切片,在透射电镜下观察。
1.2.5 Western blot检测蛋白含量:从-80 ℃冰箱取出大鼠海马组织称重,加入含1 mmol/L PMSF和1 mmol/L组织裂解液(RIPA)300~500 μL,RIPA:PMSF=99:1,放入研磨管充分研磨,置冰上裂解20 min,使充分裂解。转移至1.5 mL EP管中,4 ℃,3 000 r/mim离心5 min。超声裂解3次,每次5 s。低温高速离心机4 ℃,12 000 r/mim 离心20 min,取上清,分装,-80 ℃保存。留1管用BCA蛋白浓度试剂盒测浓度。加双蒸水及Loading buffer配置成上样体系。通过SDS-聚丙烯酰胺凝胶分离等量的大鼠海马蛋白质并转移至PVDF膜,在室温下用5%无脂奶粉将PVDF膜封闭2 h。然后将膜与各自的一抗在4 ℃温育过夜,PGC-1α一抗(1:100),NRF-1、TFAM一抗(1:500),TBST洗膜5 min×6次,加HRP标记的山羊抗兔或山羊抗鼠二抗(1:5 000),室温孵育2 h,TBST洗膜5 min×6次,用ECL发光液覆盖膜(每张约60 μL),曝光后进行分析计算。
1.2.6 RT-PCR检测mtDNA:将海马标本从-80 ℃冰箱取出,再加入4 mL 4 ℃预冷的Solution I,研磨管匀浆;匀浆液转移至EP管,4 ℃,500 r/mim离心5 min;取上清液,4 ℃ 800 r/mim离心10 min。然后根据QIAGEN DNA(德国QIAGEN公司)提取试剂盒说明书进行线粒体DNA提取。检测线粒体DNA浓度后严格按照试剂盒要求进行qPCR反应液的配制,线粒体DNA拷贝数以线粒体编码基因细胞色素b的拷贝数为代表。引物序列:上游5’-AAAGCCA CCTTGACCCGATT-3’,下游3’-GATTCGTAGGGCCGCGAT A-5’,以β-actin作为内参,引物序列:上游5’-AGTG TGACGTTGACATCCGTA-3’,下游3’-CCAGAGCAGTAATCT CCTTCT-5’。反应条件:预变性:95 ℃,120 s,1个循环;扩增:95 ℃ 5 s,60 ℃ 1 min,72 ℃ 30 s,共40个循环;溶解:95 ℃ 1 s,65 ℃ 15 s,共1个循环;冷却:40 ℃ 30 s,共1个循环,采用△CT法计算mtDNA的相对表达量。
1.3 统计学处理方法 采用SPSS17.0统计分析软件,所有数据以±s表示。水迷宫潜伏期采用水迷宫重复测量数据的方差分析,其他数据组间比较均采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫检测低O2高CO2对大鼠学习记忆的影响 图1显示了各组搜索平台的路线。与对照组比,急性组大鼠每天训练的逃避潜伏期和游泳距离差异无统计学意义(P>0.05);慢性组的逃避潜伏期(P<0.01)和游泳距离明显长于对照组(P<0.05)。在水迷宫实验第6天的空间探索实验中,与对照组比,急性组穿越平台次数差异无统计学意义(P>0.05),慢性组穿越平台次数较急性组显著减少(P<0.05)。见表1。
2.2 透射电镜观察低O2高CO2对海马区线粒体形态的影响 透射电镜观察显示对照组线粒体双层膜结构完整,嵴清晰,内容物饱满。急性组大鼠海马区线粒体双层膜完整,结构尚清晰,而慢性组大鼠海马区线粒体膜出现肿胀,膜模糊不清,部分膜破裂,线粒体空泡变,嵴紊乱或疏松溶解,部分消失。见图2。
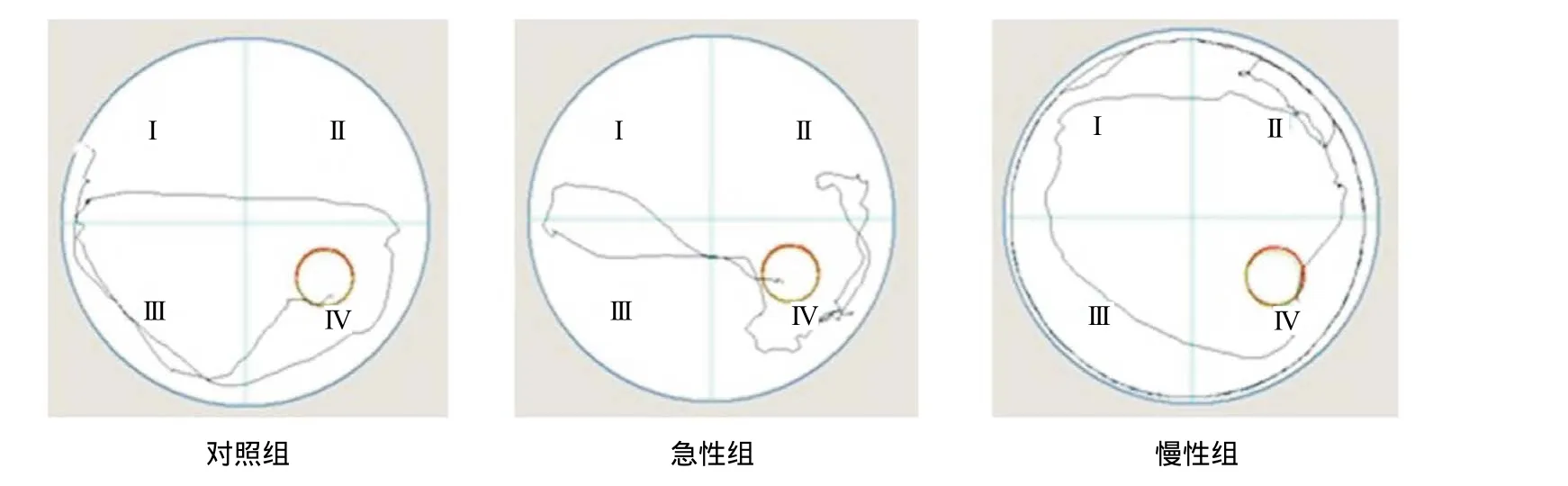
图1 各组大鼠在Morris水迷宫中搜索平台的路线图
表1 Morris水迷宫实验逃避潜伏期、游泳距离、穿越平台次数比较(每组16只,±s)

表1 Morris水迷宫实验逃避潜伏期、游泳距离、穿越平台次数比较(每组16只,±s)
与对照组比:aP<0.05,bP<0.01
组别 逃避潜伏期(s) 游泳距离(m) 穿越平台次数对照组 24 063.39±3 772.68 14.57±2.24 3.91±1.16急性组 25 106.33±4 741.03 14.98±2.31 3.87±1.46慢性组 28 077.12±4 575.77a 17.87±2.70b 2.63±1.06a
2.3 低O2高CO2对海马区线粒体生物合成相关蛋白表达影响 Western blot结果显示急性组大鼠海马PGC-1α蛋白水平较对照组明显增加(P<0.01),其下游级联蛋白NRF-1和TFAM蛋白表达均较对照组表达增加(P<0.05);慢性组PGC-1α、NRF-1、TFAM表达较对照组减少(P<0.01)(见图3、表2)。
2.4 低O2高CO2对海马区mtDNA拷贝数影响 实时定量PCR结果显示,急性组mtDNA拷贝数(1.879±0.234)较对照组(0.998±0.002)增加(P<0.01),慢性组mtDNA拷贝数(0.598±0.178)较对照组减少(P<0.05)。
3 讨论
线粒体功能障碍是退行性疾病的一个重要特点。细胞内的线粒体并非静止,其一直处于融合与分裂的动态变化之中。线粒体的平均寿命只有10 d左右,所以通过线粒体生物合成补充新的线粒体对于组织正常功能及应激条件下细胞的适应性至关重要。线粒体生物合成过程受到细胞内外多个蛋白及信号通路的调控。有研究发现亨廷顿舞蹈病的患者出现了PGC-1α及其下游因子的下调[7],而使用了重组人线粒体转录因子A(recombinant-human mitochondrial transcription factorA,rhTFAM)的小鼠在旋转棒上跑的距离是对照组的2倍[11]。
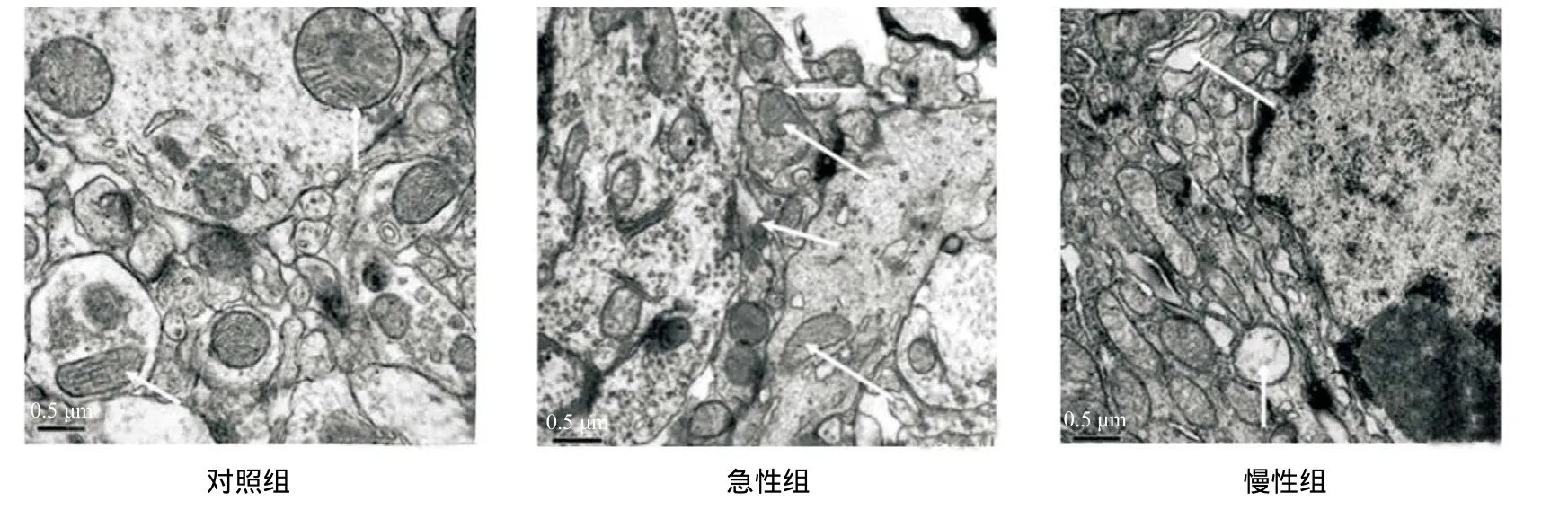
图2 透射电镜观察各组海马区线粒体结构改变(箭头所指为线粒体)

图3 各组海马组织PGC-1α、NRF-1、TFAM蛋白表达电泳图
表2 3组大鼠海马区线粒体生物合成相关蛋白表达(每组16只,±s)

表2 3组大鼠海马区线粒体生物合成相关蛋白表达(每组16只,±s)
与对照组比:aP<0.05,bP<0.01
组别 PGC-1α NRF-1 TFAM对照组 1.609±0.261 1.076±0.169 1.064±0.142急性组 2.804±0.153b 2.016±0.129a 1.853±0.097a慢性组 0.751±0.186b 0.627±0.133b 0.673±0.094b
PGC-1α是调节线粒体生物合成的重要转录因子,其通过激活NRF1/2,进而成为TFAM的启动子,从而启动线粒体基因的转录和复制。NRF-1的转录活性与许多核基因编码的线粒体呼吸链复合物,亚铁血红素生物合成的酶,蛋白相关的线粒体输入机制,线粒体核糖体蛋白及tRNA合酶等的合成有关[12]。而且NRF1和NRF2还调节着TFAM和转录因子B蛋白的转录,这两者都是mtDNA转录和复制的主要调控者[12]。雌激素相关受体(ERR-α、ERR-β、ERR-γ)是核受体超家族的成员,在激素信号下促进线粒体生物合成。ERR-α控制着核基因编码的线粒体相关因子的转录,这些因子参与了氧化磷酸化、脂肪酸氧化、三羧酸循环和线粒体的融合与分裂[13]。PGC-1α作为转录辅助激活因子,控制着线粒体的各类的转录因子,包括NRFs和ERRs[13]。在线粒体COX缺陷的小鼠模型中发现过表达PGC-1α能缓解线粒体缺陷及诱导线粒体增殖[14]。此外,在线粒体复合物III和IV缺陷的人类细胞中发现PGC-1α或PGC-1β的表达能明显提高线粒体呼吸能力[15]。因此,PGC-1α被认为是线粒体生物合成和功能的主要调控者。
研究证实线粒体功能缺陷是许多神经系统疾病的病理基础[16]。条件性的或突发事件导致的线粒体功能障碍,比如缺氧缺血性脑损伤会使得大脑能量代谢产物ROS大量释放增加,从而加重神经元损伤[16-17],此时增加线粒体的数量来代偿损伤线粒体的功能成为挽救残存神经元的关键。有研究在短暂性全脑缺血的大鼠中观察到了线粒体的延伸,这是线粒体生物合成一个重要步骤[18],而持续30 min的缺血则会引起mtDNA的减少[19]。本研究结果显示,急性的低O2高CO2刺激增加了线粒体的生物合成,而长期暴露于低O2高CO2环境则引起了线粒体生物合成的减少。行为学实验发现急性刺激尚未引起实验大鼠的认知功能,而4周的慢性暴露则引起了大鼠的学习记忆障碍。这可能是在急性应激下,细胞的需氧量增加,氧化磷酸化加速,ROS开始释放增加。ROS的堆积可以激活线粒体上非特异通透性转运孔道开放并促使凋亡因子的释放[20]。受到攻击的线粒体启动了一系列的自我保护机制,这其中包括启动线粒体生物合成来增加线粒体的数量从而代偿受损线粒体的功能,以此挽救受威胁的神经元。因此在神经元功能尚能维持的情况下,大鼠的学习记忆尚未受到影响。而在长期的慢性暴露过程中,机体需氧量增加,活性氧自由基不断产生,神经元细胞大量凋亡及坏死,过多线粒体的生成将有更多的能量消耗,进一步威胁残余神经元的存活。同时,我们的研究也发现此时大鼠脑内自噬的活性也很高,低氧下的自噬可以促进受损线粒体的降解,并且可以抑制线粒体的生物合成来减少能量消耗[21]。所以我们推测以上各因素的共同影响导致了慢性组大鼠的学习记忆障碍及生物合成的减少。
综上,急性低O2高CO2环境尚未引起大鼠学习记忆障碍,但却能增加大鼠海马区线粒体生物合成水平;而长期暴露低O2高CO2环境则导致大鼠学习记忆能力下降,且出现大鼠海马区线粒体生物合成水平下降;因此线粒体生物合成水平的下降可能是长期低O2高CO2暴露下大鼠学习记忆障碍的原因之一。
