不同酵母对无花果酒高级醇、氨基酸的影响研究
2018-12-15蒋成付云云杨云洁李晗魏妙宏陈安均刘兴艳张志清
蒋成,付云云,杨云洁,李晗,魏妙宏,陈安均,刘兴艳,张志清
(四川农业大学 食品学院,四川 雅安,625014)
无花果(FicuscaricaLinn)称蜜果、天仙果,属于桑科榕属的植物果实[1]。无花果营养丰富,富含多糖、黄酮、呋喃香豆素内酯等功能成分[1-2]。同时,还含有有机酸、氨基酸、矿质元素等[3],有文献报道无花果的氨基酸含量高达4 000 mg/kg[4],鲜果中氨基酸种类有18种,含有人体所需的8种必需氨基酸[5]。目前,无花果主要以鲜食和药用价值为主[3],然而,无花果受季节影响强,极不耐贮藏,常温一般贮藏1~2 d[1],极大制约了无花果产业的发展。有研究提出,将无花果酿制成酒,能够保留无花果的营养价值和药用价值,延长保存时间[6],无花果酒具有改善血脂和控制体重等功效[7]。
高级醇指碳原子数大于2的醇类总称,由于高级醇在水中呈现油状又俗称杂醇油,主要是正丙醇、正丁醇、异丁醇、正戊醇、异戊醇、苯甲醇等醇类[8-9]。适量的高级醇赋予果酒特有醇香,增强风味,但当含量过高时,会使酒体粗糙产生异、杂味、具有致醉性,还会使人产生头晕、恶心、呕吐等症状[10]。目前,无花果酒专用酵母匮乏,采用商业酿酒酵母酿制无花果酒是一个不错的选择,但有文献报道商业酵母在发酵代谢过程中产生较多的高级醇[3]。同时,有文献报道[11]高级醇的代谢途径为氨基酸代谢和糖代谢途径,无花果氨基酸丰富,满足酵母在发酵过程中产生高级醇的条件。
基于上述原因,以无花果果汁和5株优良的商业酵母发酵无花果酒为对象,对不同酵母发酵的无花果酒中氨基酸和高级醇进行分析与对比,筛选较优的酿酒酵母,为无花果酒的研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
无花果购自雅安农贸市场;无水乙醇:色谱纯,购自成都市科隆化学品有限公司;乙酸正丁酯、正丙醇、正丁醇、异丁醇、正戊醇、异戊醇、苯乙醇:色谱纯,购自上海阿拉丁试剂公司;偏重亚硫酸钠、磷酸二氢钠、蛋白胨、酵母粉、琼脂为国产生化试剂。
酵母KD、D254、EC1118、X16、BO213:购自烟台帝伯仕商贸有限公司。
1.1.2 培养基
YEPD培养基:酵母粉10 g、蛋白胨20 g、葡萄糖20 g、蒸馏水1 000 mL、pH 6.0、115 ℃灭菌20 min。
无花果果汁培养基:无花果破碎后榨汁,加入60 mg/L的果胶酶,0.7 g/L的硅藻土40 ℃恒温保持4.5 h,虹吸上清液得清汁,加入SO2并调整其浓度为80 mg/L,然后加入蔗糖,调整无花果清汁糖度为20 Brix,置于4 ℃冰箱备用。
1.1.3 主要仪器设备
气浴恒温振荡器(ZD-85型),金坛市科析仪器有限公司;生物安全柜(HR40-IIA2),南京温诺仪器设备有限公司;生化培养箱(SPX-250),上海申贤恒温设备厂;分析天平(京制00000249号),北京赛多利斯仪器系统有限公司;电热恒温水浴锅(DZKW-D-4),北京市永光明医疗仪器厂;CX21双目光源生物显微镜,奥林巴斯有限公司;气相色谱仪(7890B),Agilent Technologies;1 μL微量进样器,上海安亭微量进样器厂。
1.2 实验方法
1.2.1 菌种的活化
5株活性干酵母按0.03%的比例称取,加入质量分数为5%的糖水中,在30 ℃条件下活化30 min。将活化的酵母全部转入无花果果汁培养基中,在28 ℃、150 r/min气温恒温振荡器中培养48 h,离心,弃上清液,用无菌生理盐水洗涤3次,重新悬浮于细胞,用无菌生理盐水将悬浮液菌数调至1×107CFU/mL备用[12-13]为种子液。
1.2.2 无花果酒的酿制工艺
工艺流程主要参考文献[14-15]。
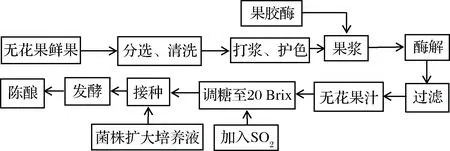
操作要点:将购买的鲜果挑选出烂果,然后清洗2~3次,进行打浆,添加5 g/L的维生素C进行护色[12],加入60 mg/kg果胶酶,在40 ℃条件下酶解4 h后,进行过滤获得无花果汁。用白砂糖调至无花果汁的糖度为20 °Brix,然后加入80 mg/kg SO2,接种1.2.1活化好的种子液,接种量为5%,在22 ℃条件下进行发酵,发酵8 d后,进行倒罐处理,去除酒脚,然后在22 ℃条件下后发酵8~10 d,将原酒转入磨砂广口瓶中(每个广口瓶倒满)、密封,在室温下进行陈酿60 d,获得无花果酒。
1.2.3 无花果酒理化指标的测定
分别测定5株菌株发酵无花果酒的酒精度、总酸、总糖、干浸出物,测定方法按照国标GB/T 15038—2006中的方法测定。
1.2.4 无花果酒中高级醇的测定
1.2.4.1 气相色谱条件
HP-INNOWAX色谱柱(30 m×0.250 mm);程序升温:初始温度40 ℃,保持4 min后,以3.5 ℃/min升至170 ℃,以20 ℃/min升至200 ℃保持10 min;进样量:1 μL;分流比50∶1;分流流量50 mL/min;空气流量400 mL/min;H2流量30 mL/min;尾吹气流量25 mL/min。
1.2.4.2 混合标准溶液的配制
准确称取正丙醇、正丁醇、异丁醇、正戊醇、异戊醇、苯乙醇标准品0.640 0 g于100 mL容量瓶,称取乙酸正丁酯0.8 g于100 mL容量瓶,用20%乙醇溶液定容配制成混合标准溶液贮备液和乙酸正丁酯贮备液,将贮备液进行梯度稀释,配制成正丙醇、正丁醇、异丁醇、正戊醇、异戊醇、苯乙醇含量为640.00、320.00、160.00、80.00、40.00、20.00、10.00 mg/L的混合标准液,不同梯度混合标准液中含有80.00 mg/L的乙酸正丁酯。
1.2.4.3 高级醇定性
根据1.2.4.1的色谱条件,取各高级醇和乙酸正丁酯的单标溶液1 μL过0.22 μm的无机水系滤膜进行气相色谱分析,确定各物质的保留时间。
1.2.4.4 高级醇标准曲线的绘制与加标回收率
取配制好不同梯度的混合标准溶液1 μL过0.22 μm的无机水系滤膜进行气相色谱分析,以各物质峰面积与乙酸正丁酯峰面积比值为纵坐标,高级醇标准品质量浓度为横坐标绘制标准曲线,加标回收率参考文献[16-17]。
1.2.4.5 样品的分析
将待测样品过0.22 μm无机水系滤膜并加入乙酸正丁酯,使乙酸正丁酯质量浓度为80 mg/L,取1 μL进行气相色谱分析,根据高级醇与乙酸丁酯的峰面积比值计算高级醇的含量。
1.2.5 氨基酸的测定
无花果汁及酒中氨基酸的测定,委托山东青岛科创质量检测有限公司进行检测。
1.2.6 实验数理统计分析
采用IBM SPSS Statistics 20软件,对本实验测得的定量数据进行统计分析;采用OriginLab OriginPro 8.5软件作图。
2 结果与分析
2.1 不同酵母发酵无花果酒的理化指标分析
对陈酿60 d无花果酒进行理化指标测定,结果见表1。
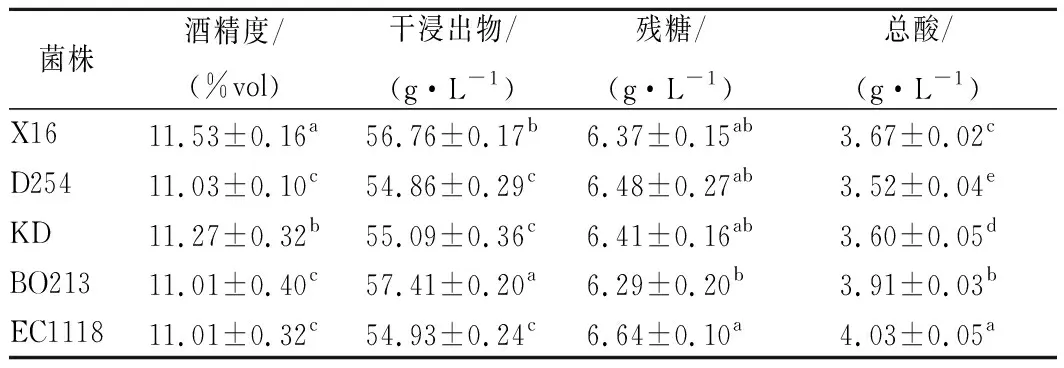
表1 5株酵母酿造无花果酒的理化指标Table 1 Physicochemical indexes of fig wine fermented by5 yeast strains
注:同一列数字右上角小写字母表示在p<0.05水平差异显著,不同字母表示不同处理之间差异显著,具有相同字母表示不同处理之间差异不显著。
由表1可以看出,5株菌株发酵的无花果酒酒精度均大于11.00%vol,其中菌株X16发酵的无花果酒酒精度为11.53%vol,显著高于其他菌株(p<0.05)。所有菌株发酵的无花果酒干浸出物含量均大于53.00 g/L,菌株BO213发酵的酒中干浸出物的含量(57.41 g/L)显著高于其他菌株(p<0.05)。5株菌株发酵的无花果酒中残糖含量较低均小于6.80 g/L,说明各菌株在本实验条件下发酵彻底。各菌株发酵无花果酒总酸含量均存在显著差异(p<0.05),所有酒的总酸含量均小于4.10 g/L,菌株D254发酵的酒总酸含量显著低于其他菌株,含量为3.52 g/L。
2.2 无花果酒中高级醇的测定
2.2.1 色谱条件下不同高级醇的分离
按照1.2.4.1的色谱条件,无花果酒中的高级醇能够得到较好的分离,各高级醇的色谱峰与标准品出峰时间一致,并且样品中各高级醇的峰未见干扰。结果见图1、图2。
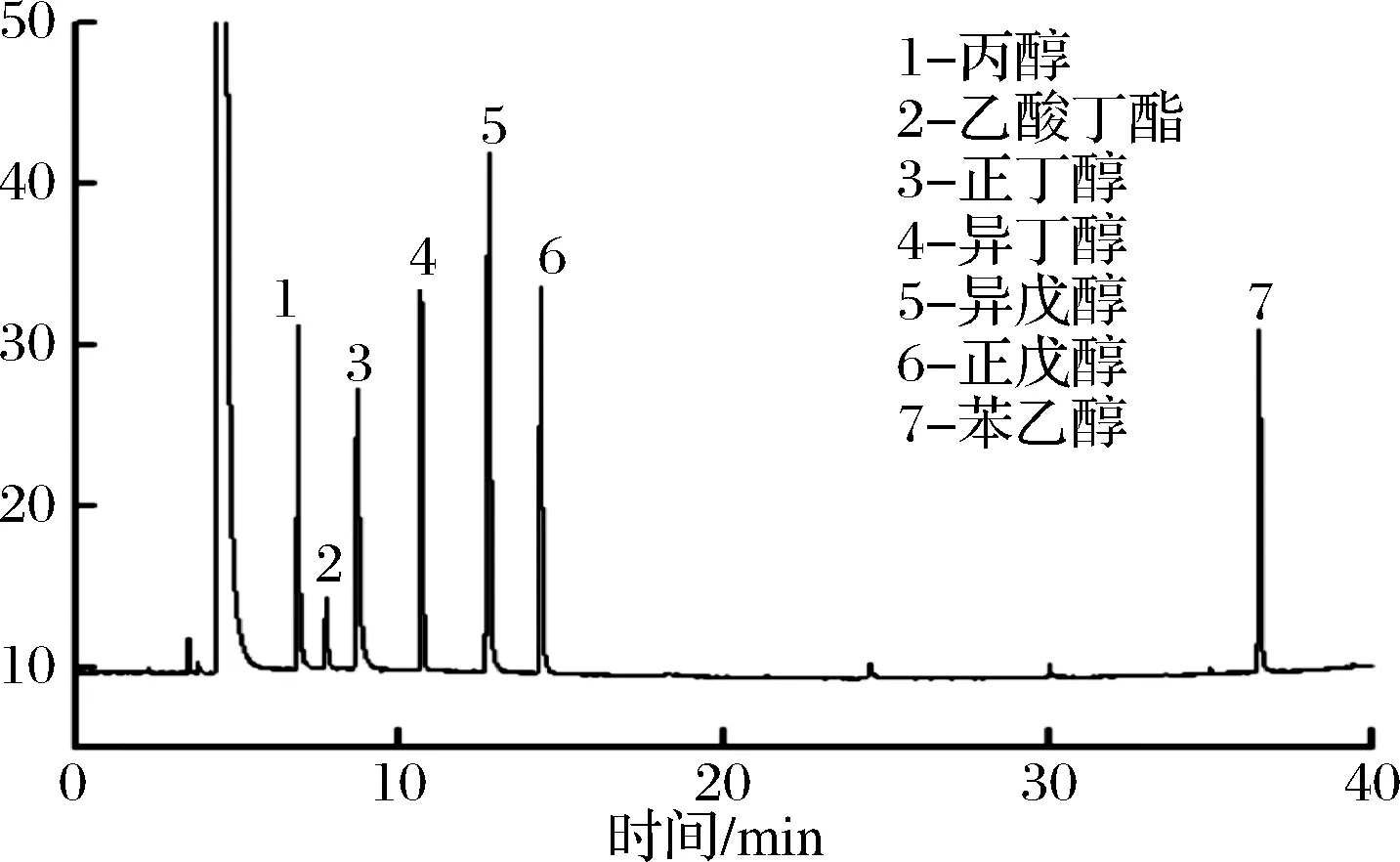
图1 高级醇混合标品色谱图Fig.1 The gas chromatogram of calibration higher alcoholsmixtur
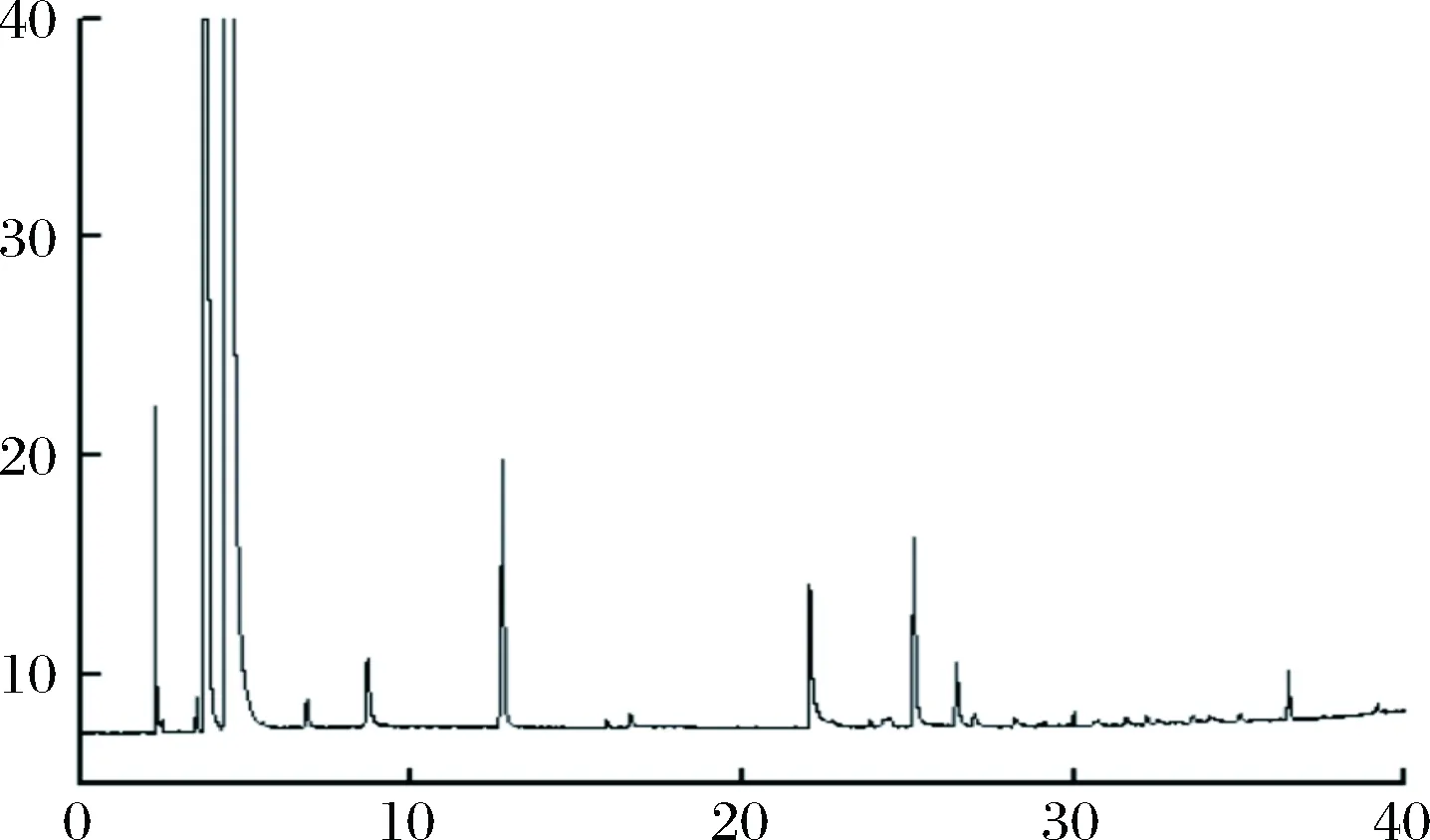
图2 菌株KD发酵的无花果酒中高级醇色谱图Fig.2 The gas chromatogram of calibration higher alcohols of the fig wine fermented by bacterial strain KD
2.2.2 高级醇标品线性关系、回收率测定
按照1.2.4.1的色谱条件,不同浓度的高级醇标准品的质量浓度与峰面积和具有良好的线性关系,加标回收率均高于90.00%,结果见表2。

表2 高级醇标准曲线Table 2 Standard curve of higher alcohols
2.2.3 无花果酒中高级醇含量
不同无花果酒中高级醇含量检测见表3。由表3可知,本实验选用5株酵母发酵的酒中主要高级醇含量为异戊醇,不同酵母发酵的无花果酒,高级醇含量存在差异,但高级醇的总量均小于350.00 mg/L,菌株EC1118与KD、D254与X16发酵的酒中高级醇含量存在显著差异(p<0.05),菌株BO213发酵的酒中高级醇存在含量显著低于其他菌株,为246.60 mg/L(p<0.05)。游玲等[8]报道,正丙醇、正丁醇及正戊醇是由不同酵母代谢产生的,在本实验条件下5株菌株发酵的酒中均未检测出正丁醇和正戊醇。菌株EC1118发酵酒中正丙醇含量显著高于其他菌株,为70.99 mg/L;而菌株BO213和X16发酵的酒中正丙醇含量显著低于其他菌株(p<0.05),含量分别为27.99、27.53 mg/L。菌株X16发酵的酒中异丁醇含量显著高于其他菌株(p<0.05),为64.84 mg/L。所有菌株发酵酒中高级醇含量均大于145.00 mg/L,5株菌株发酵的酒中苯乙醇含量均小于40.00 mg/L,菌株KD苯乙醇含量显著高于其他菌株(p<0.05)为39.86 mg/L。
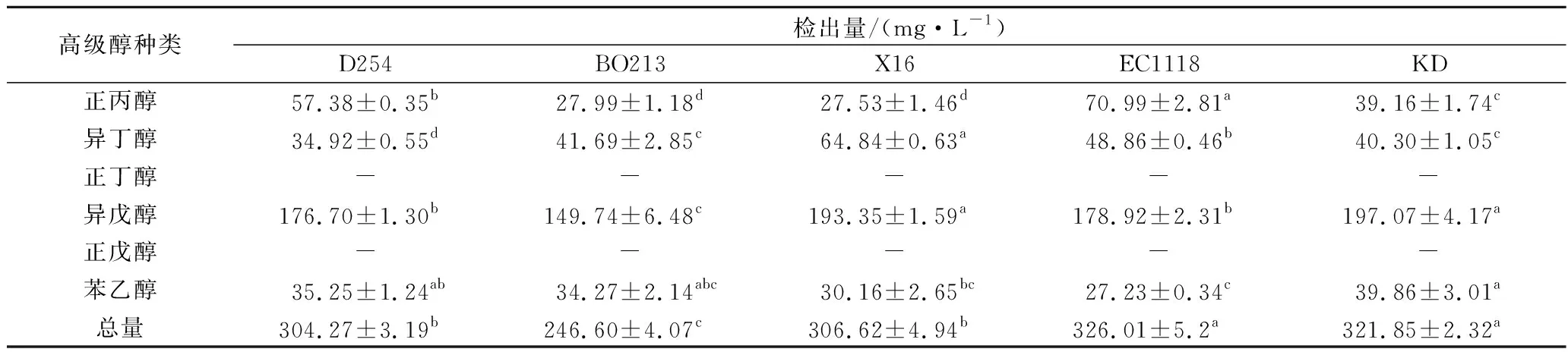
表3 不同无花果酒高级醇含量Table 3 Higher alcohol conten of Advanced alcohol content of different fig wine
注:同一行数字右上角小写字母表示在p<0.05水平差异显著,不同字母表示不同处理之间差异显著,具有相同字母表示不同处理之间差异不显著。
2.3 无花果酒中氨基酸含量的测定
5种无花果酒中氨基酸含量测定结果见表4。

表4 无花果酒中氨基酸含量测定 单位: mg/L
注:同一行数字右上角小写字母表示在p<0.05水平差异显著,不同字母表示不同处理之间差异显著,具有相同字母表示不同处理之间差异不显著。
由表4可知,本实验条件下测定无花果中17种游离氨基酸总量为739.52 mg/L,5株菌株发酵无花果酒游离氨基酸总量均下降且存在显著差异(p<0.05),说明酵母菌在发酵过程中代谢消耗氨基酸,例如酵母在发酵过程中代谢氨基酸产生高级醇[18],菌株X16发酵无花果果酒总游离氨基酸含量保留率最高与本实验其他菌株存在显著差异(p<0.05),含量为465.72 mg/L,总游离氨基酸保留率(无花果果酒游离氨基酸含量/无花果果汁中游离氨基酸含量)为62.97%;菌株D254发酵酒中总游离氨基酸保留率较本实验其他菌株最低仅为26.84%;不同酵母发酵的无花果酒必需、非必需、甜味、苦味及酸味氨基酸总含量均显著下降(p<0.05);鲜味氨基酸总含量在发酵后均显著上升(p<0.05),主要因为不同菌株发酵的无花果酒赖氨酸、谷氨酸含量较发酵前显著上升(p<0.05),这2种氨基酸为鲜味氨基酸[19]。总氨基酸含量依次为:无花果汁>X16>BO213>EC1118>KD>D254。必需氨基酸含量依次为:无花果汁>X16>EC1118>BO213>KD>D254。
本试验条件下测得无花果汁中主要的游离氨基酸为丝氨酸、脯氨酸、精氨酸含量分别为225.37、194.87、77.97 mg/L,这3种氨基酸占无花果汁游离氨基酸总量的67.37%;菌株D254发酵的无花果酒中主要的游离氨基酸为脯氨酸、精氨酸、胱氨酸、亮氨酸含量分别为74.92、27.99、12.54、11.63 mg/L,菌株BO213对应酒的主要氨基酸为丝氨酸、精氨酸、脯氨酸含量分别为55.18、38.75、124.99 mg/L,菌株X16发酵的酒主要氨基酸为丝氨酸、精氨酸、脯氨酸含量分别为102.00、61.44、131.37 mg/L,菌株EC1118发酵的酒中主要氨基酸为胱氨酸、精氨酸、脯氨酸、亮氨酸、赖氨酸含量分别为27.12、44.44、61.33、17.89、16.01 mg/L,菌株KD发酵的酒中主要氨基酸为胱氨酸、甘氨酸、精氨酸、脯氨酸,含量分别为14.51、13.27、23.00、129.86 mg/L。菌株D254、BO213、X16、EC1118、KD主要游离氨基酸占对应酒的总游离氨基酸分别为64.02%、65.63%、63.30%、61.62%、72.21%。
2.4 聚类分析
聚类分析已经被用于许多领域,有研究者对不同蜂蜜中的氨基酸进行聚类分析,将不同来源的蜂蜜进行了很好的分类[20-21]。本研究对测得无花果酒及汁的氨基酸含量进行聚类分析,可以将不同酵母发酵的无花果酒进行分类,聚类分析结果见图3,由图3可知,无花果汁和5株酵母发酵的无花果酒通过第1次聚类被聚为4类,无花果汁被聚为1类,菌株X16发酵的无花果酒被聚为1类,菌株KD和BO213发酵的酒归为一类,EC1118与菌株D254归为一类,第1次聚类将5株酵母发酵的酒聚为3类,可以看出不同酵母菌发酵无花果酒通过不同代谢途径对无花果酒中氨基酸含量的影响是不同的。
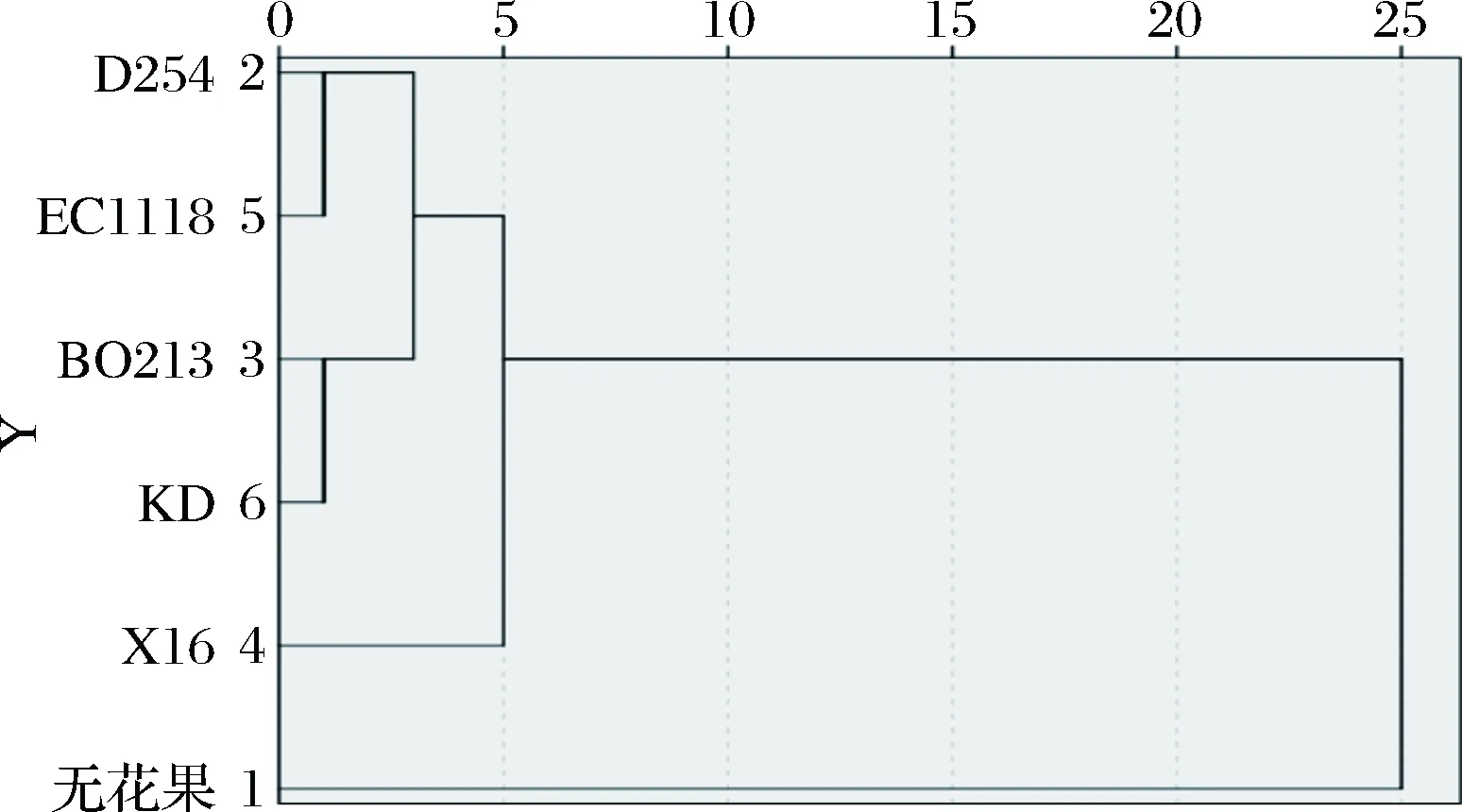
图3 无花果酒及汁的聚类分析树状图Fig.3 Cluster analysis of fig wine and fig juice
3 结论与讨论
通过研究5株商业酵母发酵无花果酒,对不同酵母发酵的无花果酒的高级醇、氨基酸进行了比较,筛选出最优酿酒酵母,实验结果表明:在本实验条件下5株菌发酵的酒中高级醇总量均小于350.00 mg/L,魏云平[16]以高级醇指标筛选出了酿制猕猴桃酒的野生酵母SYS2000,高级醇总量为(丙醇+异丁醇+异戊醇)268.8 mg/L,本研究中丙醇+异丁醇+异戊醇含量依次为EC1118(298.77 mg/L)>X16(285.72 mg/L)>KD(276.53 mg/L)>D254(269.00 mg/L)>BO213(219.42 mg/L),差异不大。各酒样中高级醇总含量依次为:EC1118>KD>X16>D254>BO213。有研究表明,高级醇对葡萄酒香气有重要的影响,适量(总量<300.00 mg/L)的高级醇可增加葡萄酒香气的复杂性,含量过高(总量>400.00 mg/L)则会使酒的香气粗糙[22-24],本试验所有样品高级醇总量在246.60~326.01 mg/L,低于400.00 mg/L。因此,对高级醇总量进行分析,菌株X16、D254、BO213均能用于无花果酒生产。
该试验条件下采用5株酵母将无花果汁发酵成无花果酒,游离氨基酸总量均下降,各菌株游离氨基酸总量存在显著差异(p<0.05),样品中氨基酸总量依次为:无花果汁>X16>BO213>EC1118>KD>D254,菌株X16发酵的无花果酒中氨基酸总量(465.72 mg/L)显著高于其他菌株(p<0.05)。沈颖等[25]研究荔枝酒在酿造过程中氨基酸含量的变化,发现荔枝酒中主体氨基酸较发酵前含量下降,与该研究结果相一致。氨基酸的下降,是酵母的代谢结果。高年发等[26]研究了葡萄酒酿造过程氨基酸的变化,发现葡萄酒较发酵前天冬氨酸、缬氨酸、组氨酸、异亮氨酸、亮氨酸、苯丙氨酸、丝氨酸、精氨酸和苏氨酸含量降低。本试验检测到苏氨酸、缬氨酸、亮氨酸、苯丙氨酸、甘氨酸含量与发酵前相比显著下降(p<0.05),与前人研究结果一致。
无花果酒中含有丰富的氨基酸,为酵母发酵的过程中提供了丰富的氮源,也提供了酵母产生高级醇的前体物质,王亚钦等[24]报道一些氨基酸可参与高级醇的代谢。张光亚等[27]报道正丙醇、异丁醇、异戊醇、苯甲醇的前体物质分别为苏氨酸、缬氨酸、亮氨酸、苯丙氨酸。张文叶等[28]研究发现甘氨酸是异戊醇的前体物质。然而,本试验条件下发酵的无花果酒中高级醇的含量并不是很高,均小于350.00 mg/L,有趣的是菌株BO213高级醇含量最低,但氨基酸含量不是最高,X16氨基酸含量最高,但高级醇不是最低,说明在本实验条件下氨基酸与高级醇的形成相关性不高。曾朝珍等[29]报道高级醇的形成主要由氨基酸降解代谢路径(ehrlich代谢机制)和糖合成代谢路径(harris代谢机制)。魏云平[16]以筛选的野生酵母SYS2000为对象,研究还原糖和氨基酸对高级醇的影响,发现高级醇与还原糖的代谢远高于相应氨基酸系数。因此,推测本试验条件下酵母发酵无花果酒中高级醇与糖合成代谢路径有较高的相关性。聚类分析将X16单独聚为一类,说明X16发酵的无花果酒中氨基酸含量明显区别于其他菌株。通过对无花果酒中氨基酸、高级醇的聚类分析,可得出菌株X16较本试验其他菌株更适合无花果酒的生产。
本实验建立了测定无花果酒中高级醇含量的准确方法,无花果酒中高级醇得到良好的分离,对5株酿酒酵母发酵无花果酒的高级醇及氨基酸进行了比较,筛选出较优的酵母,为工业无花果酒的生产提供了理论基础。
