甲状腺乳头状癌BRAFV600E及TERT启动子突变的预后意义
2018-12-15罗春华申九妹郑启忠
罗春华 林 云 贺 峥 申九妹 王 静 郑启忠
(北京中医药大学厦门医院病理科,福建 厦门 361009)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最常见的内分泌系统恶性肿瘤,占甲状腺恶性肿瘤的80%~85%[1]。PTC是一个具有很高治愈率和良好预后的恶性肿瘤,其10年疾病总生存率超过90.0%[2],但近年来其发病率逐年上升,难治性甲状腺癌的患者数量亦逐渐增多,甚至部分患者死于转移和复发[3-9]。因此,研究预测PTC转移及预后的分子标志物是PTC研究的重要课题。本研究采用荧光PCR法检测PTC组织中BRAF V600E 和TERT 启动子的突变情况,分析其与PTC 患者临床病理特征之间的关系,进一步明确BRAF V600E 和TERT 启动子突变对PTC 患者预后评估的临床意义。
1 材料与方法
1.1 患者和组织样本:选取2015年1月至2017年12月在北京中医药大学附属厦门医院及厦门市第三人民医院外科手术切除的248例10%中性福尔马林固定石蜡包埋的PTC标本,所有标本均按照样本伦理道德规范及匿名处理。
1.2 主要设备与试剂:主要设备包括StepOne实时荧光定量PCR系统(美国Applied-Biosystems公司),OD-2000TM超微量分光光度计(美国Thermo Scientific公司)。主要试剂包括石蜡切片样品DNA提取试剂盒(型号:FFPE DNA,Cat NO.ADx-FF01)、人BRAF基因V600E突变检测(荧光PCR法)试剂盒(货号:ADx-BR01、ADx-BR02)以及人TERT基因启动子突变检测(PCR-荧光探针法)试剂盒(货号:RPQ008)。
1.3 样品DNA提取及质检:按石蜡切片样本DNA提取试剂盒(ADx-FF01)说明进行样品DNA提取,在OD-2000TM超微量分光光度计上检测所提DNA的质量,并将DNA模板浓度标化至2.0 ng/μL。
1.4 荧光PCR法检测BRAF V600E突变:按人BRAF基因V600E突变检测试剂盒说明进行BRAF基因突变检测。每一PCR反应板均设阳性质控与阴性对照。结果判读:严格按试剂盒提供的判读标准确定标本BRAF V600E突变状态,满足以下3点可认为检测成功:①待测样本和阳性质控的内控信号升起;②阴性对照内控信号和外控信号均无升起;③阳性质控的外控信号Ct值<20。BRAFV600E突变结果判断:①待测样本外控信号的Ct值≥28,为BRAF V600E未突变;②待测样本Ct值<28则认为BRAF V600E突变。
1.5 荧光PCR法检测TERT启动子C228T及C250T突变:按人TERT基因启动子突变检测试剂盒说明进行TERT C228T及C250T突变检测。每一PCR反应板均设阳性质控与阴性对照。结果判读:以RPQ008TERT试剂盒提供的判读标准确定标本TERT启动子C228T及C250T突变状态,满足以下3点则认为检测成功:①待测样本和阳性质控的内控信号升起;②阴性对照内控信号和外控信号均无升起;③阳性质控的外控信号Ct值<14。TERT突变判定标准:①待测样本外控信号的Ct值>25为未突变;②待测样本Ct值<25则为有突变。
1.6 统计学分析:应用SPSS19统计软件对实验结果进行统计学分析,计数资料的两两比较用χ2分析,P<0.05被认为有统计学意义。
2 结 果
2.1 荧光PCR法检测BRAF V600E突变及TERT启动子突变的质量控制:本实验结果显示所有样本均能有效提取和纯化DNA,A260/A280均在1.8~2.0,且A260/A230>2.0,符合荧光PCR法的质量标准。采用荧光PCR法检测BRAFV600E突变的结果显示:阳性质控的PCR扩增曲线均见升起、且外控信号Ct值<20,阴性对照无外控信号升起,所有待测样本的内控信号均见升起,提示检测成功(图1)。采用荧光PCR法检测TERTC280T及C250T突变的结果显示:阳性质控的PCR扩增曲线均见升起、且外控信号Ct值<14,阴性对照无外控信号升起,所有待测样本内控信号均见升起,提示检测成功(图2)。
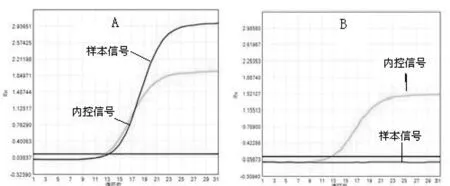
图1 荧光PCR法检测BRAF V600E突变。A:BRAF V600E突变阳性;B:BRAF V600E突变突变阴性

图2 荧光PCR法检测TERT启动子突变。A:TERT启动子突变阳性;B:TERT启动子突变阴性
2.2 BRAF V 600E 突变与PTC患者临床病理特征的关系:本组病例中甲状腺乳头状癌BRAF V600E 基因突变率为78.6%(195/248)。BRAF V600E突变与PTC患者性别(χ2=0.968,P=0.325)、年龄(χ2=1.538,P=0.215)、肿瘤大小(χ2=0.163,P=0.686)、肿瘤单侧或双侧累及(χ2=0.997,P=0.318)、肿瘤侵犯至甲状腺被膜外或局限在甲状腺内(χ2=0.597,P=0.44)以及淋巴结转移(χ2=1.78,P=0.186)等临床病理特征均无关(P值均>0.05,表1),提示BRAF V600E与PTC患者预后无关。
2.3 TERT 启动子突变与PTC患者临床病理特征的关系:本组病例中PTC 患者TERT 启动子突变率为7.66%(19/248),其中TERT C228T 位点突变率为6.85%(17/248),TERT C250T 位点突变率为0.81%(2/248)。TERT启动子突变与PTC患者性别(χ2=0.171,P=0.679)及肿瘤单侧或双侧累及(χ2=0.476,P=0.49)无关(P值均>0.05,表1);与患者年龄(χ2=5.635,P=0.018)、肿瘤大小(χ2=5.001,P=0.025)、肿瘤侵犯至甲状腺被膜外或局限在甲状腺内(χ2=131.92,P=0.000)以及淋巴结转移(χ2=5.457,P=0.019)等临床病理特征均有关(P值均<0.05,表1),提示TERT启动子突变与PTC患者预后相关。
2.4 仅BRAF突变或仅TERT 突变或二者同时突变与PTC患者临床病理特征的关系:PTC 患者BRAF V600E突变195例,TERT 启动子突变19例,其中10例同时伴有BRAF V600E突变及TERT启动子突变。仅BRAF V600E突变组与PTC患者临床病理特征无关(P值均>0.05,表2);仅TERT突变组与PTC患者性别及是否双侧侵犯无关(P值均>0.05,表2),与患者年龄、肿瘤大小、腺外侵犯及淋巴结转移有关(P值均<0.05,表2);BRAF 和TERT 同时突变亦表现出与PTC 患者年龄、肿瘤大小、腺外侵犯及淋巴结转移有关(P值均<0.05,表2),而与性别、是否双侧累及均无关(P值均> 0.05,表2),提示TERT 启动子突变与PTC患者预后相关,是否同时发生BRAF V600E突变对患者预后影响无明显意义。
3 讨 论
PTC 是常见的甲状腺恶性肿瘤,其发生、发展是一个多基因参与的过程。因此,探寻PTC发生、发展的关键基因既有利于PTC的早期诊断与合理治疗,也有利于更好的理解常规治疗无效的原因。
目前研究表明,BRAF V600E基因突变是PTC经典DNA相关标志物,广泛参与PTC的发生、发展过程。然而,BRAF V600E 突变是否对PTC 患者预后产生影响,多年来的研究仍未得出一致的观点。Virk等[10]认为BRAF V600E突变是区域淋巴结转移的独立预测因素;Lang等[11]的研究提示,BRAFV600E突变与肿瘤大小、肿瘤腺外侵犯、淋巴结转移相关。但是,近年来的研究认为BRAF V600E突变与PTC生物学行为并无明显关系,Pelttari等[12]的研究结果显示BRAF V600E突变与性别、年龄、肿瘤大小、腺外侵犯和区域淋巴结转移均无显著相关性。本研究结果中甲状腺乳头状癌BRAF V600E 基因突变与PTC患者性别、年龄、肿瘤大小、肿瘤单侧或双侧累及、肿瘤侵犯至甲状腺被膜外或局限在甲状腺内以及淋巴结转移等临床病理特征均无关,提示BRAF V600E与PTC患者预后无关。
有研究报道,TERT(telomerase reverse transcriptase)启动子C228T和C250T突变与PTC的不良预后相关[13]。和他们的研究结果相一致,本研究也发现TERT启动子突变的患者临床病理表现较差,这些患者往往年龄大、肿块大、包膜侵犯和腺外侵犯比例高以及淋巴结出现转移。而在Melo 等[14]作者的研究中发现没有发现TERT启动子突变和颈部淋巴结转移存在相关性,为什么Melo等作者的研究结果跟其他人的研究结果不一样,具体原因目前还不清楚,一种可能是Melo等作者研究的TERT启动子突变的样本量较小,尚不足以得出统计学差异有关。在本研究中,仅BRAF V600E突变组与PTC患者临床病理特征无关(P值均>0.05);仅TERT突变组与患者年龄、肿瘤大小、腺外侵犯及淋巴结转移有关(P值均<0.05);BRAF 和TERT 同时突变亦表现出与PTC 患者年龄、肿瘤大小、腺外侵犯及淋巴结转移有关(P值均<0.05),提示TERT 启动子突变与PTC患者预后相关,是否同时发生BRAF V600E突变对患者预后影响无明显意义,提示两个基因突变未产生协同作用,是否因样本量不够大的原因还有待进一步证实。
本研究采用荧光PCR法检测PTC患者BRAF V600E及TERT启动子突变情况,分析两基因突变与患者临床病理特征的关系,评估两基因突变对患者预后的影响,研究结果发现BRAF V600E突变与患者预后无明显关系,TERT启动子突变与患者预后明显相关,这一结果提示BRAF V600E突变更可能是PTC发生的早期事件,对PTC的早期诊断有良好的应用前景,TERT启动子突变可能是PTC发生的晚期事件,对PTC的预后判断更有价值,而两基因突变是否有协同作用有待进一步研究。
表1 BRAF V600E或TERT启动子突变与PTC临床病理特征的关系
特征 BRAFV600E χ2P TERT启动子 χ2P突变型(n=195) 野生型(n=53) 突变型(n=19) 野生型(n=229)性别 0.968 0.325 0.171 0.679男46 16 4 58女149 37 15 171年龄(岁) 1.538 0.215 5.635 0.018<45 88 29 4 113≥45 107 24 15 116肿瘤大小(cm) 0.163 0.686 5.001 0.025<1.0 108 31 6 133≥1.0 87 22 13 96双侧累及 0.997 0.318 0.476 0.490否114 35 10 139是81 18 9 90腺外侵犯 0.597 0.440 131.90 0.000否160 41 3 198是35 12 16 12淋巴结转移 0.063 0.802 5.457 0.019否81 21 3 99是114 32 16 130
表2 仅BRAF或仅TERT或BRAF与TERT同时突变与PTC患者临床病理特征的关系
注:P:仅BRAF突变型vs二者都没突变型;P*:仅TERT突变型vs二者都没突变型;P**:二者同时突变型vs二者都没突变型
特征 二者都没突变型(n=44) 仅BRAF突变型(n=185) P 仅TERT突变型(n=9) P* 二者同时突变型(n=10) P**性别 0.137 0.487 0.386男15 43 2 2女29 142 7 8年龄(岁) 0.100 0.006 0.003<45 27 88 1 1≥45 17 97 8 9肿瘤大小(cm) 0.100 0.002 0.005<1.0 30 106 1 2≥1.0 14 79 8 8双侧累及 0.699 0.585 0.444否25 111 6 7是19 74 3 3腺外侵犯 0.111 0.000 0.000否41 155 2 3是3 30 7 7淋巴结转移 0.346 0.032 0.021否22 78 1 1是22 107 8 9
[4] Chen D,Qi W,Zhang P,et al.Investigation of BRAF V600E detection approaches in papillary thyroid carcinoma[J].Pathol Res Pract,2018,214(2):303-307.
[5] Yarchoan M,LiVolsi VA,Brose MS,et al.BRAF mutation and thyroid cancer recurrence[J].J Clin Oncol ,2015,33(1):7-8.
[6] Kim TH,Ki CS,Kim HS,et al.Refining Dynamic Risk Stratification and Prognostic Groups for Differentiated Thyroid Cancer With TERT Promoter Mutations[J].J Clin Endocrinol Metab,2017,102(5):1757-1764.
[7] Vuong HG,Altibi AMA,Duong UNP,et al.Prognostic implication of BRAF and TERT promoter mutation combination in papillary thyroid carcinoma-A meta-analysis[J].Clin Endocrinol(Oxf),2017,87(5):411-417.
[8] Melo M,Gaspar da Rocha A,Batista R,et al.TERT,BRAF,and NRAS in Primary Thyroid Cancer and Metastatic Disease[J].J Clin Endocrinol Metab,2017,102(6):1898-1907.
[9] Nasirden A,Saito T,Fukumura Y,et al.In Japanese patients with papillary thyroid carcinoma,TERT promoter mutation is associated with poor prognosis,in contrast to BRAF V600E mutation[J].Virchows Arch,2016,469(6):687-696.
[10] Virk RK,Van Dyke AL,Finkelstein A,et al.BRAF V600E mutation in papillary thyroid microcarcinoma:a genotypephenotype correlation[J].Mod Pathol,2013,26(1):62-70.
[11] Lang BH,Chai YJ,Cowling BJ,et al.Is BRAF V600E mutation a marker for central nodal metastasis in small papillary thyroid carcinoma?[J].Endocr Relat Cancer,2014,21(2):285-295.
[12] Pelttari H,Schalin-Jantti C,Arola J,et al.BRAF V600E mutation does not predict recurrence after long-term follow-up in TNM stage Ⅰor Ⅱpapillary thyroid carcinoma patients[J].APMIS,2012,120(5):380-386.
[13] Vuong HG,Duong UN,Altibi AM,et al.A meta-analysis of prognostic roles of molecular markers in papillary thyroid carcinoma[J].Endocr Connect,2017,6(3):8-17.
[14] Melo M,da Rocha AG,Vinagre J,et a1.TERT promoter mutations are a major indicator of poor outcome in differentiated thyroid carcinomas[J].J C1in Endocrinol Metab,2014,99(5):754-765.
