胃腺癌突变型P53蛋白和PCNA的表达及对比研究
2014-08-25廖谦和纪竹青范丽丽
廖谦和,徐 丹,纪竹青,范丽丽
(沭阳人民医院 病理科,江苏 沭阳223600)
胃癌的发生是多因素、多途径和多阶段的,与抑癌基因的失活、癌基因的激活以及细胞增殖与凋亡失衡等有关,而细胞增殖活性及某些癌基因突变与胃癌的关系尤为密切。本研究应用免疫组化法检测胃腺癌组织中突变型P53蛋白和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达情况,以探讨其在胃癌发生发展中的作用。
1 材料与方法
1.1材料收集我院2008年1月至2012年12月经外科手术切除的胃腺癌标本42例,所有患者术前均未接受过化疗或放疗,术后手术标本经病理确诊。患者中男31例,女11例,年龄39-81岁,平均65.6岁。TNM分期:胃癌Ⅰ期6例,Ⅱ期14例,Ⅲ期18例,Ⅳ期4例。胃腺癌病理组织学分级:高分化腺癌6例,中分化腺癌22例,低分化腺癌14例。伴有淋巴结转移29例,无淋巴结转移13例。
1.2方法每例胃癌标本取组织2-3块,包括胃癌病变组织的胃壁黏膜、肌层及浆膜。标本经10%中性福尔马林固定,常规石蜡切片,HE染色。免疫组织化学采用EnVision法,标记以正常胃黏膜组织10例作对照。所用试剂购自基因科技(上海)有限公司,抗体为突变型P53蛋白(DO-7)、PCNA(PC10),一抗稀释浓度为1∶50。
1.3结果判定阳性细胞标记为棕黄色颗粒,突变型P53蛋白、PCNA阳性细胞定位在细胞核。每张切片随机选择10个高倍视野,根据切片中阳性细胞所占同类细胞总数百分比和阳性标记细胞着色强度的差异,分别记为-、+、++、+++四个等级,即不着色为阴性(-),0-25%为(+),25%-50%为(++),>50%为(+++)。
1.4统计学处理用SPSS13.0统计软件处理,采用χ2检验,相关性分析采用Spearman等级相关检验,P<0.05为差异具有统计学意义。
2 结果
2.1 突变型P53蛋白阳性表达 突变型P53蛋白在胃腺癌组织中的阳性细胞表达在胃腺癌的细胞核,呈棕黄色颗粒状(图1),P53阳性细胞表达率为81.0%,P53表达与胃腺癌分化程度,淋巴结转移有显著性意义(P<0.05),而与患者年龄、性别、胃腺癌浸润深度之间无显著性意义(P>0.05),见表1。
2.2 PCNA阳性表达 PCNA在胃腺癌组织中的阳性细胞表达在胃腺癌的细胞核,呈棕黄色颗粒状(图2),PCNA阳性细胞表达率为85.7%。PCNA表达与胃腺癌分化程度,淋巴结转移有显著性意义(P<0.05),而与患者年龄、性别、胃腺癌浸润深度之间无显著性意义(P>0.05),见表1。
2.3 突变型P53蛋白、PCNA与胃腺癌分化程度的关系 42例胃腺癌阳性率随病理分级增加阳性率有上升趋势, 突变型P53蛋白在高、中、低分化组的胃腺癌中阳性率分别为50.0%(3/6)、81.8%(18/22)和92.9%(13/14),低分化组显著高于高分化组(P<0.05)。PCNA在高、中、低分化组的胃腺癌中阳性率分别为50.0%(3/6)、86.4%(19/22)和100.0%(14/14),低分化组显著高于高分化组(P<0.05)。中、低分化腺癌中P53和PCNA阳性表达强度多在“++”以上。正常胃黏膜组织中突变型P53蛋白不表达,正常胃黏膜中PCNA不表达或仅见于基底层的单个细胞表达。突变型P53蛋白、PCNA在胃腺癌组与正常胃黏膜两组间的差异具有显著性(P<0.05)。
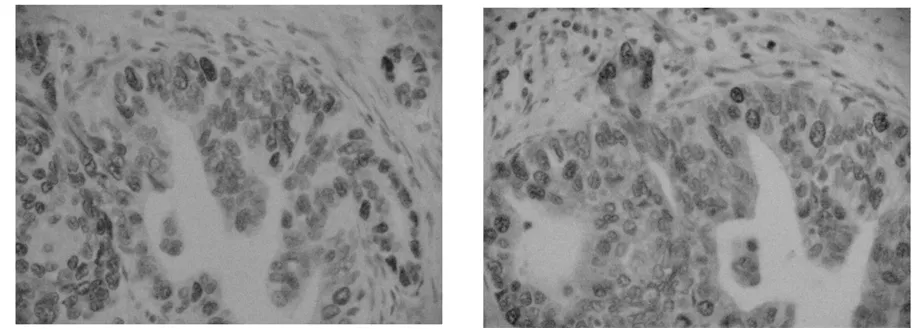
图1突变型P53蛋白在胃腺癌细胞核中的阳性表达(LSAB×400)图2PCNA在胃腺癌细胞核中的阳性表达(LSAB×400)
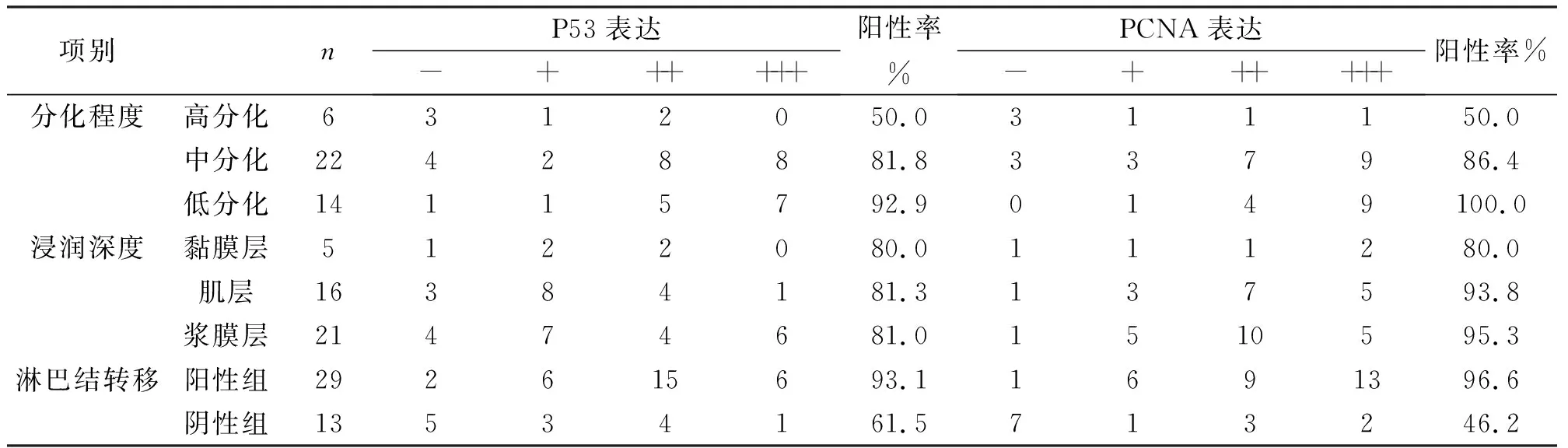
表1 突变型P53蛋白、PCNA在胃腺癌组织中的阳性表达(n=42)
2.4突变型P53蛋白、PCNA与胃腺癌淋巴结转移的关系有淋巴结转移组29例中,突变型P53蛋白检测阳性率为93.1%,阳性强度多在++以上,PCNA检测阳性率为96,6%,阳性强度亦在++~+++以上。突变型P53蛋白、PCNA在有淋巴结转移组与无淋巴结转移两组间的差异具有显著性(P<0.05)。
2.5突变型P53蛋白和PCNA在胃腺癌组织中表达的相关性突变型P53蛋白和PCNA在胃腺癌组织中均有较高的表达,42例胃腺癌中突变型P53蛋白表达阳性占33例(78.6%),PCNA表达阳性占37例(88.1%),两指标的阳性表达多在“++”以上,经等级相关性分析突变型P53蛋白和PCNA呈显著正相关(P<0.01)。
3 讨论
人类P53基因定位于17p13.1,是一个非常重要的抑癌基因,全长16-20 kb,基因组有11个外显子,10个内含子。P53分野生型和突变型,野生型P53因半衰期短,含量低,用免疫组化方法检测不到,而突变型P53蛋白降解缓慢,积聚在核内易于被检测。野生型P53具有抑制癌细胞的增殖和促进癌细胞凋亡的作用,而突变型P53蛋白通常不再能控制细胞增殖,这就导致无效的DNA修复和遗传不稳定。大多数突变型P53通过阻止野生型P53结合到靶基因启动子而施加明显的负面效应,因此突变型P53参与肿瘤的恶性转化[1]。本组研究结果显示,胃腺癌组织中突变型p53蛋白的表达与胃癌的分化程度、淋巴结转移有关,各组间差异显著(P<0.05),与文献研究结果相符[2]。突变型P53蛋白过度表达与侵袭性增加和预后不良相关,与肿瘤细胞的高度增生及分化程度有关,分化越低的肿瘤,突变型P53蛋白的表达水平越高,具有重要的预后价值[3]。本组研究结果提示突变型p53蛋白在胃癌发生发展中有重要作用,突变型P53蛋白在胃腺癌组织中的过度表达反映了其对癌细胞的抑制作用丧失或减弱,并失去对癌细胞增殖的负调节作用,使癌细胞不断增殖而促进癌细胞转移。
PCNA又称周期抗原,是一种与细胞周期相关的酸性核蛋白,分子量为36 000,其表达在细胞增殖周期Gl后期开始升高,Gi/S期时达高峰,S期持续高水平,能与DNA多聚酶辅助蛋白结合,参与细胞DNA的复制,是反映细胞增殖活性的一个良好指标[4]。其在细胞增殖中发挥重要作用,因此PCNA的表达可反映局部细胞的增生状态[5]。PCNA在癌细胞中高表达反映肿瘤细胞过度增殖,可促进肿瘤的发生。有研究报道PCNA可在多种肿瘤组织中高表达[6]。本组研究结果显示,胃腺癌组织中PCNA的表达与胃癌的分化程度、淋巴结转移有关,各组间差异显著(P<0.05),说明癌组织中细胞增殖活性明显增高,细胞增殖旺盛,分化差易转移,预后较差。与文献研究结果相符[7,8]。
本组资料中突变型P53蛋白、PCNA在胃腺癌组织中均有较高表达,提示这两个指标与胃癌发生发展存在密切相关性,其阳性表达在评估胃癌恶性程度、估计患者预后和指导临床治疗等方面有着重要的参考价值。
参考文献:
[1]Qian Y,Chen X.Senescence regulation by the p53 protein family[J].Methods Mol Biol,2013,965(1):37.
[2]李 慧,时 阳,孙 逊,等.胃腺癌组织中P53、Ki-67的表达及其临床意义[J].中国老年学杂志,2013,33(2):275.
[3]赵 旸,王继萍,张 强,等.乳腺癌的MRI表现与C-erbB-2、ER、PR、P53、ANG-2表达相关性的研究[J].中国实验诊断学,2013,17(2):389.
[4]Wang K,Shi Z,Zhang M,et al.Structure of PCNA from Drosophila melanogaster[J].Acta Crvstallogr Sect F Struct Biol Crvst Commun,2013,69(4):387.
[5]Pan M,Kelaman LM,Kelman Z.The archaeal PCNA proteins[J].Biochem Soc Trans,2011,39(1):20.
[6]Karamitopoulou E,Zlobec I,Tornillo L,et al.Differential cell cycle and proliferation marker expression in ductal pancreatic adenocarcinoma and pancreatic intraepithelial neoplasia(PanIN)[J].Pathology,2010,42(3):229.
[7]马 健.胃肿瘤中EGFR、C-erbB-2和PCNA的表达及其临床意义[J].中国实验诊断学,2011,15(12):2058.
[8]余朝亚.胃癌组织中nm23、PCNA的表达及临床意义[J].中国现代医生,2011,49(30):37.
