胰岛素/胰岛素样生长因子信号通路:“整合效应”治疗阿尔茨海默病潜在途径及人参的治疗特点及优势
2018-12-13吴宿慧李寒冰陈晓晖李根林
吴宿慧 李寒冰 陈晓晖 李根林
(河南中医药大学药学院,河南 郑州 450046)
阿尔茨海默病(AD)是一种起病隐匿的神经系统退行性疾病,是老年人最常见的痴呆类型,我国60岁以上人群中发病率为3%~5%,临床以记忆障碍、认知功能障碍及人格和行为改变等痴呆表现为特征,其发病机制复杂,病因尚不明确,虽有众多假说,但临床中尚缺乏治疗AD的特效药物。AD是一种代谢性疾病,与大脑内葡萄糖代谢异常有关〔1〕,衰老、肥胖、代谢综合征等都可能是导致AD的潜在因素〔2〕。AD全基因组关联研究表明AD神经弹性变化可能主要受非遗传效应的影响〔3〕间接证明了该观点。线粒体作为葡萄糖代谢的主要场所、胰岛素/胰岛素样生长因子(IGF)信号通路作为调控葡萄糖代谢的主要因素备受关注〔4〕。AD相关的胰岛素/IGF信号通路异常主要原因是胰岛素/IGF抵抗与缺失所致。因此,AD被认为是“脑部特异的2型糖尿病”,具有胰岛素抵抗(IR)及胰岛素缺失的双重特征〔5,6〕,被称为3型糖尿病(T3DM)〔7〕。若胰岛素/IGF信号通路障碍导致糖代谢异常会促使β淀粉样蛋白(Aβ)沉积,Aβ沉积导致线粒体功能失调,进一步使线粒体对淀粉样前体蛋白(APP)的降解减少,Aβ沉积增多,形成恶性循环,加速T3DM病情的发生发展〔8〕。因此,脑部能量代谢失调、胰岛素/IGF信号通路障碍及线粒体功能调节在AD与糖尿病之间的相关性研究中成为了必不可少的纽带。也成为中医药“整合效应〔9,10〕”治疗AD的潜在途径。本文将对胰岛素/IGF信号通路的研究进展及中医药的治疗理念与优势做一综述。
1 胰岛素/IGF信号通路是联系T2DM与AD的纽带
胰岛素/IGF信号通路是机体中调控葡萄糖代谢、脂肪酸氧化,维持能量平衡的重要途径〔11〕,在中枢,对大脑的结构与功能亦至关重要,可影响髓鞘的完整性、神经可塑性调节及神经细胞的生长发育,也参与机体的学习和记忆等。中枢的葡萄糖主要在外周生成,经葡萄糖转运蛋白(Gluts)介导跨过血脑屏障(BBB)转运至大脑发挥作用〔12〕。占体重2%的大脑消耗全身18%~30%的葡萄糖给几乎所有神经系统提供能量〔13〕。有研究表明,AD 患者脑内存在着糖与能量代谢障碍,并随疾病发展而进行性加重,与脑Gluts减少及IR有关,和T2DM具有共同病理学基础及特征〔14〕。二者又互为致病因素,互相影响。因此,胰岛素/IGF信号通路被认为是联系T2DM与AD的纽带〔15〕,在研究中被广泛认同。胰岛素/IGF受体胞内机制相似〔16〕,激活后的信号通路主要有3种:磷脂酰肌醇-3蛋白激酶(PI3K)、丝裂原激活蛋白激酶(MAPK)和磷酯酶(PL)C信号通路,其中PI3K/蛋白激酶(PK)B(Akt)级联途径是主要的信号转导通路,是促细胞存活信息转导的重要途径之一,主要成分为Akt/PKB和磷酸化的环磷酸腺苷反应元件结合蛋白(P-CREB),调控着mTORC1,糖原合酶激酶(GSK)-3及FoxO家族功能的活化〔17〕,使mTORC1介导的蛋白合成增加,神经元中mTORC1依赖的突触可塑性调节、自噬功能激活、折叠错误蛋白及受损细胞器的降解途径激活;同时GSK-3α受抑制,使APP降解为Aβ减少;GSK-3β受抑制,减少磷酸化tau蛋白的生成,共同防止神经细胞死亡及神经退行性疾病的发生〔16〕。
2 IR、Aβ与线粒体之间的恶性循环导致T2DM与AD的发生发展
胰岛素/IGF信号通路异常导致机体IR是T2DM与AD发生发展的共同因素之一。据此,AD被认为是一种“IR的脑状态”,亦被称为“T3DM”〔5~7〕。Aβ沉积作为T2DM与AD的共同病理基础之一与IR相互影响。生理情况下,胰岛素与Aβ是胰岛素降解酶(IDE)的底物,两者以竞争性的形式与IDE结合并存在负反馈调节:当胰岛素水平降低,IDE活性下降,Aβ降解减少;胰岛素水平升高,可与Aβ竞争结合IDE,Aβ降解亦减少〔17〕。IR发生时,一方面,高胰岛素血症可使脑内Aβ降解减少,另一方面,使胰岛素/IGF信号通路介导的GSK3α受抑制减弱,使APP降解产物Aβ生成增加,另外GSK3β受抑制减弱,使tau蛋白过度磷酸化,造成神经纤维缠结(NFTs)。皮摩尔浓度的Aβ激活PI3K与MAPK、增加海马内乙酰胆碱生成、激活N胆碱受体,是记忆的增强子,微摩尔浓度的Aβ则产生完全相反的功能〔18~20〕。故Aβ降解减少,生成增多,会导致记忆力丧失,形成AD。同时,Aβ的主要形式为Aβ40及Aβ42。与胰岛素受体竞争性结合,影响受体介导的级联反应,加剧IR〔21,22〕。线粒体作为糖、脂代谢的主要场所,除了基质内进行氧化磷酸化过程生成大量ATP给机体提供能量之外,也参与IR、细胞生存和死亡。每个线粒体具有5~10个自主遗传的线粒体基因拷贝〔23〕,与机体疾病产生关系密切。Aβ与线粒体之间存在交互作用。若环境、饮食、遗传等因素导致疾病使Aβ在大脑中集聚过多时,多余的Aβ与低密度脂蛋白受体相关蛋白(LRP)1结合流出BBB,被线粒体外膜类似物转移酶(Tommo40)转运至线粒体内〔8〕。线粒体功能失调导致APP生成增多,使Tommo40功能减弱,Aβ转运减少。神经细胞、星形胶质细胞和神经胶质细胞内质网中多余的Aβ就激活核因子(NF)κB,使线粒体DNA功能改变导致促炎症因子释放引起炎症〔24〕,进而导致复合物Ⅰ功能受到抑制,氧化态辅酶Ⅰ(NAD)+/还原态辅酶Ⅰ(NADH)比率降低,ATP生成减少,细胞色素C氧化酶活性下降,氧耗减少,葡萄糖利用降低〔25〕,细胞处于饥饿状态〔1〕。线粒体电子传递链功能改变会导致过多的氧自由基(ROS)及氮自由基(RNS)产生,造成氧化损伤加剧,使tau蛋白磷酸化程度增加及线粒体传递减弱〔26〕。最终导致线粒体片段化,功能丧失,形成恶性循环。而增强线粒体蛋白稳态可减少Aβ 毒性〔27〕,使线粒体成为防治AD的潜在靶点。见图1。

图1 Aβ与线粒体之间的交互作用〔8〕
3 Aβ-线粒体恶性循环假说的提出
为了更好地阐明胰岛素/IGF信号通路、Aβ与线粒体功能之间的关系,有学者提出了现代淀粉样蛋白级联假说即Aβ-线粒体恶性循环的观点。该假说在原有淀粉样蛋白级联假说的基础上进行了补充与修正,认为:Aβ形成的斑块沉积是机体生成的垃圾,不再是形成AD的元凶,而过多Aβ尤其是Aβ42则是关键因子,与PI3K/Akt通路和线粒体相互作用,形成网状交联。最终使Aβ生成进一步增多,造成机体记忆力减退、氧化损伤加剧、BBB损伤、NFTs及老年斑,同时tau蛋白磷酸化加剧,错误折叠增多,共同形成AD。另外机体炎症因子生成增多通过PI3K/Akt信号通路中下游因子核因子(NF)-κB的作用,造成IR,形成T2DM。反过来,IR加速AD与T2DM的形成。该假说的提出可能为理解AD提供了更好的病理学基础,并给全面认识Aβ的重要作用提供了一定的帮助〔8,22〕。见图2。
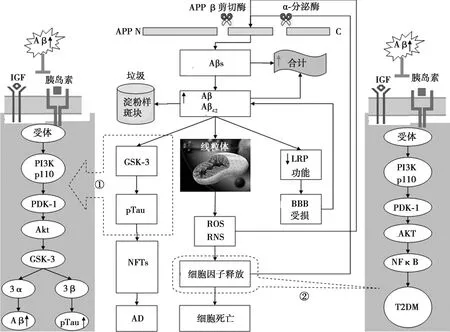
①Aβ生成增多后与PI3K/AKT信号通路的交互作用,GSK-3作为桥梁把T2DM与AD联系起来,箭头所指为虚线框内效应的全过程;②Aβ生成增多后造成线粒体氧化损伤加剧,细胞因子释放增多,通过PI3K/AKT信号通路中NFκB的效应,产生T2DM,箭头所指为虚线框内效应的全过程;PDK:3-磷酸肌醇依赖性蛋白激酶图2 胰岛素/IGF信号通路与Aβ-线粒体恶性循环假说的关系〔8,22〕
4 以胰岛素/IGF信号通路为靶点的药物研究现状
治疗AD的药物研究进展缓慢,且临床治疗效果欠佳,并不能很好控制病情发展。从T2DM与AD相关性研究中受到启发,最近从IR角度或以胰岛素/IGF信号通路为靶点治疗AD的动物实验及临床报道开始日益增多。降糖药的“老药新用”成为了竞相研究的热点。在研究中发现:双胍类通过AMPK使得β位点APP剪切酶1功能上调导致APP在其作用下的Aβ生成增加,而增加糖尿病患者发生AD的风险。噻唑烷二酮类(TZD)通过增加胰岛素敏感性,缓解IR,但罗格列酮潜在的严重副反应较多〔28〕,而吡格列酮是当前认为治疗AD的潜力药物〔29〕。有研究经鼻腔吸入胰岛素的方式治疗AD,可改善患者的注意力及陈述性记忆能力〔28〕,对轻度认知障碍(MCI)和早期AD有益,但制剂工艺有待完善且价格昂贵,且是否对中后期重度AD具有治疗作用仍需进一步的临床研究。
5 中医药对AD的认识及人参“整合效应”的治疗特点及优势
祖国医学认为脑为“髓之海”、“清窍之府”、“精明之府”、“元神之府”,与五脏功能密切,以心、肾、肝、脾为甚。若脏腑功能失调,脑功能也随之受损,或为精气血亏损,脑失所养,或为风、火、痰、瘀诸邪内阻,清窍受蒙,使机灵记性俱乏,遂致痴呆发生,属呆病、文痴、善忘、郁证、癫证等范畴,最早于《内经》有载,后在众多医学论著中具有记载,如《灵枢·海论》:髓海不足,脑转耳鸣、胫酸眩冒,目无所见,懈怠安卧。清·王清任《医林改错·脑髓说》:“灵机记忆,不在心在脑”,“高年无记忆者,脑髓渐空”。清·陈士铎在《辩证录》中有“呆病门”,认为“人之聪明,非生于心肾,而生于心肾之交也,夫心肾交而智慧生,心肾离而智慧失”;“痰积于肠中,盘踞于心外,使神明不清,而成痴呆矣”。结合现代医家对AD的认识,可归纳为①肾虚精不生髓,脑失所养。②气血亏虚,脑髓失养。③痰瘀阻滞,清窍失灵〔30〕。以火、痰、瘀为因,虚实为证,且相互影响,相兼为病。 针对病因复杂的AD,中药具有起效方式多样性,能通过多靶点、多方式、多途径作用于多种神经传递机制的优势,疗效颇显。经过高频次中药的频次频率统计、性味归经及类别分析显示〔31〕,常见的用于治疗AD的中药如人参、淫羊藿、薏苡仁、肉苁蓉、银杏叶、酸枣仁、墨旱莲、补骨脂、附子、山茱萸等,主要归脏以心、肾、肝、脾为主,其中补益药中补益肾脏的药物最多,验证了AD与五脏功能的密切关系及补益肾脏在治疗中的重要地位。中医中药的治疗理念中,“整合效应〔9,10〕”被认为是最大特色之一,如人参为五加科植物人参Panax ginseng C.A.Mey.的干燥根,具有补气、固脱、生津、益智、安神等功效,由于其广泛而悠久的应用历史及确切的临床疗效,被认为是补益类中药(甚至是整个中药)的典型代表药,故有“百草之王”的美称。人参除了功效显著的补益作用外,亦具有生津、安神、益智等多种功效,众多学者认为其生津作用主要体现在对糖尿病尤其是T2DM(消渴症)的治疗中,而安神、益智则表现在对失眠、记忆减退等如AD的确切疗效上,因此受到广泛关注,并成为研究的热点。人参及其主要活性成分具有降血糖、扩血管、改善记忆力、调节机体功能稳态等多方面的作用。人参及有关成分的药理作用与影响胰岛素/IGF信号通路、激活PI3K/Akt等有关〔32,33〕,可通过胰岛素/IGF信号通路调节机体血糖异常而对IR与T2DM有一定治疗作用,在对于AD的防治研究中,大多数的研究集中在人参皂苷单体中,如人参皂苷Rg1可增加APP代谢途径中α-分泌酶中ADAM9和ADAM10基因表达,增强APP的α-分泌酶代谢途径间接减少AD发生发展过程中的关键因子Aβ42的产生〔34~37〕,且可下调APP基因的表达,提高体内催化Aβ降解的关键酶即神经内肽酶(NEP)的表达,调节NEP酶活性,从而达到抑制Aβ增加的目的〔38〕。也可通过抑制PKA的活性降低大鼠脑片AD模型P-Tau的表达水平,从而减缓NFTs形成,还可通过抑制凋亡效应蛋白半胱氨酸天冬氨酸酶(caspase)-3的表达,从而抑制神经元凋亡发挥抗痴呆作用,减轻脑内Tau蛋白的异常过度磷酸化,减少NFTs的形成〔39~41〕。人参皂苷Rg1能通过抑制GSK-3β活性,降低Tau蛋白的磷酸化水平,减少痴呆模型动物Aβ25~35的增加而激活GSK-3β诱导的Tau蛋白异常磷酸化造成的神经元微管系统破坏〔40〕。此外,人参皂苷Rg1还可以通过多种途径和机制增加神经可塑性〔42〕:(1)提高突触效能和结构可塑性,显著降低诱发最大胞外群峰电位(PS)的阈值,提高突触传递效能,包括基础突触传递的增强,长时程增强(LTP)的诱导和高频电刺激引起的LTP幅度进一步增加,或者包括新突触的形成,苔藓纤维末梢发芽数增加,脑重和脑皮层厚度的增加等;清醒自由活动的大鼠停药3 d后,LTP仍可维持;同时齿状回颗粒细胞层及齿状回门区突触生长相关因子神经生长相关蛋白(GAP)-43表达显著增加。(2)中枢内乙酰胆碱含量和M-胆碱受体密度增加。(3)FOS蛋白和脑源性神经营养因子(BDNF)表达增加。(4)具有清除氧自由基、抗炎、调节端粒系统的作用〔43〕,还能通过调节c-Jun氨基末端激酶(JNK)信号通路,抑制Aβ1~42引起的细胞凋亡,发挥对神经元的保护作用〔44〕。也可以通过改变脑内主要神经递质乙酰胆碱、多巴胺、谷氨酸的量、MAPK信号通路的抑制作用及信号转导途径中的蛋白分子等,改善动物的学习记忆行为能力〔45〕。其他人参皂苷如Rg2对Aβ25~35致AD大鼠海马神经元结构及突触素表达具有保护作用〔46〕,Rg3能增强H2O2损伤海马神经元内超氧化物歧化酶(SOD)活性,降低丙二醛(MDA)水平,提高海马神经元细胞活性〔47〕,Rb1易透过BBB,能通过改善脑缺血、抑制神经元细胞凋亡、维持神经元微管结构的稳定、干扰Aβ形成和沉积等作用,又可作用于L型钙离子通道,可降低海马神经元内钙离子浓度,维持钙稳态抑制细胞凋亡的发生,有效改善智力、提高学习记忆功能〔48~50〕,Rd能减少Aβ25~35致AD大鼠海马内Tau蛋白的异常磷酸化〔51〕。
6 总结与展望
胰岛素/IGF-1信号通路代谢异常导致的IR及缺失可能在AD 疾病进程中加速了Aβ 产生而成为治疗AD 重要的潜在靶点〔52〕,虽然从目前的科学研究来看,至今尚无彻底治疗AD的药物,只是防治或者延缓病情的恶化,但相比西药通过单一靶点疗效有限的现状,中药具有多靶点、整合效应等优势,是当前防治AD药物开发中重点关注的对象。虽有众多丰富的实验研究报道,但也缺乏中医特色,无法体现中医独有的辨证论治思想精髓。如中药成分复杂,提取分离技术的不同导致成分的差异影响疗效的稳定性,还有中药在不合理用药时具有的潜在不良反应。网络药理学“整合效应”的出现,可结合中医辨证与辨病相结合的理论,将线粒体和突触作为早期治疗靶点〔27〕,运用现代科学技术,通过科学的研究方法,突出中医整体思维的特色,发挥中医药优势,将为防治老年痴呆药物的开发开创新的局面。
