低氧对内皮祖细胞迁移的影响
2018-12-13王虔
王 虔
(沈阳急救中心,辽宁 沈阳 110000)
内皮祖细胞(EPCs)是一类可以分化为成熟内皮细胞(ECs)的前体细胞,来源于骨髓、胎儿肝脏、脐带血等,存在于骨髓、外周血及肝脏中〔1〕。组织缺血可造成局部缺氧进而造成损伤,因此其修复需要改善局部血运。本实验观察低氧对内皮祖细胞的迁移影响,讨论其改善局部血运的可能。
1 材料与方法
1.1主要材料 SD大鼠(体重150~180 g)、胎牛血清、DMEM培养液、M199培养液、内皮生长因子(EGF)、血管内皮生长因子(VEGF)、碱性纤维细胞因子(bFGF)、Percoll淋巴细胞分离液(天津灏洋);anti-CD133/PE、anti-CD34/PE(BD公司);SABC免疫组织化学试剂盒 (武汉博士德)等。
1.2EPCs的分离诱导培养 取SD大鼠四肢长骨,剔除残余肌肉组织,直接用PBS冲出骨髓,将冲出的骨髓液收集在带刻度的离心管中,密度梯度离心法分离出单个核细胞(白色絮状物层),重悬在含有胎牛血清及VEGF、bFGF、凝集素表皮生长因子结构域的共同区域(LEGF)的M199 培养基中,并将含细胞培养液接种在预先包被人纤维连接蛋白(HFN)的培养瓶中,在37℃,5%CO2的恒温箱中培养。培养3 d后首次换液,留取贴壁细胞进行培养,以后每隔3~4 d换液1次。当细胞融合达到约80%时可传第1代,以后每8~10 d可传1代。
1.3EPCs的鉴定 ①通过观察细胞形态进行鉴定:在倒置相差显微镜下,观察细胞的生长情况及形态学变化,与内皮祖细胞形态特点进行对比并加以鉴定;②流式细胞检测:获取培养的第3代细胞,将其制成浓度为1×106/ml的细胞悬液,然后向细胞悬液分别加入10 μl FITC标记的CD34抗体、R-PE标记的VEGFR2抗体,避光孵育30 min。使用流式细胞仪分析EPCs表面特有的标志,细胞以同型的R-PE染色作为阴性对照。CD34(+)、CD133(+)、VEGFR-2(+)的细胞被认为符合EPCs特征。
1.4ELISA检测不同条件下 SDF-1 的表达情况:实验分组:A组(常氧组):21%O2,25%CO2,74%N2;B组(低氧6 h组):1%O2,5%CO2,94%N2;C组(低氧12 h组):1%O2,5%CO2,94%N2;D组(低氧24 h组):1%O2,5%CO2,94%N2;各组培养后取上清液,ELISA检测基质细胞衍生因子(SDF)-1浓度。
1.5免疫荧光检测SDF-1 的表达 分别取出以收集的常氧和低氧6、12、24 h 的细胞涂片,PBS 冲洗两次,染色步骤严格按荧光试剂盒说明书操作,以SDF-1 为一抗。染色结果SDF-1 为胞质和胞膜发绿色荧光(FITC)为阳性。
1.6Transwell检测低氧对EPCs迁移的影响 用含0.02%EDTA胰蛋白酶消化贴壁的EPCs并制成单细胞悬液。并将EPCs以1×105/ml浓度的重悬于含1%FBS的M199培养基中,小室下层分别加入600 μl A、B、C、D四组的细胞悬液,37℃、5%CO2培养箱中培养过夜。24 h后从培养箱中取出小室,棉签擦去小室上层膜的细胞,多聚甲醛固定,DAPI染色,通过计算染色数目可计算迁移细胞数量。在荧光显微镜下观察滤膜外侧面的染色细胞数量。100倍镜下随机8个视野进行计数,取平均值。
1.7统计学方法 采用 SPSS17.0 统计软件进行t检验。
2 结 果
2.1光镜下观察细胞的形态 EPCs通常于接种后2~3 d开始贴壁。接种后第4天,可见细胞团聚呈“集落”样;接种后2 w,可见细胞成“鹅卵石”样改变,见图1。
2.2流式细胞仪检测结果 CD34阳性率为(53.21±5.14)%,CD133阳性率为(50.33±6.08)%,VEGFR-2阳性率为(55.07±4.16)%。
2.3ELISA 检测不同条件下 SDF-1 的表达情况 A组EPCs培养液上清SDF-1浓度(203.6±5.3)ng/L,B组浓度为(392.7±3.4)ng/L,C组浓度(619±5.8)ng/L,D组浓度为(469.1±6.6)ng/L。与常氧对照组比较,低氧6、12、24 h 诱导 HIF-1α 的表达,6 h 表达开始增强,12 h 表达最强,24 h 又有所减弱(P<0.01);低氧12 h与低氧6、24 h差异明显比较(P<0.01)。
2.4免疫荧光检测SDF-1 的表达 与A组比较,低氧 6 h 表达开始增强,12 h 表达最强,24 h 又有所减弱。因SDF-1 为胞质和胞膜表达,FITC 为绿色荧光。见图2。
2.5Transwell检测低氧对EPCs迁移的影响 A组EPCs穿过滤膜数为(29.0±1.2)个,B组为(47.2±2.1)个,C组为(61.7±1.6)个,D组为(39±0.9)个。 A组分别与B组、C组、D组比较差异显著(P<0.05);C组与B组、D组比较差异显著(P<0.05)。见图3。

图1 EPCs形态学观察(×100)
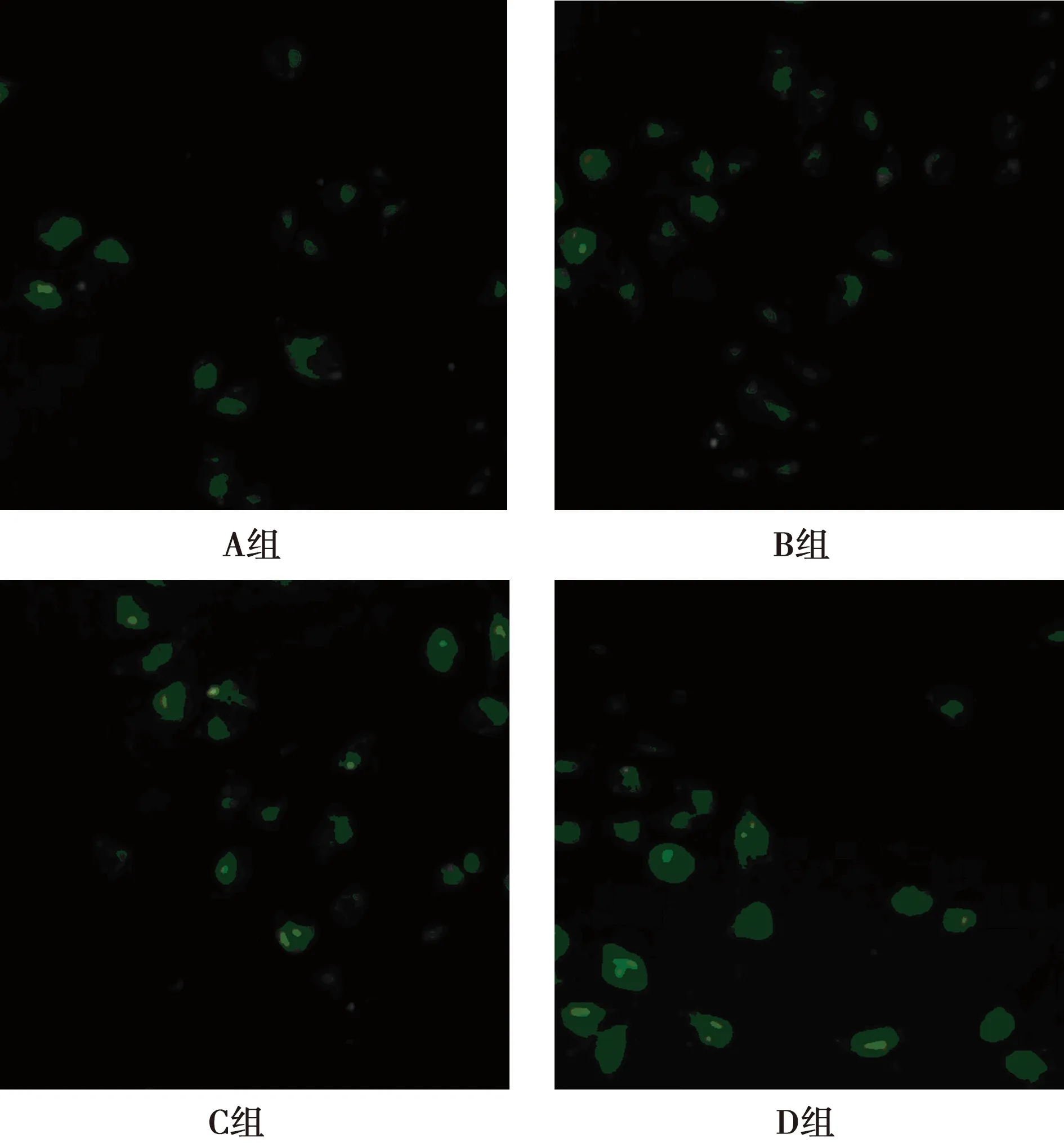
图2 免疫荧光检测SDF-1表达

图3 Transwell检测低氧对EPCs迁移的影响(×200)
3 讨 论
EPCs是一类能够在特定条件下定向增殖分化为成熟血管内皮细胞(EC)的前体细胞〔1〕。1997年,当EPCs首次被提出后〔2〕,15年的时间内,人们对血管再生及修复过程有了全新的认识。EPCs主要存在于骨髓至中,正常情况下仅占外周循环血的0.01%〔3〕。当局部缺血、缺氧造成器官受损或生理性需要血管新生时,局部组织通过释放多种细胞因子,生长因子及激素等物质促进骨髓中的EPCs向外周动员〔4~8〕。当干/祖细胞受到外界影响与骨髓基质细胞分离,到达作用部位,称为EPCs 的动员和归巢〔9,10〕。同年Aiuti首次发现SDF-1是CD34+干细胞的趋化因子,提出CD34+可能按照SDF-1的浓度梯度进行迁移的结论,这为干细胞在骨髓和外周血之间的迁移提出了一个新的可能机制〔11~13〕。本实验所得细胞符合内皮祖细胞特点〔14,,15〕。因此,本文得出结论,低氧可以促进EPCs分泌SDF-1,并动员外源性EPCs按照浓度梯度迁移。根据此结论,我们认为,应用外源性EPCs可以促进缺血缺氧部位组织的血管化,改善缺血缺氧状态,进而进行组织修复。随着对EPCs的研究逐步增加以及对低氧造成EPCs趋化作用的认识,人们更注重于将EPCs与治疗缺血缺氧性疾病联系起来。但是目前仍有一些问题有待解决,如EPCs的局部浓聚是否会形成血管瘤等带来一定副作用。虽然这些问题尚未解决,但是EPCs对缺血缺氧性疾病的治疗一定具有重要意义。
