替格瑞洛对不稳定型心绞痛病人血清MCP-1和MMP-2水平及心功能的影响
2018-12-13,,
,,
不稳定型心绞痛是心血管内科常见的危急重症之一,其病理生理机制为冠状动脉内粥样硬化不稳定斑块形成、破裂,导致血栓形成引起心肌缺血。炎症反应及斑块内基质合成减少、降解增加造成斑块不稳定、破裂,冠状动脉血流中断导致心血管事件的发生。单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)是一种特异性的单核细胞趋化因子,是脂质形成的重要因素,参与动脉粥样硬化斑块炎症反应[1]。基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)可特异性降解胶原蛋白和基底膜,在斑块内活性增高促使易损斑块形成[2]。血清MCP-1和MMP-2水平均与动脉粥样硬化不稳定斑块的形成有关[3]。替格瑞洛是一种可逆性结合二磷酸腺苷受体拮抗剂,可选择性抑制P2Y12,具有起效快、疗效稳定、出血风险低等优点,于2011年7月被美国食品药品管理局(FDA)批准上市。近年来在国内应用越来越多。有研究发现,急性冠脉综合征病人经皮冠状动脉介入术(PCI)后应用替格瑞洛抗血小板聚集和炎症反应效果优于氯吡格雷,并可降低缺血事件发生率[4]。有关替格瑞洛和氯吡格雷对不稳定型心绞痛病人血清MCP-1、MMP-2水平及其心功能的影响尚未见相关报道。本研究旨在探讨替格瑞洛对不稳定型心绞痛病人血清MCP-1、MMP-2水平及心功能的影响,为替格瑞洛的临床应用提供参考依据。
1 资料与方法
1.1 一般资料 选取2014年1月—2015年11月我科收治的不稳定型心绞痛病人92例,其中男58例,女34例。纳入标准:①符合中华医学会心血管学会、《中华心血管病杂志》编辑委员会制定的《不稳定性心绞痛诊断和治疗建议》诊断标准[5];②血小板计数>100×109/L;③入院前未服用氯吡格雷和替格瑞洛;④病人均知情同意并签署知情同意书。排除标准:①抗血小板药物不耐受或过敏者;②血小板计数<100×109/L或>450×109/L;③中途因病情变化行PCI者;④严重肺部、肝肾功能不全,恶性肿瘤等病史;⑤有消化道溃疡或穿孔等疾病;⑥有出血性疾病、凝血功能异常、服用抗凝药物等。所有病人按照入院顺序分为替格瑞洛组和氯吡格雷组,每组46例,两组病人括性别、年龄、既往病史、吸烟等一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组病人一般资料比较
1.2 方法
1.2.1 治疗方法 两组病人均给予吸氧、卧床休息以及低盐低脂饮食,监测生命体征,根据血压、血糖情况,给予降压、降糖治疗,心绞痛常规治疗包括硝酸酯类药物扩张冠状动脉、钙离子拮抗剂、β受体阻滞剂、ACEI/ARB等。氯吡格雷组在常规治疗基础上口服氯吡格雷,首次负荷剂量为300 mg,维持剂量为每次75 mg,每日1次;替格瑞洛组在常规治疗基础上口服替格瑞洛,首次负荷剂量为180 mg,维持剂量为每次45 mg,每日2次。两组用药时间均为6个月。
1.2.2 实验室检测 病人于治疗前及治疗后4周采集空腹静脉血5 mL,常规分离血清,放置于-80 ℃冰箱保存,集中待测。采用酶联免疫吸附法(ELISA)测定血清MCP-1、MMP-2水平,ELISA试剂盒购自北京易科攀博生物科技有限公司,严格按照试剂盒说明书进行操作。
1.2.3 心功能检查 在治疗前和治疗后4周,采用彩色多普勒超声心动图仪(美国VIVID3型)进行检测。病人取左侧卧位,检测左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室射血分数(LVEF)、舒张早期充盈峰速度(E)与舒张晚期充盈峰速度(A),计算比值(E/A)。
1.2.4 随访 采用门诊复诊或住院复查、电话、邮件等方式进行随访,随访时间为6个月,每月1次,观察并记录病人不良反应及心血管事件的发生情况。

2 结 果
2.1 两组治疗前后血清MCP-1、MMP-2水平比较 治疗前两组血清MCP-1、MMP-2水平比较差异无统计学意义(P>0.05);两组治疗后血清MCP-1、MMP-2水平较治疗前均明显下降(P<0.01),且替格瑞洛组明显低于氯吡格雷组,差异有统计学意义(P<0.05或P<0.01)。详见表2。
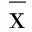
表2 两组治疗前后血清MCP-1、MMP-2水平比较(±s)
2.2 两组治疗前后心功能指标比较 治疗前两组LVEDD、LVESD、LVEF、E/A差异无统计学意义(P>0.05);治疗4周后两组LVEDD、LVESD较治疗前均明显下降(P<0.01),且替格瑞洛组明显低于氯吡格雷组,差异有统计学意义(P<0.05);治疗4周后LVEF、E/A较治疗前明显增加(P<0.05或P<0.01),且替格瑞洛组明显高于氯吡格雷组,差异有统计学意义(P<0.05)。详见表3。
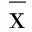
表3 两组治疗前后心功能指标比较(±s)
2.3 两组不良事件发生率比较 两组病人均未出现肝肾功能及血常规异常。随访2个月时,替格瑞洛组有3例因出现呼吸困难而停用替格瑞洛;随访3个月时,氯吡格雷组4例行冠状动脉支架植入术,替格瑞洛组2例行冠状动脉支架植入术;随访5个月时替格瑞洛组失访1例。氯吡格雷组胃肠道不良反应发生率14.3%(6/42),与替格瑞洛组[7.5%(3/40)]比较,差异无统计学意义(χ2=0.965,P=0.326);氯吡格雷组皮疹发生率7.1%(3/42),与替格瑞洛组[2.5%(1/40)]比较,差异无统计学意义(χ2=0.952,P=0.329);替格瑞洛组不良心血管事件发生率明显低于氯吡格雷组,差异有统计学意义(χ2=4.072,P=0.044)。详见表4。

表4 两组不良心血管事件发生率比较
3 讨 论
在急性冠脉综合征发病过程中,炎症起到了重要作用。由于血小板活化,激活炎性细胞功能,刺激炎症细胞趋化因子产生,吸引巨噬细胞及淋巴细胞在斑块聚集,导致斑块不稳定性增加。MCP-1是属于趋势细胞因子家族中β家族成员之一,由巨噬细胞和内皮细胞产生,通过趋化、激活单核细胞,诱导斑块内细胞炎性因子、趋化因子、基质金属蛋白酶(MMPs)等表达增加,促进血栓形成,反映了斑块急性炎症过程,是预测心血管事件发生及预后的危险因子[6]。急性冠脉综合征病人MCP-1水平显著高于非冠心病病人,与高龄、糖尿病、吸烟等指标有关[7]。石一夫等[8]研究发现,MCP-1浓度随着不同斑块硬化程度而逐渐降低。血清MCP-1水平升高,提示斑块存在急性炎症反应,有发生急性冠脉综合征的风险。
基质金属蛋白酶是一组特异性降解细胞外基质的锌离子依赖性蛋白水解酶家族,参与动脉粥样硬化形成过程,其中,MMP-2是影响斑块稳定性的主要基质金属蛋白酶[9]。MCP-1趋化和激活单核细胞,分泌多种炎性因子,诱导内皮细胞分泌MMP-2等基质金属蛋白酶降解基底膜,加快低密度脂蛋白的渗透,使内皮细胞转化为泡沫细胞,从而发生动脉粥样硬化[10]。因此,MCP-1和MMP-2具有协同作用。急性冠脉综合征病人血清MMP-2明显升高,与冠状动脉病变密切相关,可反映急性冠脉综合征病人动脉粥样硬化斑块不稳定或破裂,有助于冠状动脉病变严重程度的危险分层[11]。
有关替格瑞洛对不稳定型心绞痛病人炎症因子及心功能的影响尚未见相关的报道。杨威等[12]研究表明,对于接受PCI的不稳定型心绞痛病人,替格瑞洛较氯吡格雷可显著降低血清炎症因子水平,抗炎作用更强,降低缺血事件发生率,且不增加出血事件。张劲松[13]研究发现,替格瑞洛治疗老年非ST段抬高型急性冠脉综合征病人1周后,替格瑞洛组炎症因子下降速度快于氯吡格雷组,心功能改善幅度大于氯吡格雷组。替格瑞洛较氯吡格雷能更快降低机体炎症反应程度,保护心功能作用更明显。刘怡等[14]研究发现,急性冠脉综合征病人血浆MCP-1和凝血酶原片段1+2(F1+2)水平与心功能分级呈正相关,与LVEF水平呈负相关。本研究结果显示,替格瑞洛组治疗4周后血清MCP-1、MMP-2水平明显低于治疗前,且替格瑞洛组下降水平明显高于氯吡格雷组;治疗4周后LVEDD、LVESD较治疗前均明显下降,LVEF、E/A较治疗前明显增加,且替格瑞洛组改善心功能效果明显优于氯吡格雷组。提示替格瑞洛能更好地抑制炎症反应,降低心肌损伤程度,有利于保护心功能,改善预后。
PLATO研究结果表明,与氯吡格雷相比,替格瑞洛治疗12个月后心血管死亡和心肌梗死发生率显著降低[15]。杨玉辉等[16]研究表明,替格瑞洛组不良心血管事件发生率低于氯吡格雷组(P<0.05),呼吸困难及出血风险略高于氯吡格雷组,替格瑞洛联合阿司匹林治疗急性冠脉综合征,临床疗效确切,具有良好的安全性和耐受性。在本研究中,有3例因呼吸困难而停用替格瑞洛,随访6个月,替格瑞洛组不良心血管事件发生率明显低于氯吡格雷组,与PLATO结果基本一致。提示替格瑞洛有着更好的临床疗效和预后。由于本研究样本量偏少,随访时间偏短,这一结果趋势是否与PLATO结果相一致,还有待于扩大样本量及延长随访时间来进一步证实。
综上所述,替格瑞洛有着更好的抗血小板聚集和抗炎作用,不良心血管事件发生率更低。替格瑞洛可能是通过抑制血清MCP-1、MMP-2水平来发挥抗炎作用,稳定斑块,改善心功能。随着替格瑞洛应用研究的深入,在急性冠脉综合征治疗中将起到越来越重要的作用。
