拔节期和孕穗期低温处理对小麦叶片光合及叶绿素荧光特性的影响
2018-12-11刘蕾蕾纪洪亭刘兵马吉锋肖浏骏汤亮曹卫星朱艳
刘蕾蕾,纪洪亭,刘兵,马吉锋,肖浏骏,汤亮,曹卫星,朱艳
拔节期和孕穗期低温处理对小麦叶片光合及叶绿素荧光特性的影响
刘蕾蕾,纪洪亭,刘兵,马吉锋,肖浏骏,汤亮,曹卫星,朱艳
(南京农业大学国家信息农业工程技术中心/农业农村部农作物系统分析与决策重点实验室/江苏省信息农业高技术研究重点实验室/江苏省现代作物生产协同创新中心,南京 210095)
【目的】研究自然温度日变化模式下低温处理对小麦光合及荧光特性的影响。【方法】以温度敏感性不同的2个小麦品种扬麦16和徐麦30为材料,于拔节期和孕穗期在全自动人工气候室中进行4个低温水平和3个低温持续时间的处理,于低温处理期间及低温处理结束后7 d内每天测定小麦第一张全展叶的光合和荧光参数。【结果】低温处理期间,扬麦16和徐麦30叶片净光合速率(n)、气孔导度(s)、蒸腾速率(r)、最大光化学效率(Fv/Fm)、实际光化学效率(ФPSII)、光化学猝灭系数(qP)均随温度的降低而下降。拔节期低温处理期间,叶片n、s、r、Fv/Fm、ФPSII和qP随低温持续时间的延长呈先降低后升高的趋势,而孕穗期低温处理期间,则随低温持续时间的延长呈下降趋势。低温处理结束后,除孕穗期T4(Tmin/Tmax/Tavg,-6℃/4℃/-1℃)处理外,其他处理的叶片n、s、r、Fv/Fm、ФPSII、qP和非光化学猝灭系数(NPQ)均可恢复到正常水平。低温胁迫下,相对n与相对Fv/Fm、ФPSII、qP呈显著的正相关关系,而与相对NPQ呈显著的负相关关系,且相对n与相对ФPSII、qP的相关性要高于相对Fv/Fm和相对NPQ。【结论】低温主要通过降低叶片ФPSII和qP,引起小麦叶片光合速率下降,进而降低小麦干物质积累,最终导致产量下降。
小麦;拔节期;孕穗期;低温处理;光合;荧光
0 引言
【研究意义】近百年来,自然的气候波动和人类活动的加剧导致地球气候正经历一次以全球变暖为主要特征的显著变化。在全球变暖背景下,极端低温发生的频率、强度和持续时间也在不断加强[1-3]。低温频发加剧了小麦生产系统的不稳定性,降低了小麦产量和品质[4-5]。光合作用是植物最基本的生理现象,是干物质积累的唯一途径[6]。同时,光合作用又是对低温最为敏感的生理过程之一[7],低温不仅伤害光系统I和光系统II,还会影响到暗反应即卡尔文循环过程[8-9]。因此,在全球变暖背景下,研究低温对小麦叶片光合特性的影响,定量分析低温处理下叶片光合速率与荧光参数的关系,可为未来气候条件下小麦抗寒品种选育及减灾丰产高效栽培管理措施制定等提供理论依据。【前人研究进展】低温(非致死)条件下,光合作用由于酶反应受到限制而遭受抑制,使光合碳同化表现出对氧浓度变化不敏感,继而降低植物的光合作用速率[10]。Single等[11]认为小麦拔节期-7℃—0℃的夜间低温将对小麦叶片和茎秆组织产生破坏,降低小麦的光合作用速率。Marcellos等[12]通过人工气候室降温试验(设0℃,-1℃和-2℃3个低温处理,每个处理持续2 h)发现,温度越低导致小麦的光合速率下降越明显,且孕穗期经过-2℃处理后的植株光合性能3 d后仍无法恢复。另外,Marcellos等[12]还得出,低温胁迫对低叶位叶片光合速率的影响明显大于高叶位叶片,低温处理后高叶位叶片出现水泡,尖端坏死,而低叶位叶片则出现皱缩甚至死亡。李卫民等[13]通过对拔节至灌浆期的小麦叶片进行光合测定表明,低温明显降低了小麦的气孔导度和光合速率,进而减少了同化物的累积。为研究小麦植株光合特性对低温冻害的响应规律,任德超等[14]在可移动田间智能低温霜箱内设置了-1℃、-3℃、-5℃、-7℃和-9℃5个温度梯度,对拔节前期和拔节后期的小麦进行4 h低温处理,研究结果表明,小麦叶片光合速率、胞间CO2浓度、蒸腾速率和气孔导度均随温度的降低呈下降趋势,且拔节前期-7℃和拔节后期-5℃处理的小麦叶片各光合性能指标均较对照显著下降。关雅楠等[15]研究认为,分蘖期(-10℃连续处理2 d)和拔节期(0℃连续处理3 d)低温处理下,不同基因型小麦品种叶绿素荧光参数的变化不同,半冬性品种烟农19最大光化学效率、光化学猝灭系数和非光化学猝灭系数显著高于春性品种扬麦18,表明低温胁迫下烟农19光合器官损伤程度轻,具有较高的光合活性和较强的自我保护机制。【本研究切入点】综合国内外文献报道,前人就低温胁迫对小麦叶片光合特性的影响机理进行了大量研究,但已有研究均是在冰箱或人工霜箱中进行,温度的设置大都基于恒定的白天/夜间处理温度,并没有考虑自然条件下的温度日变化规律;再者,已有研究大多仅考虑低温水平对小麦叶片光合及荧光特性的影响,较少研究低温持续时间及低温水平和持续时间的交互作用效应。在自然环境下,低温胁迫是温度日变化规律下低温水平和持续时间的综合效应。另外,已有研究大都是定性描述低温对小麦叶片光合作用和叶绿素荧光参数的影响,缺乏低温胁迫下小麦光合及荧光特性的定量研究。【拟解决的关键问题】本研究以温度敏感性不同的扬麦16和徐麦30为材料,在人工气候室中实施自然温度日变化模式下不同低温发生时期、低温水平、低温持续时间及其互作的小麦盆栽试验,研究低温处理对小麦叶片光合及叶绿素荧光特性的影响,以期为未来气候条件下小麦安全生产及适应性栽培措施的制定提供参考依据。
1 材料与方法
1.1 试验设计
低温处理试验于2013—2015年连续2个小麦生长季,在江苏省如皋市国家信息农业工程技术中心试验基地(120.33°E, 32.23°N)的全自动人工气候室进行。供试小麦品种为扬麦16(春性品种)和徐麦30(半冬性品种)。设置拔节期(S1)和孕穗期(S2)2个低温处理时期,并根据1981—2010年我国冬小麦主产区拔节至孕穗阶段出现的极端温度情况(图1),于每个处理时期设置了4个低温水平和3个低温持续时间,其中4个低温水平分别为T1(6℃/16℃/11℃,处理阶段的日最低温度/最高温度/平均温度,分别用Tmin/Tmax/Tavg表示,CK)、T2(较CK平均低4℃,即设计为2℃/12℃/7℃,Tmin/Tmax/Tavg)、T3(较CK平均低8℃,即设计为-2℃/8℃/3℃,Tmin/Tmax/Tavg)、T4(较CK平均低12℃,即设计为-6℃/4℃/-1℃,Tmin/Tmax/Tavg);3个低温持续时间分别为2 d(D1)、4 d(D2)和6 d(D3)。
试验分别于2013年11月4日和2014年11月3日进行,当天于高30 cm、直径25 cm的塑料桶里播种,每桶在3叶期留苗10株。小麦播种前每桶施用基肥0.9 g N、0.5 g P2O5和0.9 g K2O,拔节前追施0.9 g N,其他管理措施(如灌溉、病虫害防治等)同当地高产栽培管理,以确保小麦生长不受水分和病、虫、草害等限制。低温处理前将小麦置于自然生长环境中,根据各小麦品种的生育进程,分别于拔节期(群体50%植株基部第一节间伸长至离地面2 cm)和孕穗期(群体50%旗叶叶片全部抽出叶鞘,旗叶叶鞘包着的幼穗明显膨大)选取长势一致的小麦移入人工气候室中进行低温处理。低温处理阶段,为减少气候室内各方位光温的差异,每天对内、外侧桶的位置进行互换。低温处理结束后,将小麦置于对照的人工气候室内使其在对照环境下恢复7 d,之后搬出气候室外恢复自然生长环境,直至成熟。
1.2 人工气候室概况
人工气候室采用高透光玻璃构成,每个气候室长×宽×高分别为3.4 m×3.2 m×2.8 m,内安装有温、湿度控制设备、补光和自动换气设备,以便控制人工气候室中的温度、空气湿度、光照和CO2浓度,使其与外界大气环境基本保持一致。人工气候室的温度控制范围在冬春季为-10℃—30℃,夏秋季为10℃—45℃,室内温度均匀性允差为±1℃,湿度控制范围为20%—95%RH,CO2浓度控制范围为350—2 000 μmol·mol-1。采用卤素灯进行补光,以确保气候室内小麦生长能够获得足够的光照强度,晴天中午和阴天中午,人工气候室内的光强分别为1 380 μmol·m-1·s-1和240 μmol·m-1·s-1。人工气候室内的昼夜温度变化采用外界环境中温度日变化曲线模式进行控制,从而使得人工气候室内的温度日变化能够尽量符合自然条件下的温度日变化规律(图2)。

图1 1981—2010年我国冬小麦主产区拔节至孕穗阶段极端最低温度、温度日较差及平均低温持续天数

图2 人工气候室内控制温度的实测值与外界环境温度动态(数据获取于2015年3月25日)
1.3 测定项目与方法
1.3.1 光合指标测定 低温处理期间,于每天上午9:00—12:00,在人工气候室内采用美国Li-COR公司生产的Li-6400 XT型便携式光合测定系统测定小麦顶部第一张全展叶的净光合速率(n)、气孔导度(s)、蒸腾速率(r)等光合指标,每个处理测定5张叶片。测试时选择红蓝光源叶室,设定光量子密度(PAR)1 100 μmol·m-2·s-1。低温处理结束后,将低温处理的小麦移到对照温度下(T1,CK)进行恢复,继续每天测定光合数据直至处理后7 d。
1.3.2 荧光参数测定 采用德国Walz公司生产的PAM2500测定小麦顶部第一张全展叶片的荧光参数,每个处理测试5张叶片。低温处理期间,于每天凌晨3:00—4:00在人工气候室内测定初始荧光(Fo)、最大荧光(Fm)和暗处理下PSⅡ的最大光化学效率(Fv/Fm)。将叶片充分光适应后,于每天上午9:00—12:00,测定小麦顶部第一张全展叶片的光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)和PSⅡ实际光化学效率(ФPSII)等。处理结束后,将低温处理的小麦移到对照温度下(T1,CK)进行恢复,继续每天测定荧光数据直至处理后7 d。
1.4 数据处理
采用Microsoft Excel 2016对2年的试验数据进行数据统计,运用SPSS 18.0 进行数据分析。
2 结果
2.1 拔节期和孕穗期低温处理对小麦叶片光合特性的影响
2.1.1 低温处理对小麦叶片净光合速率的影响 由图3可知,拔节期同一低温处理水平下(T1除外),2个小麦品种叶片净光合速率(n)随低温持续时间的延长呈先下降后升高的趋势,并且2个小麦品种叶片n在处理后1—3 d降至最低,其值(T2—T4)分别较对照(T1)下降48.6%、69.3%和75.3%(2个小麦品种的平均值)。拔节期低温处理结束后,2个小麦品种叶片n开始回升,且均能够在1—6 d内恢复到对照水平(T1)。而孕穗期同一低温处理水平下(T1除外),2个小麦品种叶片n均随低温持续时间的延长呈下降趋势。其中,T2和T3处理的n能够恢复到T1水平,而T4处理结束后叶片n一直持续下降。
拔节期和孕穗期低温处理期间,扬麦16和徐麦30叶片n均随温度的下降而下降,且孕穗期低温水平对叶片n的影响大于拔节期。另外,拔节期低温处理水平对扬麦16的影响大于徐麦30,而孕穗期低温处理水平对叶片n的影响在品种间差异不大。拔节期和孕穗期低温处理期间,最低温度每降低1℃,扬麦16叶片n平均降低6.2%和6.4%,徐麦30叶片n平均降低4.9%和6.9%。此外,从2个小麦品种低温处理结束后叶片n的恢复能力来看,拔节期低温处理结束后,徐麦30叶片n用于恢复的时间要少于扬麦16,而孕穗期低温处理后,2个小麦品种叶片n的恢复时间相差不大。
2.1.2 低温处理对小麦叶片气孔导度的影响 由图4可以看出,拔节期低温处理期间,T2水平下,随低温持续时间的延长,2个小麦品种叶片气孔导度(s)呈升高趋势,而在T3和T4水平下,两个小麦品种叶片s呈先下降后上升的趋势。拔节期低温处理结束后,小麦叶片s均能够恢复到对照水平。而在孕穗期低温处理期间,T2、T3和T4水平下,随低温持续时间的延长,2个小麦品种叶片s均呈下降趋势。其中,T4水平处理1 d,扬麦16和徐麦30叶片s仅为T1处理的9.2%和3.3%,T4处理2—6 d,扬麦16和徐麦30叶片s仅为T1处理的8.2%—24.3%和1.1%—3.9%。孕穗期低温处理结束后,除T4处理外,其他低温水平下的小麦叶片s均能够恢复到对照水平。

a-d和e-h:扬麦16和徐麦30拔节期(S1)低温处理;i-l和m-p:扬麦16和徐麦30孕穗期(S2)低温处理;误差线代表平均值的标准差。■D1处理后恢复期,□D2处理后恢复期,○D3处理后恢复期,●低温处理期间。下同

图4 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片气孔导度(Gs)的影响
拔节期和孕穗期低温处理期间,扬麦16和徐麦30叶片s均随温度的下降呈下降趋势,且孕穗期低温处理水平对s的影响大于拔节期。此外,低温处理水平对徐麦30叶片s的影响大于扬麦16。拔节期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片的s平均降低3.8%和6.5%,而孕穗期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片的s平均降低5.7%和8.0%。
2.1.3 低温处理对小麦叶片蒸腾速率的影响 由图5可以看出,低温处理下2个小麦品种叶片蒸腾速率(r)与s规律基本一致。拔节期低温处理期间,r随低温持续时间的延长呈先下降后上升的趋势(T1除外)。而在孕穗期低温处理期间,随低温持续时间的延长,r基本上呈下降趋势。其中,T4处理1 d,扬麦16和徐麦30叶片r仅为T1的10.0%和5.7%,T4处理2—6 d,扬麦16和徐麦30叶片r仅为T1的5.2%—18.5%和2.5%—4.6%。此外,除孕穗期T4水平外,其他低温处理下小麦叶片r基本上均可恢复到对照水平。
拔节期和孕穗期低温处理期间,扬麦16和徐麦30叶片r均随温度的下降而下降,孕穗期低温处理对r的影响大于拔节期,并且低温处理水平对徐麦30叶片r的影响大于扬麦16。拔节期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片r分别降低6.0%和6.9%。而在孕穗期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片r分别降低6.2%和7.6%。
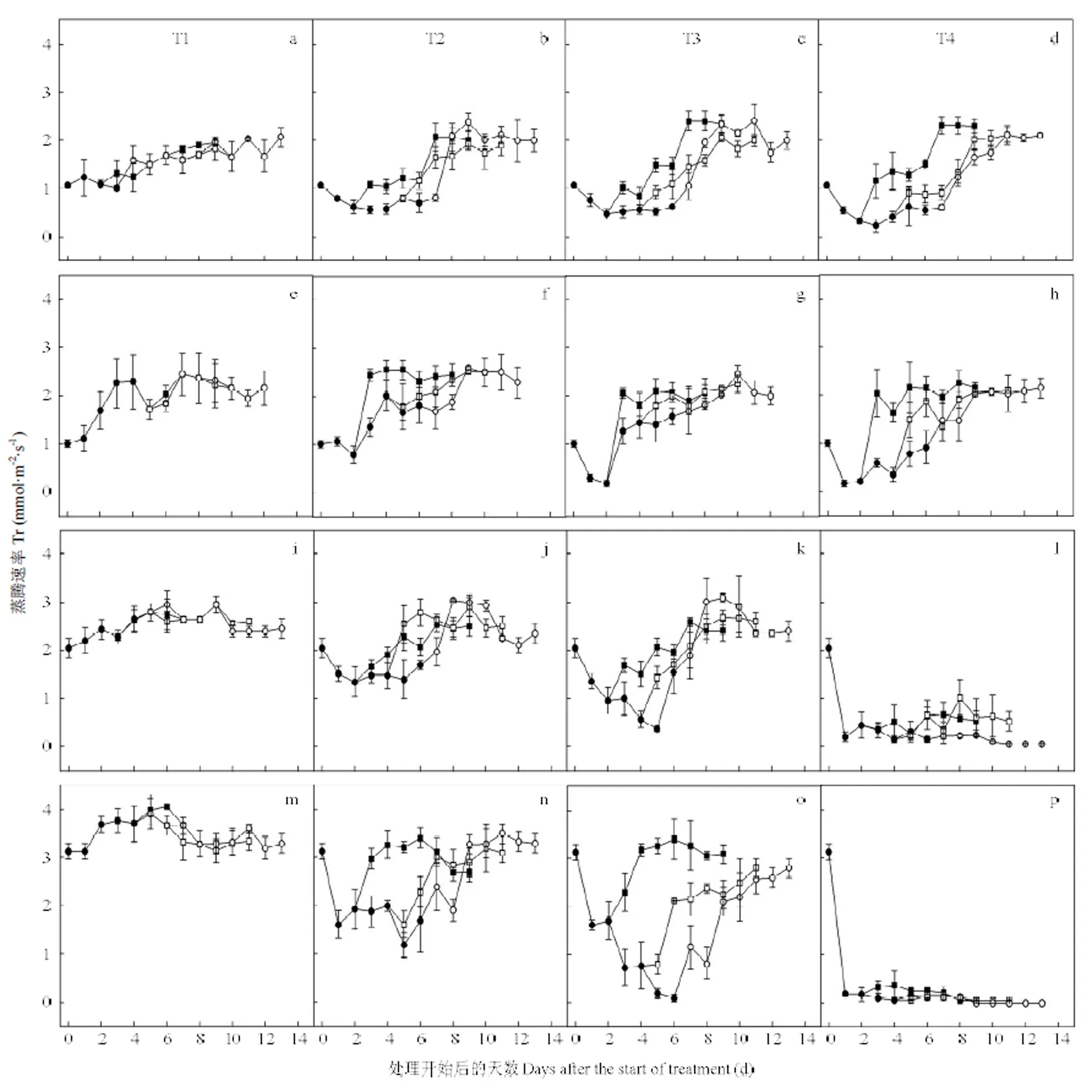
图5 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片蒸腾速率(Tr)的影响
2.2 拔节期和孕穗期低温处理对小麦叶片荧光参数的影响
2.2.1 低温处理对小麦叶片最大光化学效率的影响 由图6可知,拔节期低温处理期间,除T1水平外,2个小麦品种叶片最大光化学效率(Fv/Fm)均随低温持续时间的延长呈先下降后升高的趋势。拔节期T2、T3和T4水平下,扬麦16叶片Fv/Fm在低温处理后4 d降到最低,其值分别较T1下降8.7%、10.6%和12.5%,随后缓慢恢复;而徐麦30叶片Fv/Fm在低温处理后2 d降到最低,其值分别较T1下降4.3%、4.0%和6.9%,随后迅速恢复,表明拔节期低温处理对扬麦16叶片Fv/Fm的影响大于徐麦30。孕穗期低温处理期间,T2和T3水平下,扬麦16和徐麦30叶片Fv/Fm随低温持续时间的延长,其下降趋势不显著;而在T4水平下,2个小麦品种叶片Fv/Fm随低温持续时间的延长而呈显著下降,低温持续时间每增加1 d,T4处理的扬麦16和徐麦30叶片Fv/Fm分别较T1下降2.7%和1.8%。

图6 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片最大光化学效率(Fv/Fm)的影响
拔节期和孕穗期低温处理期间,2个小麦品种叶片Fv/Fm均随温度的降低呈下降趋势。拔节期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片Fv/Fm(D1—D3)分别较T1降低0.7%和0.2%、1.1%和0.2%、0.8%和0.5%。而孕穗期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片Fv/Fm(D1—D3)分别较T1降低0.5%和0.8%、0.4%和0.9%、1.2%和0.7%。由此可见,拔节期低温水平对扬麦16叶片Fv/Fm的影响大于徐麦30,而在孕穗期则是徐麦30叶片Fv/Fm的影响大于扬麦16(D3除外)。另外,除孕穗期T4低温处理水平下,其他低温处理的小麦叶片Fv/Fm值均可恢复到对照水平。
2.2.2 低温对处理小麦叶片PSⅡ实际光化学效率的影响 由图7可以看出,拔节期低温处理期间,2个小麦品种叶片PSⅡ实际光化学效率(ФPSII)随低温持续时间的延长呈先下降后上升的趋势(除T1外),一般在2—5 d,叶片ФPSII降至最低(图7)。与T1相比,拔节期T2、T3和T4水平下,扬麦16和徐麦30叶片ФPSII的最低值分别下降55.6%和38.9%、64.3%和53.3%、73.3%和56.8%。孕穗期低温处理期间,T2水平下,扬麦16叶片ФPSII随低温持续时间的延长呈下降趋势,持续时间每增加1 d,叶片ФPSII降低2.6%,而在T3和T4水平下,扬麦16叶片ФPSII随低温持续时间的延长变化不大,其值分别在0.28—0.31和0.06—0.11。在T2和T3水平下,徐麦30叶片ФPSII随孕穗期低温持续时间的延长呈显著下降,持续时间每增加1 d,叶片ФPSII分别降低3.8%和4.2%,而T4温度水平下,徐麦30叶片ФPSII随持续时间的延长变化不大,其值在0.08—0.12。

图7 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片PSⅡ实际光化学效率(ФPSII)的影响
拔节期和孕穗期低温处理期间,2个小麦品种叶片ФPSII随温度的降低呈下降趋势,且孕穗期低温对小麦叶片ФPSII的影响大于拔节期。在拔节期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片ФPSII(D1—D3)分别降低6.0%和3.5%、5.8%和5.8%、5.7%和6.1%。而在孕穗期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片ФPSII(D1—D3)分别降低6.3%和5.9%、5.9%和6.1%、5.8%和6.5%。此外,除孕穗期T4外,低温处理结束后,2个小麦品种叶片ФPSII均可恢复到对照水平。
2.2.3 低温处理对小麦叶片光化学猝灭系数的影响 由图8可以看出,拔节期和孕穗期低温处理期间,2个小麦品种叶片光化学猝灭系数(qP)随低温持续时间的延长呈先下降后升高趋势,并且随温度的降低呈下降趋势,孕穗期低温处理水平对小麦叶片qP的影响大于拔节期。在拔节期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片qP(D1—D3)分别降低4.7%和2.4%、4.0%和4.5%、4.0%和5.3%。而在孕穗期低温处理期间,最低温度每降低1℃,扬麦16和徐麦30叶片qP(D1—D3)分别降低5.7%和5.9%、5.1%和4.9%、4.4%和5.4%。此外,在小麦拔节期,低温持续2 d处理(D1)下,低温水平对扬麦16叶片qP的影响大于徐麦30,而低温持续4 d处理(D2)下,低温水平对扬麦16叶片qP的影响要小于徐麦30。在孕穗期,D1和D2处理下,低温水平对叶片qP的影响在2个小麦品种间差异不大,但在低温持续6 d处理(D3)下,低温水平对徐麦30叶片qP的影响要大于扬麦16。此外,除孕穗期T4处理外,其他处理的叶片qP在低温处理结束后1—3 d均可恢复到对照水平。
2.2.4 低温处理对小麦叶片非光化学猝灭系数的影响 由图9可知,低温持续时间对扬麦16和徐麦30叶片非光化学猝灭系数(NPQ)的影响不大,但2个小麦品种叶片NPQ随温度的降低呈较为显著的上升趋势。D1处理下,NPQ在2个处理时期间差异不大,而D2和D3处理下,孕穗期低温对2个小麦品种NPQ的影响要大于拔节期,表明孕穗期低温处理下,小麦叶片光合器官吸收的光能以热耗散形式消耗为主,从而在一定程度上缓解低温导致的光抑制(图9)。低温处理结束后,除孕穗期T4外,其他处理的叶片NPQ在1—3 d内均可恢复到对照水平。
2.3 拔节期和孕穗期低温处理下小麦叶片净光合速率与荧光参数的关系
由图10可知,叶片相对净光合速率与相对荧光参数密切相关,相对n与相对Fv/Fm、ФPSII、qP间存在显著的正相关关系,而与相对NPQ呈显著的负相关关系。线性方程的斜率表明,相对Fv/Fm、ФPSII、qP每降低0.01个单位,叶片相对n分别降低5.2%、1.0%、1.1%,而相对NPQ每增加1个单位,相对n降低16.2%。分析净光合速率与荧光参数的关系以选择最优的荧光参数,有助于定量分析低温处理下叶片净光合速率的变化。从4个荧光参数与叶片净光合速率的相关关系来看,与n的关系较好的为ФPSII和qP,其次是Fv/Fm,而NPQ与n的相关关系较差。
3 讨论
光合作用是对低温最敏感的生理过程之一[16],关于低温对小麦叶片光合作用影响的研究已有较多报道[17-19]。前人研究多针对低温水平对小麦叶片光合作用的影响[9, 20],或针对低温持续时间对叶片光合作用的影响[21],较少考虑低温水平和持续时间的综合调控效应。即使有少量的研究同时考虑了低温水平和持续时间的综合效应[22],其温度的设置也不符合自然温度日变化规律,大都基于恒定固定的白天/夜间温度。因此,本研究通过在人工气候室中实施自然温度日变化模式下不同低温发生时期、低温水平和低温持续时间的小麦盆栽试验,分析低温环境下小麦叶片光合和荧光参数对低温的响应规律,定量低温处理下净光合速率与各荧光参数间的关系,以期为全球气候变化背景下中国小麦安全生产适应性措施和缓解策略的制定提供数据支持和理论依据。本研究表明,低温显著降低小麦叶片净光合速率,这与前人的研究一致[16, 20]。在拔节期低温处理期间,同一低温持续时间下,小麦叶片n随温度的降低而下降。在同一低温水平下,扬麦16和徐麦30在处理后1—3 d降至最低值,之后开始回升。其原因可能是短时间的低温适应增加了叶片光合过程中主要酶含量、促使光合同工酶的表达以及增强细胞膜的稳定性[23],从而在一定程度上缓解了低温对叶片光合作用的影响。而在孕穗期低温处理期间,小麦叶片n随温度的降低和低温持续时间的延长呈下降趋势,其原因可能是孕穗期低温对小麦n的影响大于拔节期处理,短期低温适应无法缓解低温对净光合速率的影响。关雅楠等[15]通过研究低温胁迫下不同基因型小麦品种光合性能的影响结果表明,分蘖期和拔节期低温胁迫下半冬性品种烟农19n、s、Fv/Fm、qP、NPQ均高于弱春性品种郑麦9023和春性品种扬麦18,表明烟农19具有较高的光合活性和较强的自我保护机制。本研究表明,在小麦拔节期和孕穗期下,低温水平和低温持续时间对扬麦16n的影响大于徐麦30,而低温水平和持续时间对荧光参数的影响在品种间的表现与n并不一致。例如,在拔节期,低温水平对扬麦16 Fv/Fm的影响大于徐麦30,而在孕穗期,低温水平对扬麦16和徐麦30 Fv/Fm的影响差异不大。这可能与扬麦16是春性品种,较半冬性的徐麦30对拔节期低温更为敏感有关。而到了孕穗期,小麦抗低温能力迅速减弱[24],两个小麦品种对低温的抗性逐渐降低,所以导致低温对2个品种间Fv/Fm的影响差异不大。
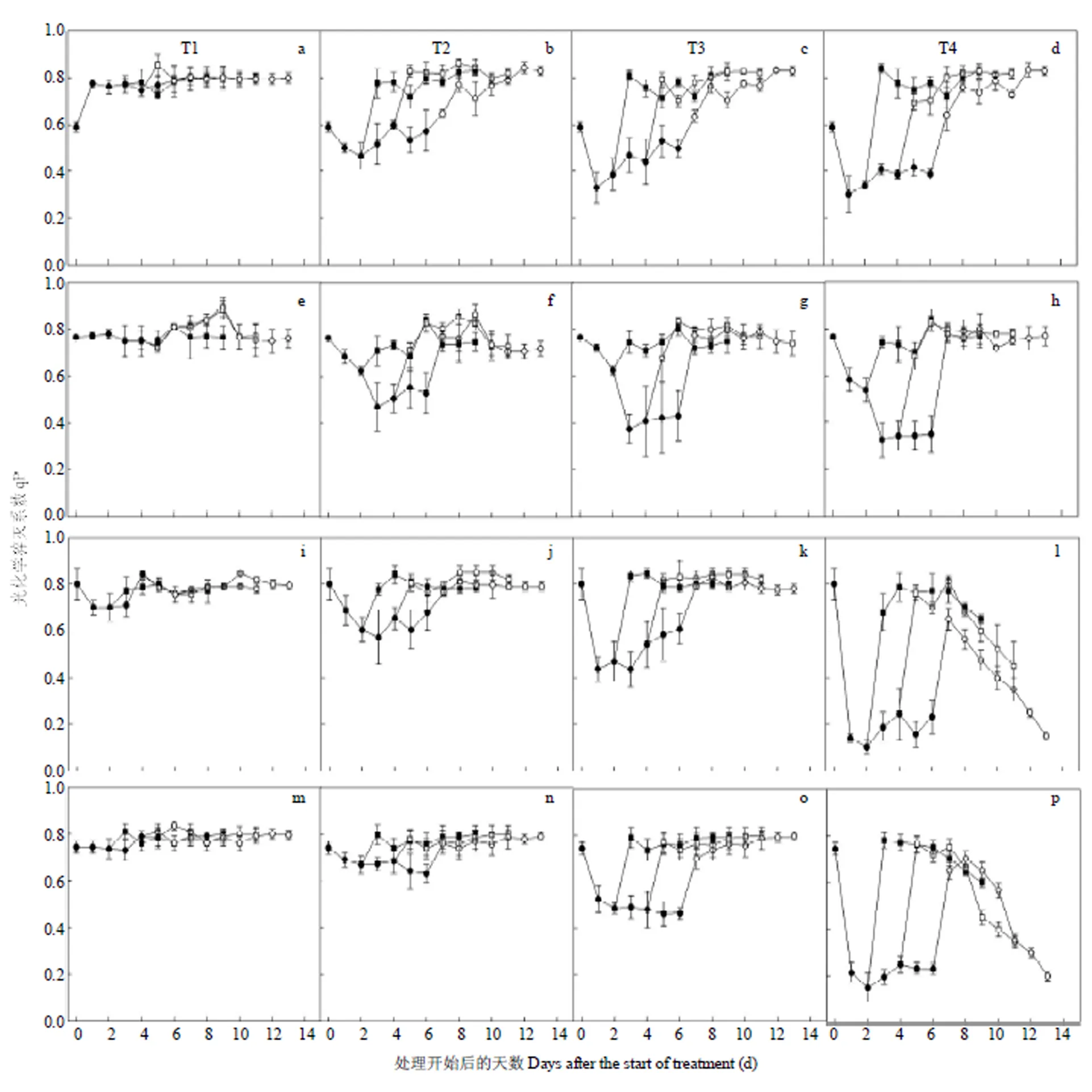
图8 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片光化学猝灭系数(qP)的影响

图9 拔节期和孕穗期不同低温水平和持续时间对小麦第一张全展叶片非光化学猝灭系数(NPQ)的影响

**表示达到0.01显著水平**, significant at P<0.01
Marcellos[25]研究认为,轻度低温胁迫后,小麦在正常温度下生长3 d,叶片净光合速率便可恢复到正常水平,而重度低温胁迫后叶片净光合速率无法恢复。Fuller等[26]报道,孕穗期以后-5℃处理下,小麦旗叶损伤很小,但温度低于-5℃,小麦旗叶损伤严重。本研究表明,拔节期T4温度处理后,小麦叶片在正常温度生长1—6 d便可恢复到正常水平,而孕穗期T4处理后,小麦叶片净光合速率显著下降,处理结束后7 d仍无法恢复到正常水平,表明小麦叶片临界致死温度随生育期的变化而变化,-6℃/4℃可能是孕穗期小麦叶片临界致死温度。
牟会荣等[27]研究表明,与“表观性”的气体交换指标相比,叶绿素荧光参数更具有反映“内在性”的特点。低温胁迫下,叶片叶绿素荧光参数的变化与低温程度有关[28-29]。本研究表明,叶片Fv/Fm、ФPSII和qP随温度水平的降低呈下降趋势,而NPQ则随温度水平的降低而显著增加。低温处理后,除孕穗期T4处理外,其他处理的叶片Fv/Fm、ФPSII、qP和NPQ均可恢复到正常水平。这表明拔节期和孕穗期适度低温下产生的光抑制并没有导致PSⅡ反应中心的损伤,PSⅡ反应中心活性和开放程度的下降起到了光保护的作用,而孕穗期T4处理的叶片PSⅡ反应中心遭受到不可逆损伤。
有关定量分析叶片光合速率与荧光参数的关系研究已有报道,而多数的研究多采用Fv/Fm来定量分析低温对作物叶片光合速率的影响[30-31]。本研究表明,相对叶片净光合速率(n)与相对最大量子产量(Fv/Fm)、相对实际的量子产量(ФPSII)、相对光化学猝灭系数(qP)间均存在显著的正相关关系,而与相对非光化学猝灭系数(NPQ)呈显著的负相关关系。从4个荧光参数与叶片净光合速率的相关关系来看,n与ФPSII和qP的关系较好,其次是Fv/Fm,而NPQ与n的相关关系较差。这表明,低温处理下,基于ФPSII和qP两个指标来定量分析n的变化较其他2个指标更能反映低温对叶片光合速率的影响。
4 结论
拔节期低温处理期间,扬麦16和徐麦30叶片n、s、r和Fv/Fm均随低温持续时间的延长呈先降低后升高的趋势,而在孕穗期低温处理期间,n、s、r和Fv/Fm则随低温持续时间的延长呈下降趋势。同一低温持续时间下,小麦叶片n、s、r、Fv/Fm、ФPSⅡ和qP均随温度的下降呈降低的趋势,而NPQ则随温度的下降显著增加。低温处理结束后,除孕穗期T4处理外,其他低温处理后的小麦叶片n、s、r、Fv/Fm、ФPSII、qP和NPQ均可恢复到对照水平。
此外,低温处理下,相对n与相对Fv/Fm、ФPSII、qP呈显著的正相关关系,而与相对NPQ呈显著的负相关关系,且n与ФPSII、qP的相关性要好于Fv/Fm和NPQ。表明低温主要通过降低叶片PSII的实际量子产量和光化学猝灭系数,引起小麦叶片光合速率下降,降低小麦干物质积累,最终导致产量下降。
[1] KODRA E, STEINHAEUSER K, GANGULY A R. Persisting cold extremes under 21st century warming scenarios., 2011, 38: 1-5.
[2] SANGHERA G S, WANI S H, WASIM H, SINGH N B. Engineering cold stress tolerance in crop plants., 2011, 12(1): 30-43.
[3] VAVRUS S, WALSH J E, CHAPMAN W L, PORTIS D. The behavior of extreme cold air outbreaks under greenhouse warming., 2006, 26(9): 1133-1147.
[4] ZHENG B Y, CHENU K, FERNANDA D M, CHAPMAN S C. Breeding for the future: what are the potential impacts of future frost and heat events on sowing and flowering time requirements for Australian bread wheat () varieties?, 2012, 18(9): 2899-2914.
[5] 马树庆, 李锋, 王琪. 寒潮和霜冻. 北京: 气象出版社, 2009.
MA S Q, LI F, WANG Q.. Beijing: China Meteorological Press, 2009. (in Chinese)
[6] ZHANG C J, CHEN G X, GAO X X, CHU C J. Photosynthetic decline in flag leaves of two field-grown spring wheat cultivars with different senescence properties., 2006, 72(1): 15-23.
[7] 陶宏征, 赵昶灵, 李唯奇. 植物对低温的光合响应. 中国生物化学与分子生物学报, 2012, 28(6): 501-508.
TAO H Z, ZHAO C L, LI W Q. Photosynthetic response to low temperature in plant., 2012, 28(6): 501-508. (in Chinese)
[8] 朱佳, 梁永超, 丁燕芳, 李兆君. 硅对低温胁迫下冬小麦幼苗光合作用及相关生理特性的影响. 中国农业科学, 2006, 39(9): 1780-1788.
ZHU J, LIANG Y C, DING Y F, LI Z J. Effect of silicon on photosynthesis and its related physiological parameters in two winter wheat cultivars under cold stress., 2006, 39(9): 1780-1788. (in Chinese)
[9] 范琼花, 孙万春, 李兆君, 梁永超. 硅对短期低温胁迫小麦叶片光合作用及其主要相关酶的影响. 植物营养与肥料学报, 2009, 15(3): 544-550.
FAN Q H, SUN W C, LI Z J, LIANG Y C. Effects of silicon on photosynthesis and its major relevant enzyme activities in wheat leaves under short-term cold stress., 2009, 15(3): 544-550. (in Chinese)
[10] SASSENRATH G F, ORT D R. The relationship between inhibition of photosynthesis at low temperature and the inhibition of photosynthesis after rewarming in chilly sensitive tomato., 1990, 28(4): 457-465.
[11] SINGLE W V. Frost injury and the physiology of the wheat plant., 1985, 51(2): 128-134.
[12] MARCELLOS H, Single W V. Frost injury in wheat ears after ear emergence., 1984, 11(2): 7-15.
[13] 李卫民, 张佳宝, 朱安宁. 空气温湿度对小麦光合作用的影响. 灌溉排水学报, 2008, 27(3): 90-92.
LI W M, ZHANG J B, ZHU A N.Effects of air temperature and humidity on the photosynthesis of winter wheat., 2008, 27(3): 90-92. (in Chinese)
[14] 任德超, 胡新, 陈丹丹, 张建涛, 倪永静, 刘红杰, 黄绍华, 李国强. 不同低温处理对小麦光合特性和产量性状的影响. 中国农学通报, 2016, 32(21): 44-50.
REN D C, HU X, CHEN D D, ZHANG J T, NI Y J, LIU H J, HUANG S H, LI G Q. Effects of different low temperature treatments on photosynthetic characteristics and yield traits of wheat., 2016, 32(21): 44-50. (in Chinese)
[15] 关雅楠, 黄正来, 张文静, 石小东, 张裴裴. 低温胁迫对不同基因型小麦品种光合性能的影响. 应用生态学报, 2013, 24(7): 1895-1899.
GUAN Y L, HUANG Z L, ZHANG W J, SHI X D, ZHANG P P. Effects of low temperature stress on photosynthetic performance of different genotypes wheat cultivars., 2013, 24(7): 1895-1899. (in Chinese)
[16] ALLEN D J, ORT D R. Impacts of chilling temperatures on photosynthesis in warm-climate plant., 2001, 6(1): 36-42.
[17] ENSMINGER I, BUSCH F, HUNER N P A. Photostasis and cold acclimation: sensing low temperature through photosynthesis., 2006, 126(1): 28-44.
[18] HUNER N P A, ÖQUIST G, HURRY V M, KROL M, FALK S, GRIFFITH M. Photosynthesis, photoinhibition and low temperature acclimation in cold tolerant plants., 1993, 37(1): 19-39.
[19] ÖQUIST G. Effects of low temperature on photosynthesis., 2010, 6(4): 281-300.
[20] LI X N, PU H C, LIU F L, ZHOU Q, CAI J, DAI T B, CAO W X, Jiang D. Winter wheat photosynthesis and grain yield responses to spring freeze., 2015, 107(3): 1002-1010.
[21] VENZHIK Y V, TITOV A F, TALANOVA V V, NAZARKINA E A. Effect of root cooling on the tolerance of wheat leaf cells and activity of the photosynthetic apparatus., 2009, 427(1): 346-348.
[22] 陈思思, 李春燕, 杨景, 徐雯, 朱新开, 郭文善, 封超年. 拔节期低温冻害对扬麦16光合特性及产量形成的影响. 扬州大学学报(农业与生命科学版), 2014, 35(3): 59-64.
CHEN S S, LI C Y, YANG J, XU W, ZHU X K, GUO W S, FENG C N. Effect of low temperature at jointing stage on photosynthetic characteristics and yield in wheat cultivar Yangmai 16., 2014, 35(3): 59-64. (in Chinese)
[23] YAMORI W, HIKOSAKA K, WAY D A. Temperature response of photosynthesis in C3, C4, and CAM plants: temperature acclimation and temperature adaptation., 2013, 119(1/2): 101-117.
[24] ZHONG X, MEI X, LI Y, YOSHIDA H, ZHAO P, WANG X, HAN L, HU X, HUANG S, HUANG J, SUN Z. Changes in frost resistance of wheat young ears with development during jointing stage., 2008, 194(5): 343-349.
[25] MARCELLOS H. Wheat frost injury-freezing stress and photosynthesis., 1977, 28(4): 557-564.
[26] FULLER M P, FULLER A M, KANIOURAS S, CHRISTOPHERS J, FREDERIC T. The freezing characteristics of wheat at ear emergence., 2007, 26(4): 435-441.
[27] 牟会荣, 姜东, 戴廷波, 荆奇, 曹卫星. 遮荫对小麦旗叶光合及叶绿素荧光特性的影响. 中国农业科学, 2008, 41(2): 599-606.
MOU H R, JIANG D, DAI T B, JING Q, CAO W X. Effects of shading on photosynthetic and chlorophyll fluorescence characters in wheat flag leaves., 2008, 41(2): 599-606. (in Chinese)
[28] DAI F, ZHOU M, ZHANG G. The change of chlorophyll fluorescence parameters in winter barley during recovery after freezing shock and as affected by cold acclimation and irradiance., 2008, 45(12): 915-921.
[29] PLOSCHUK E L, BADO L A, SALINAS M, WASSNER D F, WINDAUER L B, INSAUSTI P. Photosynthesis and fluorescence responses ofto chilling and freezing stress during early vegetative stages., 2014, 102(5): 18-26.
[30] FIELDSEND A F. Interactive effects of light, temperature and cultivar on photosynthesis in evening primrose () crops., 2005, 52(4): 333-342.
[31] YING J, LEE E A, TOLLENAAR M. Response of maize leaf photosynthesis to low temperature during the grain-filling period., 2000, 68(2): 87-96.
Effects of Jointing and Booting Low Temperature Treatments on Photosynthetic and Chlorophyll Fluorescence Characteristics in Wheat Leaf
LIU Leilei, JI HongTing, LIU Bing, MA JiFeng, XIAO LiuJun, TANG Liang, CAO WeiXing, ZHU Yan
(National Engineering and Technology Center for Information Agriculture, Nanjing Agricultural University/Key Laboratory for Crop System Analysis and Decision Making, Ministry of Agriculture and Rural Affairs/Jiangsu Key Laboratory for Information Agriculture/Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing 210095)
【Objective】The objective of this paper was to study the effects of low temperature treatment below the daily variation rule of natural temperature on leaf photosynthetic properties of wheat. 【Method】The environment-controlled phytotron experiments with two different temperature sensitive wheat cultivars were conducted under four low temperature levels and two low temperature durations at jointing and booting stages. During low temperature treatment stage and in 7 days after low temperature treatments, the photosynthetic and chlorophyll fluorescence characteristics in wheat leaves were measured. 【Result】During low temperature treatment stage, the net photosynthetic rate (n), stomatal conductance (s), transpiration rate (r), maximum photochemical efficiency (Fv/Fm) , PSⅡ actual photochemical efficiency (ФPSII) and photochemical quenching (qP) decreased with the decreasing temperature. During jointing stage,n,s,r, Fv/Fm, ФPSII and qP decreased firstly and then increased with the increasing of low temperature duration, while the decreased trends were observed in the response ofn,s,r, Fv/Fm, ФPSII and qP to low temperature duration when low temperature treatments were conducted at booting stage. After low temperature treatments, except for T4 (Tmin/Tmax/Tavg, -6℃/4℃/-1℃) at booting stage,n,s,r, Fv/Fm, ФPSII, qP and NPQ in all low temperature treatments could recover to the same status with T1. Moreover, under low temperature treatments, the relative of Fv/Fm, ФPSII and qP were significantly positively correlated to the relativen, while the relative NPQ was significantly negatively correlated to the relativen. Compared with the relative of Fv/Fm and NPQ, the correlation coefficients between the relative of ФPSII, qP andn were more higher. 【Conclusion】The decreases in photosynthetic rate of leaves under low temperature condition were mainly attributed to the decreased ФPSII and qP, leading to the reduction of dry matter accumulation, finally caused the lower grain yield of wheat.
wheat; jointing stage; booting stage; low temperature treatments; photosynthetic; fluorescence
10.3864/j.issn.0578-1752.2018.23.004
2018-06-06;
2018-07-10
国家重点研发计划(2017YFD0300205)、国家自然科学基金(31872848)、中央高校基本科研业务费专项资金(KYZ201703)、国家杰出青年科学基金(31725020)、江苏省高校优势学科资助项目(PAPD)
刘蕾蕾,Tel:025-84396065;E-mail:liuleilei@njau.edu.cn。
朱艳,Tel:025-84396598;E-mail:yanzhu@njau.edu.cn
(责任编辑 杨鑫浩)
