温度和相对湿度对山羊生长性能和血液指标的影响
2018-12-11李金朋王国军赵天周广琛杨雨鑫
李金朋,王国军,赵天,周广琛,杨雨鑫
温度和相对湿度对山羊生长性能和血液指标的影响
李金朋,王国军,赵天,周广琛,杨雨鑫
(西北农林科技大学动物科技学院,陕西杨凌 712100)
【目的】研究温度和相对湿度(RH)对山羊生长性能、尿常规、血常规和血清生理生化指标的影响,为山羊在高温高湿下的饲养、疾病诊断及制定缓解措施提供理论参考。【方法】试验采用4个温度水平(26℃、30℃、34℃和38℃)和4个RH水平(35%、50%、65%和80%)的4×4的试验设计,选取体重相近的1.5岁左右的波尔山羊与奶山羊杂交一代羊8只,随机分为2个组,每组4只羊,每只羊为1个重复。自然环境下适应期30 d,每组试验期5 d,全天24 h处理,按照处理方式在人工环境控制舱轮流进行试验。各组试验开始前后记录每只羊的体重,每天记录采食量、饮水量,各组试验第3天和第5天采集全血用于测血常规和获得血清,并检测血清生理生化指标。【结果】(1)温度和RH交互作用对山羊平均日采食量(ADFI)和平均日饮水量(ADWI)有显著影响(<0.05),而对平均日增重(ADG)、料重比和血常规指标均无显著影响(>0.05)。38℃各处理组山羊ADG显著低于26℃和30℃各处理组(<0.05)。38℃时山羊ADFI显著低于26℃和30℃(<0.05)。RH为65%和80%时白细胞总数(WBC)显著低于RH为35%时(<0.05)。(2)试验第3天,温度和RH交互作用对山羊血清钾(K)含量,谷丙转氨酶(ALT)和谷草转氨酶(AST)活性有显著影响(<0.05)。38℃,80%时山羊血清K含量显著低于其他组(<0.05)。38℃时山羊血清葡萄糖(GLU)、球蛋白(GLO)、尿素氮(BUN)、钙(Ca)和碱性磷酸酶(ALP)显著低于26℃和30℃(<0.05)。RH为80%时山羊血清GLU、BUN显著低于RH为35%时(<0.05)。试验第5天,温度和RH对山羊血清总蛋白(TP)、白蛋白(ALB)、GLO、BUN、Ca、磷(P)、K、钠(Na)含量和乳酸脱氢酶(LDH)活性的影响均有显著的交互作用(<0.05);34℃和38℃时对山羊血清GLU、氯(Cl)、ALT、AST、ALP和肌酸激酶(CK)显著低于26℃(<0.05);RH为60%和80%时山羊血清GLU、Cl显著低于RH为35%时(<0.05)。(3)试验第3天和第5天,38℃,80%和38℃,65%时山羊血清总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)的浓度显著低于26℃各处理组(<0.05)。34℃和38℃山羊血清丙二醛(MDA)显著高于26℃(<0.05)。(4)温度升高,ADFI、ADG及血清TP、GLO、BUN、GLU、ALT、T-AOC、SOD、CAT降低,而ADWI和血清MDA升高。RH升高,ADFI及血清GLU、Cl、T-AOC、GSH-Px降低,而血清TP、LDH、MDA升高。(5)试验第5天血清TP、ALB、GLO、BUN、GLU、TC、TG、Ca、P、ALT、AST、ALP、LDH和CK大多组低于试验第3天,而血清抗氧化指标MDA高于试验第3天,T-AOC、SOD、CAT和GSH-Px在34℃和38℃时高于第3天。【结论】温度、RH及二者交互作用不同程度地影响山羊平均日采食量、平均日饮水量、血清生化指标和抗氧化指标,高温高湿环境不利于山羊的生长性能和机体抗氧化功能,其中,温度为38℃,RH为80%时山羊受到的影响最严重。另外,随着高温高湿时间的延长,山羊表现出更强的应激反应。
温度;相对湿度;山羊;生长性能;血清生理生化指标;抗氧化指标
0 引言
【研究意义】温热环境因子主要包括温度、湿度、风速、辐射等因素,高温、高湿环境导致动物产生应激,是影响畜禽生产的主要因素之一。近年来,我国大部分地区夏季气温均高于30℃,尤其在长江流域及以南地区,高温、高湿气候持续时间更长,环境应激对动物的危害日益严重,动物生产受到了很大的影响。因此,研究温度和RH对畜禽的影响,为畜禽生产上制定缓解应激的技术措施和高温高湿引起的相关疾病的诊断具有重大意义。【前人研究进展】研究表明,热应激状态下,奶牛的食欲减退,采食量显著降低,产奶量下降,血清激素等指标受到严重影响,从而使生产性能下降[1-3]。张少帅等[4]的研究发现RH和间歇性偏热处理存在交互作用并不同程度地影响肉仔鸡的免疫功能且较高偏热和较高湿度(31℃+85%RH)的影响最大。雷虹等[5]对热应激状态下湘西黄牛常规血液生化指标进行研究,结果发现,热应激状态下,湘西黄牛血液中的红细胞总数(RBC)、红细胞压积(PCV)、白细胞数(WBC)、平均血红蛋白浓度(MCHC)和平均血红蛋白含量(MCH)与无热应激组差异显著。另外,有研究报道,热应激时,山羊的血糖含量有一定程度的上升,血清中CK明显的上升,WBC略有下降,RBC和血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)、总蛋白(TP)、尿素氮(BUN)含量变化不显著[6]。【本研究切入点】温度和RH对畜禽的研究多集中猪、鸡和牛上,而对山羊生产性能和血清生化指标的研究较为少见,对尿常规和血常规的研究更是少之又少。另外,在畜禽实际生活环境中,很难有单一环境因素,大多为温度和RH等多环境因素的交互影响。目前大部分研究为单一环境因素对畜禽影响的研究,温度、RH等组合研究的报道鲜见。【拟解决的关键问题】本试验采用数字化模拟控制的人工环控代谢舱,通过研究山羊在不同环境温湿度下生长性能和血液指标的变化规律,为进一步制定缓解山羊在高温高湿环境下产生应激的技术措施提供理论依据,同时也为山羊饲养及相应疾病诊断提供科学依据。
1 材料与方法
试验于2017年7月10日至9月25日在西北农林科技大学畜牧生态养殖场人工环控舱进行。
1.1 试验动物和试验设计
选取体况良好,体重相近的1.5岁龄左右的波尔山羊与奶山羊杂交一代羊8只,完全随机分为2个组。试验采用双因素,4×4因子设计,试验温度分4个水平:26℃、30℃、34℃和38℃;RH分4个水平:35%、50%、65% 和80%,共16个处理,每个处理组4只羊,每只羊为1个重复。2组羊分别放入两个环控代谢实验舱内循环进行,每个试验期两个处理组同时进行,共8个试验期。试验前,在自然温湿度下适应30 d,在此期间,对试验羊实施散养和笼养的交替,使山羊适应环控舱及上下代谢笼。试验期将环控舱的温度和RH调至各处理组的试验要求,每组试验期5 d,全天24 h处理,按照处理方式在人工环境控制舱轮流进行试验。各试验期从第1天8:00开始到第6天8:00结束,其中,前2 d在舱内散养,后3 d在代谢笼上饲养。
1.2 饲养管理
人工环控舱的温度和RH自动控制(精度:±1℃、±5%),每天光照时间为7:00—21:00,共14 h。所用饲料采用甘肃元生农牧科技有限公司生产的582育肥羊全混合日粮(饲料生产许可证号:甘饲证(2017)12001)。试验日粮营养含总能17.42 MJ·kg-1,粗蛋白16.29%。试验期间,各山羊自由采食和饮水。各组除温度和RH外其他饲养管理条件均一致。
1.3 样品采集与指标测定
1.3.1 生长性能 分别在试验的第1天和第6天早8:00前空腹称重,依据初重和末重计算肉羊的平均日增重。每天早上8:00和下午6:00分别精确记录各组羊的喂料量和剩料量,记录各组的采食量,计算平均日采食量和料重比。
1.3.2 饮水量的测定 每天早上8:00和下午6:00分别精确量取并记录各组羊的加水量和剩水量,记录各组的饮水量,计算平均日饮水量(注:测量饮水量时,考虑到水在空气中蒸发,备一对照水桶测其蒸发量,以便减少饮水量的误差)。
1.3.3 粪尿量及尿常规的测定 在各组处理的第3天早8:00将肉羊由散养转入代谢笼中,分别在第4、5、6天的早上量取每日各组中每只羊的尿量和每只羊的粪量;取部分粪样称重,放入65℃烘箱12 h后,称重,记录烘干后粪样的重量,最后计算各组中每只羊总的干粪量。在每个处理的第5天用接尿杯接5 mL左右的新鲜的尿液,并在2 h内送检尿液常规指标。
1.3.4 血常规的测定 分别在各组试验的第3和5天清晨7:30喂料前静脉采血5 mL。采血管为5 mL抗凝管,采血后迅速摇动,使全血与抗凝剂充分接触,并在2 h内送检。测定指标有:WBC、RBC、血红蛋白(Hb)、HCT、MCHC、MCH、红细胞平均体积(MCV)和红细胞体积分布宽度(RDW)8个指标。
1.3.5 血清生化指标的测定 分别在各个处理组试验的第3天和第5天清晨7:30喂料前静脉采血10 ml。采血管为5 ml促凝管,采血后迅速摇动,使全血与促凝剂充分接触,静置,待血清析出后,3 000 r/min离心10 min。吸取上清液,分装置于1.5 ml离心管中,-20℃冷冻保存,用于生化指标的检测。血清生化指标: TP、白蛋白(ALB)、球蛋白(GLO)、BUN、葡萄糖(GLU)、总胆固醇(TC)和甘油三酯(TG),血清无机离子:钙(Ca)、磷(P)、钠(Na)、钾(K)和氯(Cl),血清酶: ALT、AST、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)和肌酸激酶(CK)采用试剂盒(上海复星长征医学科学有限公司)测定。
1.3.6 血清抗氧化指标的测定 测定指标有:丙二醛(MDA)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT),采用比色法测定,检测所用试剂盒购于北京华英生物技术研究所。具体操作严格按照使用说明书。
1.4 数据处理与统计
用Excel对试验数据进行初步整理后,采用IBMSPSS Statistics 21.0统计软件中的GLM模块的多因素程序和one-way ANOVA 进行统计分析,以<0.05为显著水平,并采用Duncan氏法进行多重比较。分析平均日增重时把各处理组的体重作为协变量进行分析。
2 结果
2.1 温度和RH对山羊生长性能和饮水量的影响
由表1可知温度和RH对山羊的平均日采食量和平均日饮水量的影响有显著的交互作用(<0.05)。在26℃下时平均日采食量不随湿度的升高而降低,30℃和34℃下时80%时降低,而到38℃时65%即产生降低。30℃,80% RH时,平均日采食量开始显著降低(<0.05),在38℃, 80% RH时,平均日采食量达到最低。在35%、50%和65%下时平均日饮水量随温度的升高而增加,在80%下34℃时显著增加且最高(<0.05)。温度和RH对山羊的平均日增重和料重比的影响无显著的交互作用(>0.05)。温度对山羊的平均日增重有显著影响(<0.05),而温度和RH对山羊料重比影响均不显著(>0.05)。随着温度的升高,平均日采食量和平均日增重减少,平均饮水量升高。38℃山羊平均日采食量和平均日增重显著低于26℃、30℃和34℃(<0.05),平均日增重甚至出现了负增长。随着RH的升高,平均日采食量减少,平均日饮水量先减少后增加。

表1 温度和RH对山羊生长性能的影响
同列数据标不同小写字母表示差异显著(<0.05),相同或无字母表示差异不显著(>0.05)。下同
In the same column, values with different small letters mean significant difference (<0.05), while with the same or no letters mean no significant difference (>0.05). The same as below
2.2 温度和RH对山羊粪尿量及尿常规的影响
由表2可知温度和RH对山羊的尿常规中尿酸碱度的影响有显著的交互作用(<0.05),在26℃、30℃和34℃下时尿酸碱度不随湿度的升高而显著变化,而到38℃,80%RH时,尿酸碱度显著降低(<0.05)。温度和RH对山羊平均日干粪量、平均日排尿量和尿常规中尿比重的影响无显著的交互作用(>0.05)。温度对山羊的平均日干粪量、平均日排尿量及尿常规中尿比重和尿酸碱度均有显著影响(<0.05),34℃和38℃山羊平均日干粪量显著低于26℃和30℃(<0.05);34℃和38℃山羊平均日排尿量显著高于26℃(<0.05);38℃山羊尿比重显著低于26℃和30℃(<0.05)。温度的升高,平均日干粪量和尿常规中尿比重降低,平均日排尿量升高,尿酸碱度先升后降。RH对山羊的平均日干粪量有显著影响(<0.05),而对平均日排尿量和尿比重影响不显著(>0.05)。RH为80%时平均日干粪量显著低于RH为35%、50%和65%时(<0.05)。随着RH升高,平均日干粪量和尿酸碱度减少,平均日排尿量先减少后增加。

表2 温度和RH对山羊干粪量、排尿量、尿比重、尿酸碱度的影响
2.3 温度和RH对山羊血常规的影响
由表3和表4可知,温度和RH对山羊血液中WBC、RBC、Hb、HCT、MCHC、MCH、MCV和RDW的影响在试验第3天和第5天时均无显著交互作用(>0.05)。温度对试验第3天和第5天山羊血液中WBC均有显著影响(<0.05),而对试验第3和5天山羊血液中RBC、Hb、HCT、MCHC、MCH、MCV和RDW均无显著影响(>0.05)。38℃试验第3天山羊血液中WBC显著低于26℃和30℃(<0.05);34℃和38℃试验第5天山羊血液中WBC显著低于26℃(<0.05)。随着温度的升高,山羊血液中WBC和MCV降低,RBC、Hb和RDW升高。RH对试验第3天山羊血液中WBC和Hb及第5天WBC均有显著影响(<0.05),而对试验第3和5天血液中RBC、HCT、MCHC、MCH、MCV和RDW均无显著影响(>0.05)。RH为65%和80%时山羊血液中WBC显著低于RH为35%时(<0.05);RH为65%和80%时试验第3天山羊血液中Hb含量显著高于RH为35%时(<0.05)。随着RH的升高山羊血液中RBC和Hb升高,WBC、MCHC先降低后升高,RDW先升高后降低。试验第5天山羊血液中WBC、RBC、Hb和HCT低于第3天,而试验第5天MCHC高于第3天,MCH、MCV和RDW 随时间的延长基本不变。
2.4 温度和RH对山羊血清生化指标的影响
由表5和表6可知,温度和RH对试验第5天山羊血清TP、ALB、GLO和BUN含量的影响有显著的交互作用(<0.05)。在35%和50%RH下时ALB不随温度的升高而降低,而在65%RH下时30℃降低。在35%和50%RH下时GLO和BUN不随温度的升高而降低,而在65%和80%RH下时GLO随温度的升高而降低,而BUN在30℃降低。温度和RH对GLU、TC和TG含量的影响在试验第3和5天时均无显著交互作用(>0.05)。温度对山羊血清GLU和试验第3天GLO和BUN有显著影响(<0.05)。38℃试验第3天山羊血清GLO和GLU含量显著低于26和30℃(<0.05);38℃试验第5天山羊血清GLU含量显著低于26℃(<0.05);38℃试验第3天山羊血清BUN显著低于26℃、30℃和34℃(<0.05)。温度升高,山羊血清TP、GLO、BUN、GLU以及第5天ALB、TG降低,而第3天ALB和TC升高。RH对试验第3天山羊血清GLU和BUN及第5天GLU含量均有显著影响(<0.05)。RH为80%时试验第3天山羊血清GLU和BUN及第5天GLU含量显著低于RH为35%时(<0.05)。RH升高,山羊血清TP升高,GLU及第3天BUN降低,GLO及第5天TG先升高后降低,第3天TC和TG先降低后升高。除26℃,65%这一组外,其他各组试验第5天山羊血清中TP、ALB、GLO、BUN、GLU、TC和TG含量均低于试验第3天。
由表7可知,温度和RH对试验第3天山羊血清K含量和第5天Ca、P和Na含量有显著的交互作用(<0.05)。在35%和50%RH下时K不随温度的升高而降低,65%和80%下时随温度升高而降低。在35%、50%、60%RH下时Na随温度的升高变化无规律,80%RH下30℃时降低。在26℃和30℃时P随RH的升高变化无规律,34℃和38℃下时随RH升高而降低。试验第3天,38℃,80%RH血清K含量显著低于26℃各处理组。温度和RH对Cl含量的影响在试验第3和5天时均无显著交互作用(>0.05)。温度对试验第3天山羊血清Ca和第5天Na、K和Cl含量均有显著影响(<0.05)。38℃试验第3天山羊血清Ca含量显著低于26℃、30℃和34℃(<0.05);34℃和38℃试验第5天山羊血清K和Cl含量显著低于26℃和30℃(<0.05)。温度升高,山羊血清中第3天Cl和第5天Ca、Na含量降低,血清K及第3天Ca、P和第5天Cl含量先升高后降低。RH对试验第5天K和Cl含量均有显著影响(<0.05)。RH为65%和80%时,试验第5天山羊血清K和Cl含量显著低于RH为35%时(<0.05)。RH升高,血清Cl含量下降,而第5天K含量升高。试验第5天山羊血清中Ca和P含量均低于试验第3天,而时间的延长对血清中Na、K和Cl含量影响不大。

表3 温度和RH对山羊血液血常规指标的影响Ⅰ

表4 温度和RH对山羊血液血常规指标的影响Ⅱ

表5 温度和RH对山羊血清生化指标的影响Ⅰ
由表8可知,温度和RH对试验第3天山羊血清ALT和AST和第5天LDH活性有显著的交互作用(<0.05)。在26℃和30℃时ALT在65%时开始降低,而在34℃和38℃时ALT在50%时开始降低。在35%和50%RH下时AST不随温度的升高而降低,65%RH下时30℃即降低。在35%、50%和65%RH下时LDH不随温度的升高而降低,80%RH下时随温度升高而降低。试验第3天,38℃,50%RH、38℃,65%RH和38℃,80%RH组ALT活性显著低于26℃,35%RH和26℃,50%RH处理组(<0.05);温度和RH对ALP和CK活性的影响在试验第3和5天时均无显著交互作用(>0.05)。温度对试验第3天山羊血清ALP和第5天ALT、AST、ALP和CK活性均有显著影响(<0.05)。38℃试验第3天山羊血清ALP活性显著低于26℃和30℃(<0.05);34℃和38℃试验第5天ALT、AST和CK活性显著低于26℃(<0.05)。温度升高,山羊血清ALT、第3天AST、CK及第5天ALP、LDH活性降低,而第5天AST和CK先降低后升高。RH升高,山羊血清ALP及第3天CK活性降低,LDH及第5天AST和CK升高,第3天ALT和AST先降低后升高。试验第5天山羊血清中ALT和AST活性均低于试验第3天,除26℃,80%组试验第5天山羊血清中ALP和LDH活性均低于试验第3天,而血清CK活性大部分处理组第5天活性要低于第3天。
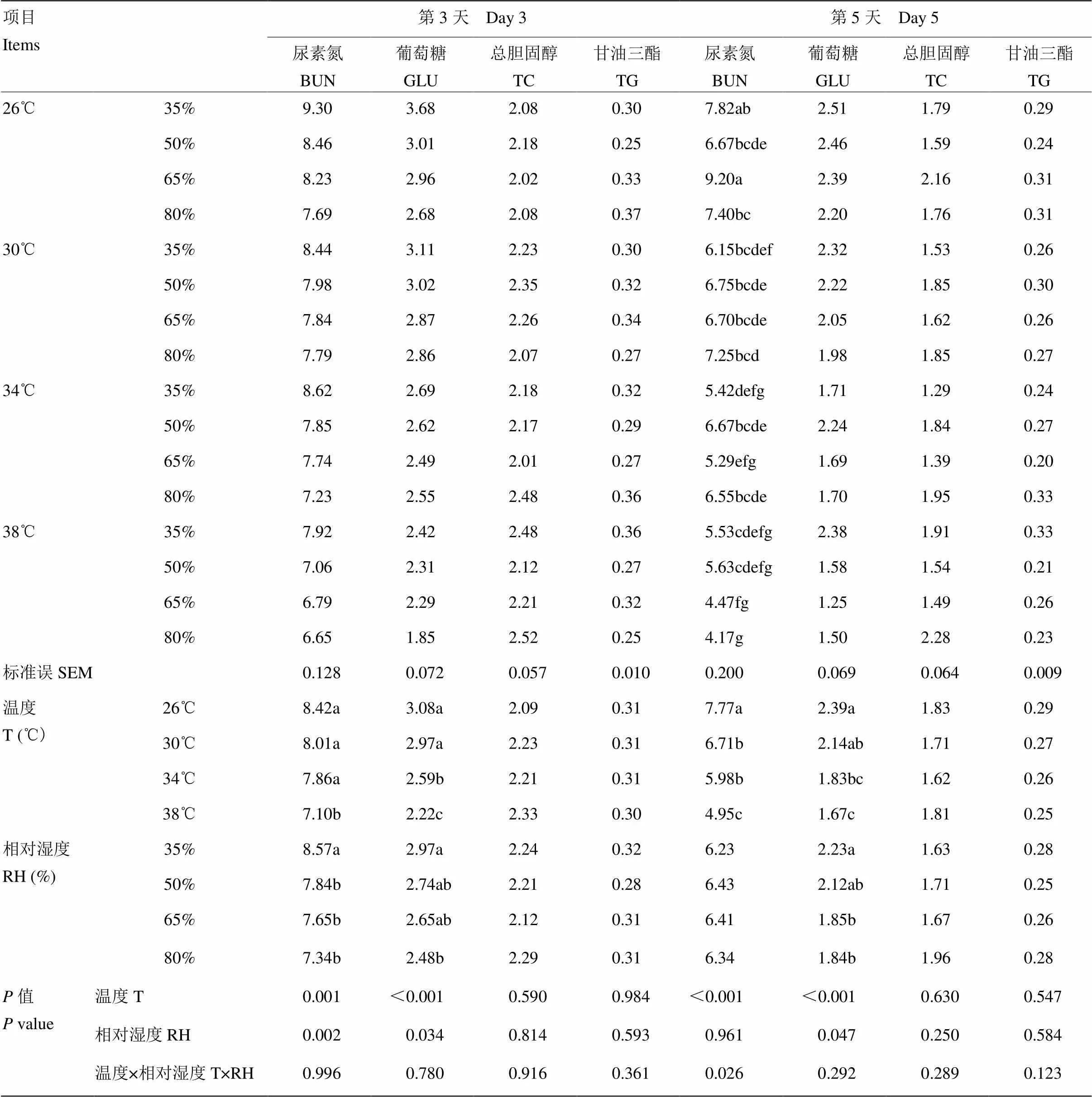
表6 温度和RH对山羊血清生化指标的影响Ⅱ

表7 温度和RH对山羊血清无机离子的影响

表8 温度和RH对山羊血清酶活性的影响

表9 温度和RH对山羊血清抗氧化指标的影响
2.5 温度RH对山羊血清抗氧化指标的影响
由表9可知,温度和RH对试验第3天和第5天山羊血清T-AOC、SOD、GSH-Px和CAT浓度均有显著的交互作用(<0.05)。第3天,在35%RH下温度为34℃时T-AOC和GSH-Px开始降低,而在50%、65%和80%RH时温度在30℃即降低;第5天,在35%和50%RH下T-AOC不随温度升高而降低,而在65%和80%RH时温度在34℃降低。在35%和50%RH下CAT不随温度升高而降低,而在65%和80%RH下在34℃开始降低。在相同湿度下,山羊血清SOD随温度的升高而降低,温度越高,RH越高,SOD浓度越低。试验第3天时,34和38℃各处理组T-AOC和SOD活性显著低于26℃各处理组(<0.05);38℃,65%RH和38℃,80%RH组GSH-Px活性显著低于26℃各处理组(<0.05);38℃,80%RH组CAT活性显著低于26℃和30℃各处理组(<0.05)。试验第5天,38℃,80%RH组T-AOC活性显著低于其他处理组;38℃,50%RH、38℃,65%RH、38℃,80%RH和34℃,80%RH组SOD活性显著低于26和30℃各处理组(<0.05);38℃,80%RH组GSH-Px活性显著低于26℃各处理组(<0.05);38℃,65%RH和38℃,65%RH组CAT活性显著低于其他处理组(<0.05)。温度和RH对试验第3天和第5天山羊血清MDA无显著的交互作用(<0.05)。温度对试验第3天和第5天山羊血清MDA均有显著影响(<0.05)。34℃和38℃血清MDA浓度显著高于26℃(<0.05)。温度升高,MDA浓度升高,T-AOC、SOD、CAT及第3天GSH-Px浓度降低。RH对试验第5天山羊血清MDA有显著影响(<0.05)。RH为80%时MDA浓度显著高于RH为35%和50%时(<0.05)。RH升高,MDA浓度升高,T-AOC、GSH-Px及第5天SOD浓度降低。试验第5天山羊血清中MDA浓度高于试验第3天,试验第5天山羊血清中T-AOC、SOD、GSH-Px和CAT浓度在26℃和30℃处理组大部分低于第3天,34℃和38℃处理组大部分高于第3天。
3 讨论
3.1 温度和RH对山羊生长性能和饮水量的影响
环境温度和RH是动物与其生存环境保持平衡的重要因素,动物在适宜环境范围中,能维持正常生长性能。当环境温度逐渐升高或环境温度与RH都较高时,畜禽的采食中枢受到抑制,维持需要的能量降低,从而导致采食量下降,以此来维持机体热平衡[7]。同时,活动减少,饮水量增加,生长缓慢,甚至出现负增长等反应。
有研究发现,热应激期内西杂牛、地方黄牛和犏牛单位体重干物质采食量和平均日增重均有不同程度的降低[8]。CHAIDANYA等[9]研究发现,与21℃相比,27℃持续六周能显著降低山羊的体重,但对日采食量无显著影响。马燕芬等[10]研究发现,热应激显著降低奶山羊干物质采食量、乳品质及其生长性能。本试验研究发现,温度和RH对山羊的平均日采食量和平均日饮水量的影响有显著的交互作用。随着温度和RH的升高,山羊的平均日采食量显著降低,30℃,80%RH平均日采食量开始下降明显,平均日增重也降低甚至出现负增长,而料重比的变化不显著。本试验结果与热应激处理结果基本一致。造成采食量减少的原因可能是其为了减少因采食带来的热增耗而自觉的减少采食[11-12]。另外,本研究还发现,温度和RH对山羊饮水量影响显著,温度升高,平均日饮水量增多,RH升高,平均日饮水量先减少后增多,这可能是其通过调节饮水量来缓解温度和RH带来的应激。
3.2 温度和RH对山羊粪尿量及尿常规的影响
动物在适宜环境范围中,动物的粪尿量和尿常规处于正常的范围内,当受到外界刺激时,粪尿量和尿常规能够间接的反应动物的生理状态。温度和RH对动物的粪尿量和尿常规的影响的研究罕见。考虑到本试验的处理条件为不同温湿度,为减小试验误差,粪量为干粪量。随着温度和RH的升高,平均日干粪量显著降低,这可能与采食量的降低有关。温度和RH的交互作用对平均排尿量影响不大,但平均日排尿量随温度的升高显著升高,这可能与饮水量增加有关。温度和RH对山羊的尿常规中尿酸碱度的影响有显著的交互作用。尿比重随温度升高而降低,尿酸碱度随RH的升高而降低,这可能是因饮水量增加而产生的影响。尿常规中的其他指标未能检测,有待进一步地研究。
3.3 温度和RH对山羊血常规的影响
动物体内环境平衡与否、健康状态和生产性能高低等综合因素可以通过血常规来反映。一旦外界环境发生变化,就会迫使动物体内调节功能做出相应调节,从而引起血液成分的改变和一系列的代谢调整。热应激使动物体内平衡机制改变,导致红细胞生成受阻。高温环境动物通过增加呼吸频率增加耗氧量,进而增加血液中氧分压,减少红细胞生成,进而减少RBC、PCV和Hb含量[13]。
有研究发现,在热应激状态下试验牛血液的RBC、MCH、PCV、MCHC、WBC等5项指标与无热应激差异显著[5]。侯引绪等[14]研究发现,在中度热应激下,荷斯坦牛RBC、MCHC、PCV与无热应激组差异显著,WBC、MCHC与无热应激组差异极显著。顾剑[15]研究发现,热应激对长毛兔WBC和RBC影响不显著。有研究发现,热应激时,山羊WBC略有下降,RBC变化不显著[6]。本试验发现,温度和RH及二者的相互作用对PCV、MCH、MCHC、MCV和RDW影响不显著。温度升高,山羊血液中WBC和MCV降低,RBC、Hb和RDW升高。38℃试验第3天山羊血液中WBC显著低于26℃和30℃(<0.05);34℃和38℃试验第5天山羊血液中WBC显著低于26℃(<0.05)。RH升高山羊血液中WBC、MCHC先降低后升高,RBC和Hb升高,RDW先升高后降低。RH为65%和80%时,试验第3天和第5天山羊血液中WBC显著低于RH为35%时(<0.05);RH为65%和80%时,试验第3天山羊血液中Hb含量显著高于RH为35%时(<0.05)。这与上述研究有差异,可能与物种、试验处理等不同有关系。另外,试验第5天山羊血液中WBC、RBC、Hb和HCT低于第3天,而试验第5天MCHC高于第3天。这说明热处理时间的长短也会对山羊的血液指标产生影响。
3.4 温度和RH对山羊血清生化指标的影响
血清中的TP、ALB和GLO含量是反映机体非特异性体液免疫及功能的的重要指标。本试验发现,温度和RH对试验第5天山羊血清TP、ALB和GLO含量的影响有显著的交互作用。温度升高,山羊血清TP、GLO以及第5天ALB降低,第3天ALB升高。温度对试验第3天山羊血清GLO含量有显著影响,38℃时山羊血清GLO含量显著低于26℃和30℃。RH升高,山羊血清TP升高。试验第5天山羊血清中TP、ALB和GLO含量大部分低于试验第3天。有研究表明,RH及温度和RH的交互作用对肉仔鸡血清蛋白含量的影响不显著,温度对试验第7天肉仔鸡的血清GLO含量有显著影响,26℃显著高于31℃[4]。伍晓雄等[6]研究发现,热应激对山羊血清中TP含量影响不显著。这与本试验结果基本一致。血清中TP、GLO和ALB的下降可能与高温高湿下山羊采食量减少,摄入蛋白含量不足,蛋白质代谢发生改变有关,这也可能成为山羊发病率提高的原因之一。
动物代谢活动时,GLU能快速有效的供能。正常情况下,动物体内的血糖含量处于稳定的动态平衡状态,受到应激时,血糖含量发生变化。另外,BUN是蛋白质分解代谢的产物,动物机体蛋白质的代谢变化的情况由血清中BUN含量直接反映出来,当蛋白质代谢良好时,其含量较低。血液中BUN的含量也与肾功能变化有重要关系,是检验肾功能的重要指标。有研究发现,热应激使肉牛血清中BUN含量降低[16]。Scharf等[17]研究发现,在急性热应激时肉牛血清中GLU含量会升高,而在慢性热应激时会降低。伍晓雄等[6]研究发现,热应激对山羊血清中GLU含量有一定程度的上升。本试验发现,温度和RH对试验第5天山羊血清BUN含量的影响有显著的交互作用;而对GLU含量的影响在试验第3和5天时均无显著交互作用(>0.05)。温度对试验第3天和第5天山羊血清BUN和GLU含量均有显著影响,温度升高,山羊血清BUN、GLU降低。38℃时山羊血清BUN和GLU含量显著低于26℃;RH对试验第3天山羊血清BUN和GLU及第5天GLU含量均有显著影响,RH升高,山羊血清GLU及第3天BUN降低。RH为80%时显著低于RH为35%时。另外,试验第5天山羊血清中BUN和GLU含量大部分低于试验第3天。这可能是山羊在高温高湿状态下采食量降低引起的。同时,高温高湿的状态,山羊体内糖代谢增强,耗能加快,能量贮存减少,从而引起血糖降低,蛋白质代谢增强,BUN降低。
TG和TC是血脂的主要成分,机体内脂类代谢水平由血脂含量的高低来表现。有研究发现,热应激对长毛兔血清中TG和TC影响显著[15]。本试验中温度、RH及二者的交互作用对山羊血清TG和TC影响不显著,温度升高,山羊血清第5天TG降低,第3天TC升高。试验第5天山羊血清中TC和TG含量大部分低于试验第3天。这可能是因为山羊与长毛兔相比,抗逆性比较强。另外,不同物种,不同处理方式和时间也会有影响。
血清中的无机离子对动物机体的内环境平衡、凝血、排泄等过程都有重要的意义。有研究发现,山羊在热应激下,血清Na+和K+含量升高[18]。魏学良等[19]研究发现,奶牛在热应激状态下,血清中Na+降低,Cl-和K+升高。SUNIL等[20]研究发现,长期热应激使血清中K+含量下降。也有研究表明,高温可引起荷斯坦牛血清K和P水平明显上升,Na、Ca含量变化不显著[21]。本试验发现,温度和RH对试验第3天山羊血清中K含量和第5天山羊血清Ca、P、Na和K含量的影响均有显著的交互作用;温度对试验第3天山羊血清Ca和第5天山羊血清Ca、Na、K和Cl含量有显著影响,温度升高,山羊血清Ca、P、Na、K和Cl含量呈降低趋势,且38℃时山羊血清Ca、P、Na、K和Cl含量显著低于26℃;RH升高,血清Cl含量下降,第5天K含量升高,RH对试验第5天山羊血清Cl含量影响显著,RH为65%和80%时显著低于RH为35%时。另外,试验第5天山羊血清中Ca和P含量均低于试验第3天。
血清中无机离子发生变化的原因可能是高温高湿使山羊的采食量显著下降、饮水量增加、排尿量明显增加引起的。另外,高温高湿干扰了小肠黏膜上皮对钙的转运[22]。高温高湿时,由于动物血液中H+和HCO3-浓度明显下降,造成酸碱平衡失调,大量有机酸由机体分泌,血液中的 pH值降低,有机酸与Ca、P等离子结合,最终使其浓度降低。环境温度突然升高,导致山羊机体的呼吸中枢兴奋,呼吸加快加深, CO2排出量增多,最终发生呼吸性碱中毒。此时肾小管保酸排钾,细胞内的氢离子与细胞外的K+交换,导致K+含量稍微有所降低。
高温高湿可引起动物机体代谢机能和酶活性发生改变,造成机体组织不同程度的损伤。在正常情况下,细胞内酶由于细胞膜的屏障作用不易逸出,处于较稳定的状态,由于细胞的不断更新破坏而少量释放进入血液[23],而在应激情况下细胞受到损伤和刺激,细胞膜的通透性增大致使其释放进入血液的速度加快,血清酶含量发生变化。
ALT和AST不仅对氨基酸的合成与分解代谢非常重要,而且能够衡量肝脏的重要功能,有助于动物疾病的诊断。ALT和AST浓度与热应激程度关系密切[24]。在正常情况下,ALT和AST是在肝细胞内,不易逸出,当高温高湿时,由于畜禽机体内细胞受到损伤,细胞膜的通透性增大,ALT和AST渗透而进入血液。ALP的活性与骨骼形成关系密切,ALP的含量与成骨细胞的活性成正比,在正常情况下与骨胶原蛋白的形成、骨盐沉积以及动物生长发育有关,这是高温高湿导致畜禽生长性能下降的一个原因。LDH几乎存在于所有组织中,是体内代谢过程中一个很重要的酶。由于组织中的LDH的活力比血浆中高得多,因此少量组织受损伤时,LDH释放入血液使在血液中LDH活力升高。CK是反映动物热应激状态的敏感指标,当动物处于热应激状态时,肌肉能量供应不足、细胞膜磷脂层被氧化而使细胞膜通透性增加进而使CK溢于胞外,使外周血CK浓度明显增加。因此,LDH和CK可以用来诊断应激[25]。
有研究发现,热应激状态下肉牛血清LDH活性显著升高,对ALT、AST、CK和ALP活性影响不显著[26]。在泌乳期绵羊中发现,血清中的ALT、AST、CK和LDH在急性热应激时显著升高,然后恢复正常水平,CK未发生显著变化[27]。Helal等[28]研究发现,热应激使ALP和LDH活性降低。Sharma等[29]研究发现,山羊受热应激时血清ALT含量降低,AST含量变化不显著。Ocak等[30]研究发现,热应激对山羊血清AST含量影响不显著。本试验发现,温度和RH对试验第3天山羊血清ALT和AST活性和第5天LDH活性的影响有显著的交互作用,试验第3天,38℃,50%RH、38℃,65%RH和38℃、80%RH组ALT活性显著低于26℃,35%RH和26℃,50%RH处理组。温度对试验第3天山羊血清ALP和第5天ALT、AST、ALP和CK活性均有显著影响,温度升高,山羊血清ALT、第3天AST、CK及第5天ALP、LDH活性降低。38℃山羊血清ALP活性显著低于26℃和30℃;34℃和38℃ALT、AST和CK活性显著低于26℃。RH升高,山羊血清ALP及第3天CK活性降低,而LDH及第5天AST和CK升高。这说明高温高湿下,不同动物的机体组织受到影响程度不同。另外,试验第5天山羊血清中ALT、AST、ALP、LDH和CK活性大部分组低于试验第3天。
3.5 温度和RH对山羊血清抗氧化指标的影响
动物机体内活性氧(ROS)的产生、利用与清除维持着动态平衡,当机体ROS产生与抗氧化系统失衡时,可引起氧化应激,造成机体组织细胞及蛋白质和核酸等生物大分子损伤[31]。当动物受到热应激侵害时,机体内的CAT、GSH-Px、SOD的活性受到影响影响机体抗氧化系统,导致机体ROS的产生与抗氧化系统失衡[32]。
T-AOC是机体防御体系的抗氧化能力,MDA是在脂质过氧化过程中产生的脂质过氧化产物,二者是衡量机体抗氧化系统功能状况的综合性指标[33]。SOD是对机体的氧化与抗氧化平衡起着关键作用的一种重金属酶。SOD和CAT、GSH-Px可以清除超氧阴离子自由基,起到抗炎作用,反映机体清除氧自由基的能力[34]。有研究发现,夏季与冬季相比,血清中SOD和GSH-Px显著降低[35]。在家禽的研究中表明,热应激会显著降低肉鸡血清中GSH-Px和T-AOC的活性[36]。刁华杰等[37]在日循环高温对蛋鸡的研究发现,低循环温度组仅显著影响血清T-AOC水平,而高循环温度组显著降低血清T-AOC水平以及血清中GSH-Px活性。热应激期,肉牛血清T-AOC、SOD及GSH-Px含量均降低,而MDA含量升高[26]。Kumar等[38]研究发现,热应激使山羊血清SOD水平升高。本试验发现,温度和RH对试验第3天和第5天山羊血清T-AOC、SOD、GSH-Px和CAT均有显著的交互作用。试验第3天时,38℃,80%RH组T-AOC、SOD、GSH-Px和CAT显著低于26℃各处理组;试验第5天,38℃,80%RH组T-AOC、SOD、GSH-Px活性显著低于26℃各处理组。温度和RH对山羊血清MDA无显著的交互作用。温度升高,MDA浓度升高,T-AOC、SOD、CAT及第3天GSH-Px浓度降低,34℃和38℃血清MDA浓度显著高于26℃。RH升高,MDA浓度升高,T-AOC、GSH-Px及第5天SOD浓度降低,RH为80%时MDA浓度显著高于RH为35%和50%时。另外,试验第5天山羊血清中MDA浓度高于试验第3天。这说明山羊在高温高湿环境下抗氧化能力受到了影响,机体ROS的产生与抗氧化系统失衡。
4 结论
4.1 温度、相对湿度及二者交互作用不同程度地影响山羊平均日采食量、平均日饮水量、血清生化指标和抗氧化指标。
4.2 温度升高,山羊平均日采食量、平均日增重、平均日干粪量、尿比重、血液中白细胞数和红细胞平均体积、血清总蛋白、球蛋白、尿素氮、葡萄糖、谷丙转氨酶、总抗氧化能力、超氧化物歧化酶、过氧化氢酶以及第3天Cl、谷草转氨酶、肌酸激酶、谷胱甘肽过氧化物酶和第5天白蛋白、甘油三酯、Ca、Na、碱性磷酸酶、乳酸脱氢酶降低,而平均日饮水量、平均日排尿量、血液中红细胞数、血红蛋白和红细胞体积分布宽度、血清中丙二醛及第3天白蛋白、总胆固醇升高。
4.3 相对湿度升高,平均日采食量、平均日干粪量、尿酸碱度、血清葡萄糖、Cl、碱性磷酸酶、总抗氧化能力、谷胱甘肽过氧化物酶及第3天尿素氮、肌酸激酶和第5天超氧化物歧化酶浓度降低,而血液红细胞数和血红蛋白、血清总蛋白、乳酸脱氢酶、丙二醛升高及第5天K、谷草转氨酶、肌酸激酶升高。
4.4 试验第5天血液白细胞数、红细胞数、血红蛋白、红细胞压积及血清总蛋白、白蛋白、球蛋白、尿素氮、葡萄糖、总胆固醇、甘油三酯、Ca、P、谷丙转氨酶、谷草转氨酶、碱性磷酸酶、乳酸脱氢酶和肌酸激酶大多组低于试验第3天,而血清抗氧化指标丙二醛高于试验第3天,总抗氧化能力、超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶在34℃和38℃时高于第3天。
总之,高温高湿环境不利于山羊的生长性能和机体抗氧化功能,其中,温度为38℃,相对湿度为80%时,山羊受到的影响最大。
[1] COLLIER R J, BEEDE D K, THATCHER W W, ISRAEL L A, WILCOX C J. Influences of environment and its modification on dairy animal health and production., 1982, 65(11): 2213-2227.
[2] RAVAGNOLO O, MISZTAL L, HOOGENBOOM G. Genetic component of heat stress in dairy cattle, development of heat index function., 2000, 83(9): 2120-2125.
[3] COLLIER R J, RENQUIST B J, XIAO Y. A 100-year review: Stress physiology including heat stress., 2017, 100(12): 10367-10380.
[4] 张少帅, 李萌, 李香, 周莹, 冯京海, 张敏红. 相对湿度和间歇性偏热处理对肉仔鸡免疫功能的影响. 动物营养学报, 2017, 29(1): 80-87.
ZHANG S S, LI M, LI X, ZHOU Y, FENG J H, ZHANG M H. Effects of relative humidity and intermittent partial heat temperatures on immune functions of broilers., 2017, 29(1): 80-87. (in Chinese)
[5] 雷虹, 龙云, 蔡文杰, 李晟, 伍佰鑫, 李昊帮, 孙鏖, 龙梦晴. 热应激对湘西黄牛常规血液生化指标的影响. 湖南畜牧兽医, 2016(1): 38-40.
LEI H, LONG Y, CAI W J, LI S, WU B X, LI H B, SUN A, LONG M Q. Effects of heat stress on routine blood biochemical indexes of xiangxi yellow cattle., 2016(1): 38-40. (in Chinese)
[6] 伍晓雄, 张雄民, 赵京杨, 杨世锦, 徐小兰. 热应激对山羊生理生化指标的影响. 家畜生态学报, 2000, 21(3): 7-9.
WU X X, ZHANG X M, ZHAO J Y, YANG S J, XU X L. Effects of heat stress on physiological and biochemical indexes of goats., 2000, 21(3): 7-9. (in Chinese)
[7] DEMO M, JENTSCH W, SCHWEIGEL M, KUHLA S, METGES C C, MATTHES H D. Measurements of heat production for estimation of maintenance energy requirements of Hereford steers., 2005, 83(11): 2590-2597.
[8] 蒲启建, 王之盛, 彭全辉, 张灿, 景小平, 胡瑞, 邹华围. 热应激对不同品种(系)青年肉牛生产性能、营养物质表观消 化率及血液生化指标的影响. 动物营养学报, 2017, 29(9): 3120-3131.
PU Q J, WANG Z S, PENG Q H, ZHANG C, JING X P, HU R, ZOU H W. Effects of heat stress on performance, nutrient apparent digestibility and blood biochemical indices of different breeds of young beef cattle., 2017, 29(9): 3120-3131. (in Chinese)
[9] CHAIDANYA K, SOREN N M, SEJIAN V, BAGATH M, MANJUNATHAREDDY G B, KURIEN E K, VARMA G, BHATTA R. Impact of heat stress, nutritional stress and combined (heat and nutritional) stresses on rumen associated fermentation characteristics, histopathology and HSP70 gene expression in goats., 2017, 5(2): 36-48.
[10] 马燕芬, 杜瑞平, 高民. 热应激对奶山羊生产性能及瘤胃上皮细胞形态结构的影响. 中国农业科学, 2013, 46(21): 4486-4495.
MA Y F, DU R P, GAO M. Effect of heat stress on dairy goat performance and rumen epithelial cell morphology., 2013, 46(21): 4486-4495. (in Chinese)
[11] MARAI I F M, EL-DARAWANY A A, FADIEL A, ABDEL-HAFEZ M A M. Physiological traits as affected by heat stress in sheep-A review., 2017, 71(1/3): 1-12.
[12] GARNER J B, DOUGLAS M, WILLIAMS S R O, WALES W J, MARETT L C, DIGIACOMO K, LEURY B J, HAYE B J. Responses of dairy cows to short-term heat stress in controlled-climate chambers., 2017, 57(7): 1233-1241.
[13] BELHADJ SLIMEN I, NAJAR T, GHRAM A, ABDRRABBA M. Heat stress effects on livestock: molecular, cellular and metabolic aspects, a review., 2016, 100(3): 401-412.
[14] 侯引绪, 张凡建, 魏朝利. 中度热应激对荷斯坦牛部分血液生化指标的影响. 中国奶牛, 2013(1): 11-13.
HOU Y X, ZHANG F J, WEI C L. Effects of moderate heat stress on some blood biochemical indexes of Holstein cows., 2013(1): 11-13. (in Chinese)
[15] 顾剑. 热应激对长毛兔生产性能及生理生化指标的影响. 现代农业科技, 2016(21): 239-240.
GU J. Effects of heat stress on production performance and physiological and biochemical indexes of angora rabbit., 2016(21): 239-240. (in Chinese)
[16] 宋小珍, 付戴波, 瞿明仁, 杨食堂, 刘道杨, 徐振松. 热应激对肉牛血清内分泌激素含量、抗氧化酶活性及生理生化指标的影响. 动物营养学报, 2012, 24(12): 2485-2490.
SONG X Z, FU D B, QU M R, YANG S T, LIU D Y, XU Z S. Effects of heat stress on endocrine hormone content, antioxidant enzyme activity and physiological and serum biochemical indices of beef cattle., 2012, 24(12): 2485-2490. (in Chinese)
[17] SCHARF B, CARROLL J A, RILEY D G, CHASE C C, JR., COLEMAN S W, KEISLER D H, WEABER R L, SPIERS D E. Evaluation of physiological and blood serum differences in heat-tolerant (Romosinuano) and heat-susceptible (Angus) Bos Taurus cattle during controlled heat challenge., 2010, 88(7): 2321-2336.
[18] KALIBER M, KOLUMAN N, SILANIKOVE N. Physiological and behavioral basis for the successful adaptation of goats to severe water restriction under hot environmental conditions., 2016, 10(1): 82-88.
[19] 魏学良, 张家骅, 王豪举, 晏梅, 孙凤清, 杨铭惠, 尹思明. 高温环境对奶牛生理活动及生产性能的影响. 中国农学通报, 2005, 21(5): 13-15.
WEI X L, ZHANG J H, WANG H J, YAN M, SUN F Q, YANG M H, YIN S M. Hot weather exercise’s effect on physiological and performance of cow., 2005, 21(5): 13-15. (in Chinese)
[20] SUNIL K B V, AJEET K, MEENA K. Effect of heat stress in tropical livestock and different strategies for its amelioration., 2011, 7(1): 45-54.
[21] 赵宗胜, 米拉古丽, 江华, 何高明. 冷、热应激对奶牛血液生理生化指标影响. 中国奶牛, 2011(22): 18-22.
ZHAO Z S, MI R G L, JIANG H, HE G M. Effect of cold and heat stress on the blood physiological and biochemical indexes of cows., 2011(22): 18-22. (in Chinese)
[22] NEJAD J G, OSKOUIAN E, KIM B-W, LEE B-H, SUNG K-I. Microbial nitrogen production, nitrogen balance and excretion of urinary purine derivatives in Corriedale ewes under water deprivation., 2017, 17(2): 517-527.
[23] INBARAJ S, SEJIAN V, BAGATH M, BHATTA R. Impact of heat stress on immune responses of livestock: a review., 2016, 39 (4): 459-482.
[24] RATHWA S D, VASAVA A A, PATHAN M M, MADHIRA S P, PATEL Y G, PANDE A M. Effect of season on physiological, biochemical, hormonal, and oxidative stress parameters of indigenous sheep., 2017, 10(6): 650-654.
[25] SINGH K M, SINGH S, GANGULY I, NACHIAPPAN R K, GANGULY A, VENKATARAMANAN R, CHOPRA A, NARULA H K. Association of heat stress protein 90 and 70 gene polymorphism with adaptability traits in Indian sheep (Ovis aries)., 2017, 22(5): 675-684.
[26] 胡煜, 蔡明成, 王玲, 谭林, 毕武, 张佳卉, 左福元. 热应激状态下牛血清生化指标、miRNA表达变化及其相关性分析. 畜牧兽医学报, 2016, 47(9): 1840-1847.
HU Y, CAI M C, WANG L, TAN L, BI W, ZHANG J H, ZUO F Y. The serum biochemical indexes and miRNA expression in cattle under heat stress and their correlation analysis., 2016, 47(9): 1840-1847. (in Chinese)
[27] HRKOVIC-POROBIJA A, HODZIC A, HADZIMUSIC N. Functional liver stress in dairy sheep., 2017, 23(2): 194-197.
[28] HELAL A, HASHEM A L S, ABDEL-FATTAH M S, EL-SHAER. Effects of heat stress on coat characteristics and physiological responses of Balady and Damascus goat in Sinai Egypt., 2010, 7(1): 60-69.
[29] SHARMA A K, KATARIA N. Effect of extreme hot climate on liver and serum enzymes in marwari goats., 2011, 81(3): 293-295.
[30] OCAK S, DARCAN N, ÇANKAYA S, INAL T C. Physiological and biochemical responses in German Fawn kids subjected to cooling treatments under Mediterranean climate conditions., 2009, 33(6): 455-461.
[31] HALLIWELL B, WHITEMAN M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean., 2004, 142(2): 231-255.
[32] 张轶凤, 齐智利. 热应激条件下机体发生氧化应激的机制. 动物营养学报, 2017, 29(9): 3051-3058.
ZHANG Y F, QI Z L. Mechanism of oxidative stress in body under heat stress., 2017, 29(9): 3051-3058. (in Chinese)
[33] GUPTA M, KUMAR S, DANGI S S, JANGIR B L. Physiological, biochemical and molecular responses to thermal stress in goats., 2013, 3(2): 27-38.
[34] CONG X, ZHANG Q, LI H, JIANG Z, CAO R, GAO S, TIAN W. Puerarin ameliorates heat stress–induced oxidative damage and apoptosis in bovine Sertoli cells by suppressing ROS production and upregulating Hsp72 expression., 2017, 88(1): 215-227.
[35] CHETIA M, SARMA S, NATH R, TAMULY S. Studies on the seasonal variations in the antioxidant enzymes in Indian zebu cattle., 2017, 5(2): 1362-1365.
[36] 李文立, 路静, 孙振钧, 姜建阳, 李方正, 任慧英. 谷氨酰胺对热应激肉鸡抗氧化性能的影响. 动物营养学报, 2011, 23(4): 695-702.
LI W L, LU J, SUN Z J, JIANG J Y, LI F Z, REN H Y. Effects of glutamine on antioxidant function of broilers under heat stress., 2011, 23(4): 695-702. (in Chinese)
[37] 刁华杰, 冯京海, 王雪洁, 刁新平. 日循环高温对蛋鸡抗氧化能力及免疫机能的影响. 畜牧兽医学报, 2017, 48(6): 1044-1053.
DIAO H J, FENG J H, WNG X J, DIAO X P. Effect of cyclic high temperature on antioxidant capacity and immune function of laying hens., 2017, 48(6): 1044-1053. (in Chinese)
[38] KUMAR M, JINDAL R, NAYYAR S, SINGLA M. Physiological and biochemical responses in Beetal goats during summer season., 2010, 16(1): 255-257.
Effects of Temperature and Relative Humidity on the Growth Performance and Blood Index of Goats
LI JinPeng, WANG GuoJun, ZHAO Tian, ZHOU GuangChen, YANG YuXin
(College of Animal Science and Technology, Northwest A&F University, Yangling 712100, Shaanxi)
【Objective】The objective of this study was to provide a theoretical reference for breeding disease diagnosis and mitigation measures for goats under high temperature and high humidity condition. This study was carried out to investigate the effects of temperature and relative humidity (RH) on growth performance, routine urine, blood routine and serum biophysiological- biochemical indexes in goats. 【Method】According to 4×4 factorial design of four temperatures (26℃, 30℃, 34℃ and 38℃ ) and four RH levels (35%, 50%, 65% and 80%), eight goats of one and a half years old from first filial generation of healthy Boer goat × Sannen dairy goat with similar body weight were allotted, and randomly divided into 2 groups (each group contained four replicates with one goat per replicate). The adjustment period lasted for 30 days in the natural environment. The experiment period of every group was 5 days and was treated 24 hours a day. And the experiment was carried out by turns in artificial environment chambers according to the processing method. Every goat’s weight was recorded before and after trial begin, and feed intake and water intake were also recorded every day. On days 3 and 5, blood was drawn from the jugular vein to determine the blood routine, and the serum samples were used to determine the serum indexes. Data were analyzed using IBM SPSS Statistics 21.0 software.【Result】(1) The interaction of temperature and RH significantly affected average daily feed intake (ADFI) and average daily water intake (ADWI) (<0.05), but no significantly affected on average daily gain (ADG), weight ratio and blood routine indexes (>0.05). ADG of goats at every treatment group of 38℃ was significantly lower than that at every treatment group of 26℃(<0.05). ADFI of goats at 38℃ was significantly lower than that at 26℃and 30℃(<0.05).The white blood cell counts (WBC) of goats at 65% and 80% RH were significantly lower than those at 35% RH(<0.05). (2) On day 3, the interaction of temperature and RH significantly affected content of potassium (K), activity of alanine aminotransferase (ALT), and aspertate aminotransferase (AST) in serum of goats (<0.05). The content of K in serum of goats at 38°C and 80% RH was significantly lower than that at other groups (<0.05). The glucose (GLU), globulin (GLO), urea nitrogen (BUN), calcium (Ca) and alkaline phosphatase (ALP)in serum of goats at 38℃ was significantly lower than that at 26℃and 30℃(<0.05). The GLU and BUN in serum of goats at 80% RH was significantly lower than that at 35% RH (<0.05).On the day 5 , the interaction of temperature and RH significantly affected content of total protein (TP), albumin (ALB), GLO, BUN, Ca, K, phosphorus (P), sodium (Na) and activity of lactate dehydrogenase (LDH) in serum of goats (<0.05). The GLU, chlorine (Cl), ALT, AST, ALP and creatine kinase (CK)in serum of goats at 34 and 38℃ was significantly lower than that at 26℃(<0.05). The GLU and Cl in serum of goats at 60% and 80% RH were significantly lower than those at 35% RH (<0.05). (3) On the day 3 and 5, the concentrations of total antioxidant capacity (T-AOC), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and catalsae (CAT) in serum of goats at 38℃, 80% and 38℃, 65% were significantly lower than those at every group at 26℃(<0.05). The concentration of malonaldehyde (MDA) in serum of goats at 34 and 38℃ was significantly higher than that at 26℃(<0.05).(4)As the temperature rose, the ADFI, ADG, TP, GLO, BUN, GLU, ALT, T-AOC, SOD and CAT in serum were deceased, but average daily water intake and MDA in serum were risen. As the RH rose, the ADFI, GLU, Cl, T-AOC and GSH-Px in serum were deceased, but TP, LDH and MDA in serum were risen. (5) The TP, ALB, GLO, BUN, GLU, TC, TG, Ca, P, ALT, AST, ALP, LDH and CK in serum on the day 5 was lower than that on the day 3, but the MDA in serum was higher on the day 3 and T-AOC, SOD and GSH-Px in serum on day 5 in 34 and 38℃was higher on day 3.【Conclusion】Temperature, RH and their interaction affected the average daily intake, average daily water intake, serum biochemical indicators and antioxidant indicators of goats. The high temperature and high humidity environment had adverse effects on the growth performance and antioxidation function of goats, and the effect was the most serious for the goats at 38℃ with 80% RH. Moreover, with the extended duration of higher temperature and humidity, the goats showed more extensive stress effect.
temperature; relative humidity; goats; growth performance; serum biophysiological-biochemical indicators;antioxidant indicators
10.3864/j.issn.0578-1752.2018.23.014
2018-02-26;
2018-08-17
国家重点研发计划(2016YFD0500508)、国家绒毛用羊产业技术体系(CARS-39-12)
李金朋,E-mail:610831703@qq.com。
杨雨鑫,E-mail:yangyuxin2002@126.com
(责任编辑 林鉴非)
