白喉和破伤风类毒素抗原ELISA检测方法的建立
2018-12-11谭亚军夏德菊李喆晁哲田霖董国霞侯启明马霄
谭亚军,夏德菊,李喆,晁哲,田霖,董国霞,侯启明,马霄
白喉和破伤风类毒素抗原ELISA检测方法的建立
谭亚军,夏德菊,李喆,晁哲,田霖,董国霞,侯启明,马霄
100050 北京,中国食品药品检定研究院百白破疫苗与毒素室/卫生部生物技术产品检定方法及其标准化重点实验室
建立定量检测白喉和破伤风类毒素抗原的酶联免疫吸附试验(ELISA)方法。
分别采用白喉、破伤风单抗包被酶标板,兔抗白喉、破伤风多抗作为二抗,辣根过氧化物酶标记的羊抗兔 IgG 抗体作为酶标抗体,以平行线法建立定量检测白喉和破伤风类毒素抗原含量的夹心 ELISA 法,并进行方法学验证。
两种定量检测 ELISA 方法的验证结果均符合规定。检测白喉类毒素抗原 ELISA 方法的定量限为 8.90 ×10-4Lf/ml,回收率为 98.35%,批内变异系数(CV)≤ 10.59%,批间 CV ≤ 13.51%;检测破伤风类毒素抗原 ELISA 方法的定量限为 2.13 × 10-3Lf/ml,回收率为 107.28%,批内 CV ≤ 13.96%,批间 CV ≤ 10.06%。
建立了白喉、破伤风类毒素抗原 ELISA 检测方法,该法特异性强、准确度高、重复性好,可用于白喉破伤风疫苗产品的质量控制和生产过程控制。
白喉; 破伤风; 抗原; 白喉-破伤风菌苗; 酶联免疫吸附测定
白喉和破伤风疫苗作为计划免疫品种,在我国得到了广泛应用,可以有效预防白喉、破伤风疾病,疫苗的基础组成分别是白喉类毒素(diphtheria toxoid,DT)和破伤风类毒素(tetanus toxoid,TT)。两种疫苗的生产工艺基本相同,方法较为传统,均为细菌在适宜的培养基中培养,产生的毒素经精制、甲醛脱毒成类毒素,再加入铝佐剂吸附制成。除作为疫苗使用外,近年随着国内外细菌多糖蛋白结合疫苗的发展,类毒素因其良好的免疫原性已成为应用最多的蛋白载体[1-2]。
目前的 2015 年版《中国药典》三部规定白喉和破伤风类毒素抗原含量的检测方法是采用絮状沉淀法[3],以絮状单位(flocculation units,Lf)表示,该方法操作较为复杂,人工终点判断较难掌握。我们利用类毒素免疫新西兰大白兔制备多抗,半固体培养基法制备单克隆抗体,以平行线法建立了白喉和破伤风类毒素的夹心酶联免疫测定法。该方法可用于白喉破伤风疫苗的鉴别试验、组分含量测定、吸附度测定等质量控制项目以及疫苗生产过程监测。
1 材料与方法
1.1 材料
1.1.1 标准品 白喉类毒素国际标准品(02/176)和破伤风类毒素国际标准品(04/150)由英国国家生物制品检定所提供[4]。
1.1.2 实验动物 BALB/c 小鼠由中国食品药品检定研究院实验动物资源研究所提供,生产许可证号 SYXK(京)2016-0004,饲养于独立通气动物笼环境。
1.1.3 主要试剂及仪器 辣根过氧化物酶标记的羊抗兔 IgG 为美国 Life Technologies 公司产品;96 孔酶标板为德国 Greiner 公司产品;底物邻苯二胺(OPD)、牛血清白蛋白(BSA)为美国 Sigma 公司产品;其他试剂为国产分析纯;Spectramax PLUS 酶标仪为美国 Molecular Devices 公司产品。
1.2 方法
1.2.1 单抗的制备和纯化 用白喉、破伤风抗原加弗氏完全佐剂,经皮下注射 8 周龄BALB/c 雌性小鼠,每种抗原免疫 5 只小鼠,30 μg/只,3 周后,再以 30 μg/只抗原加弗氏不完全佐剂经腹腔注射小鼠,7 ~ 10 d 后眼眶取血,采用间接 ELISA 法检测血清抗体效价,每种抗原分别取效价最高且大于 1:104的小鼠进行细胞融合。第二次免疫 3 周后,于融合前 3 天经尾静脉注射抗原30 μg/只加强免疫。无菌采取小鼠的脾脏细胞与对数期生长的 SP2/0 细胞按 5:1 ~ 10:1 比例,用常规方法进行细胞融合[5],将融合后的细胞与 1.1% 甲基纤维素培养液混匀,铺入 6 孔板中,平行铺 3 板。置于 37 ℃、5% CO2培养箱中,培养期间避免观察或动板,以免融合细胞移动位置。8 ~ 11 d 后肉眼可见针尖大小白色斑点,显微镜下观察即为细胞克隆团,挑取后直接移种至含饲养细胞的 96 孔板中进行培养。用 ELISA 间接法检测上清抗体效价,获取分泌高效价抗体的杂交瘤细胞株[6]。按常规方法制备小鼠杂交瘤细胞腹水,先用辛酸-硫酸铵沉淀法粗提腹水,然后将粗提液经 A 蛋白亲和层析柱进行纯化[7]。
1.2.2 多抗的制备和纯化 用 PBS 缓冲液稀释白喉、破伤风类毒素抗原至 2 mg/ml,与等体积的弗氏完全佐剂乳化后,经皮下多点注射 12 周龄、体重 2.5 ~ 3 kg 的雌性家兔,每组抗原免疫 2 只家兔,1 mg/只,以后每隔 2 周以抗原加弗氏不完全佐剂经皮下进行加强免疫,加强免疫 4 次,于最后一次免疫一周后,耳部静脉取血,分离血清。用 ELISA 间接法检测每份血清抗体效价,每组选取抗体效价高的家兔血清用辛酸-硫酸铵沉淀法进行纯化。
1.2.3 夹心 ELISA 法的建立
1.2.3.1 标准曲线的绘制 应用方阵滴定法分别确定白喉和破伤风包被单抗、检测多抗的最佳工作浓度,酶标二抗的工作浓度为 1:60 000。将包被抗体用 pH 9.6 碳酸盐缓冲液稀释至确定的包被浓度,以 100 μl/孔包被 ELISA 板,4 ℃ 过夜。用 0.5% BSA 封闭,37 ℃ 1 h 后,洗涤。然后加入
等体积一系列不同浓度的抗原标准品(白喉为 0 ~ 0.4 Lf/ml,破伤风为 0 ~ 0.4 Lf/ml),每个浓度均作复孔,100 μl/孔,用于确定两种抗原检测方法的检测线性范围。37 ℃ 1 h 后洗涤。按确定的浓度加入检测多抗,100 μl/孔,37 ℃ 1 h 后洗涤。按工作浓度(1:60 000)加入检测酶标二抗,100 μl/孔,37 ℃ 1 h 后洗涤。加 OPD 底物显色,终止反应,用酶标仪测定 490 nm 下的吸光度()。以抗原标准品不同浓度为横坐标,其相应的吸光度值为纵坐标,进行四参数拟合绘制标准曲线。
1.2.3.2 方法学验证 对供试品和标准品的剂量反应曲线同时进行拟合,以平行线法定量检测白喉类毒素和破伤风类毒素抗原含量。①特异性:用建立的 ELISA 方法检测白喉类毒素、破伤风类毒素、百日咳毒素、丝状血凝素、黏附素,分别评价两种方法的特异性。②定量限:以白喉抗原国际标准品0.0015625、0.00078、0.00039、0.000195 Lf/ml 四个稀释浓度的样品作为待测样品,0.05 Lf/ml 稀释浓度作为标准品;破伤风抗原国家标准品 0.00625、0.003125、0.0015625、0.00078 Lf/ml 四个稀释浓度的样品作为待测样品,0.1 Lf/ml 稀释浓度作为标准品,依次加入已包被抗体的酶标板 A 排中,待测样品和标准品同时进行 2 倍系列稀释至第八孔,应用已建立的 ELISA 方法,分别测定各样品抗原含量,每个样品重复测定 6 次。计算每个样品测定结果与理论值的偏差,以确定检测方法的定量限。③准确度:在零浓度标准溶液中,分别添加已知的白喉类毒素标准品 0.01 Lf/ml 和破伤风类毒素 0.02 Lf/ml,再进行 ELISA 检测,并计算含量,根据公式:回收率(%)= 测得值/ 真实值 × 100% 得出准确度。④精密度:选取高、低浓度的白喉抗原标准溶液(0.025 Lf/ml,0.00625 Lf/ml)和破伤风抗原标准溶液(0.05 Lf/ml,0.0125 Lf/ml),每份标准溶液同批测定 10 次,重复试验 3 次,计算测定结果的平均值和标准差,得出批内变异系数(CV)和批间 CV,评价方法的精密度。
2 结果
2.1 最佳工作浓度的确定
方阵滴定法结果显示,采用白喉单抗 D09A07 和破伤风单抗 T3C10 作为包被抗体时的标准曲线有较大的斜率,并确定了两种抗原 ELISA 检测方法中包被单抗、检测多抗的最佳工作浓度分别为 3 μg/ml 和 1 μg/ml。
2.2 标准曲线的绘制
以类毒素抗原标准溶液浓度(白喉为 0 ~0.05 Lf/ml;破伤风为 0 ~ 0.1 Lf/ml)为横坐标,其相应的值为纵坐标,进行四参数拟合,绘制标准曲线,结果见图 1 和图 2。检测白喉类毒素和破伤风类毒素抗原的 ELISA 方法标准曲线四参数方程分别为 Y =(–0.012 – 1.796)/[1 +(x / 0.004)ˆ0.862]+ 1.796,相关系数2为 0.999;Y =(0.104 – 1.735)/[1 +(x / 0.022)ˆ1.177]+ 1.735,相关系数2为 0.993。结果证实白喉类毒素和破伤风类毒素抗原浓度与相应值在检测范围内有良好的线性关系,表明了两种 ELISA 检测方法的可靠性。
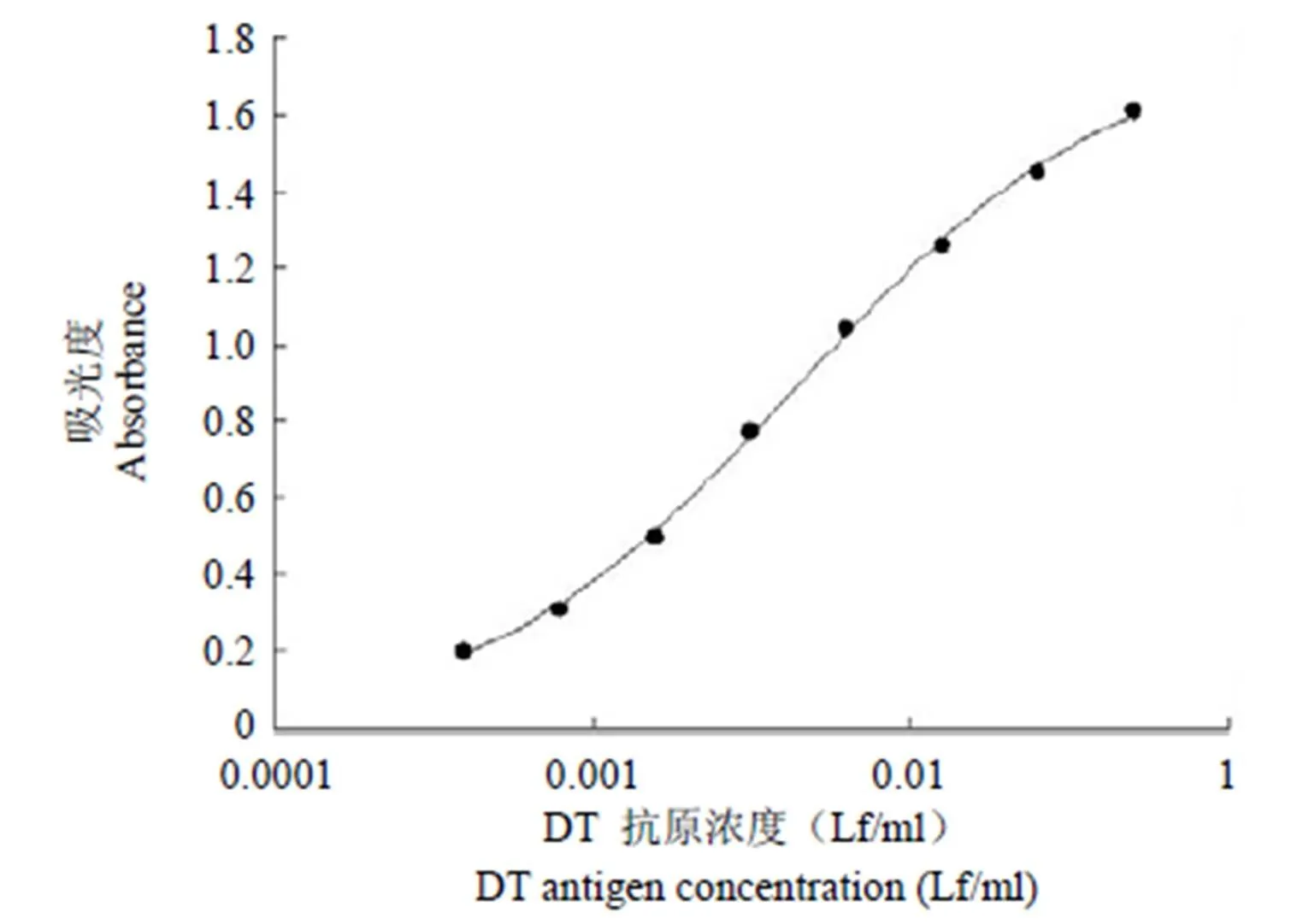
图 1 白喉类毒素 ELISA 检测方法的标准曲线
Figure 1 Standard curve of diphtheria toxoid by ELISA assay

图 2 破伤风类毒素 ELISA 检测方法的标准曲线
Figure 2 Standard curve of tetanus toxoid by ELISA assay
2.3 方法学验证
2.3.1 特异性 用建立的 ELISA 方法检测白喉类毒素、破伤风类毒素、百日咳毒素、丝状血凝素、黏附素,结果表明白喉抗原 ELISA 检测方法除了与白喉类毒素反应,对其他四种物质均无交叉反应;破伤风抗原 ELISA 检测方法除了与破伤风类毒素反应,对其他四种物质均无交叉反应。
2.3.2 定量限 测定不同浓度的白喉类毒素国际标准品和破伤风类毒素国际标准品,根据检测结果与理论值偏差≤ 20% 的最低稀释浓度来确定方法的定量限。当白喉类毒素标准品稀释至 7.81 × 10-4Lf/ml 时检测偏差为 13.90%,稀释至 3.91 × 10-4Lf/ml 时检测偏差> 20%,因此检测白喉类毒素抗原的定量限为 8.90 × 10-4Lf/ml。当破伤风类毒素标准品稀释至 3.13 × 10-3Lf/ml 时检测偏差为 7.56%,稀释至 1.56 × 10-3Lf/ml 时检测偏差> 20%,因此检测破伤风类毒素抗原的定量限为 2.13 × 10-3Lf/ml(表 1 和表 2)。
2.3.3 准确度 回收试验结果显示检测白喉类毒素和破伤风类毒素两种 ELISA 检测方法的回收率分别为 98.35% 和 107.28%,符合规定。
2.3.4 精密度 试验结果显示,白喉类毒素的 ELISA 检测方法在高浓度时,平均批内 CV 和批间 CV 分别为 8.74% 和 9.68%,低浓度时平均批内CV 和批间 CV 分别为 10.59% 和 13.51%;破伤风类毒素的 ELISA 检测方法在高浓度时平均批内CV 和批间 CV 分别为 12.35% 和 5.24%,低浓度时平均批内 CV 和批间 CV 分别为 13.96% 和 10.06%,符合规定。
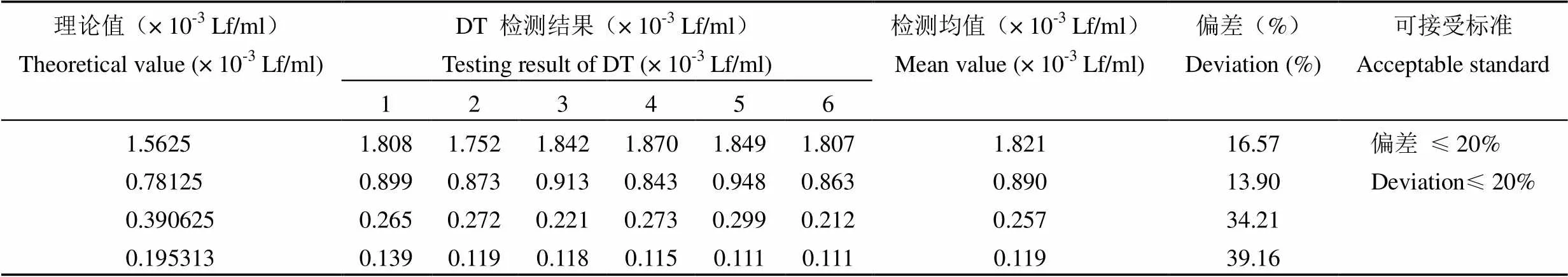
表 1 白喉类毒素 ELISA 检测方法的定量限验证结果

表 2 破伤风类毒素 ELISA 检测方法的定量限验证结果
3 讨论
白喉是一种由白喉棒状杆菌引起的急性上呼吸道传染病,人群对白喉普遍易感,以儿童为多。破伤风是由破伤风梭状芽孢杆菌感染引起的严重感染性疾病,目前在大部分发展中国家仍然是一个主要的公共卫生问题,世界范围内每年死于破伤风的人群 80% 为新生儿[1-2]。预防白喉和破伤风最有效的手段是对婴幼儿和高危人群实施疫苗的免疫接种。目前国内外使用的白喉和破伤风疫苗均为细菌产生的外毒素经精制、甲醛脱毒后制成的类毒素疫苗。不具有外毒素的毒性,但保留了其免疫原性,能刺激机体免疫系统产生特异的保护性抗体,通过对人群的广泛接种可有效降低疾病的发病率和死亡率。
有效抗原的含量测定是疫苗质量控制的重要指标。目前白喉和破伤风类毒素疫苗的抗原含量检测方法是利用类毒素与相应抗毒素在适当的含量、比例、温度、反应时间等条件下,发生抗原抗体结合,产生肉眼可见的絮状凝集反应的原理进行,以絮状单位表示,该方法操作需要经验丰富的技术人员完成,终点判断存在一定人员误差。
本研究利用抗白喉、破伤风单克隆抗体作为包被抗体,兔抗白喉、破伤风多抗作为二抗,辣根过氧化物酶标记的羊抗兔 IgG 抗体作为酶标抗体,建立了定量检测白喉和破伤风类毒素含量的夹心 ELISA 方法,方法学验证结果显示,这两种 ELISA方法的特异性强、准确性高、重复性好,方法操作 简单,易于推广,可广泛用于白喉破伤风疫苗的质量控制和生产过程控制,包括鉴别试验、抗原含量测定、吸附度测定等疫苗质控关键项目,对提高我国白喉和破伤风类毒素疫苗的质量有重要的实际意义。
[1] Plotkin S, Orenstein W, Offit P. Vaccines (Plotkin). 7th ed. Philadelphia, PA: Elsevier, 2012:153-166, 746-772.
[2] Zhao K, Zhang YH, Li HM. Medical biological products. 2nd ed. Beijing: People's Medical Publishing House, 2007:692-702, 975-1005. (in Chinese)
赵铠, 章以浩, 李和民. 医学生物制品学. 2版. 中国: 人民卫生出版社, 2007:692-702, 975-1005.
[3] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 3, 2010. Beijing: China Medical Science Press, 2010. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2010年版三部. 北京: 中国医药科技出版社, 2010.
[4] Preneta-Blanc R, Rigsby P, Wilhelmsen ES, et al. Calibration of replacement international standards of diphtheria and tetanus for use in flocculation test. Biologicals, 2008, 36(5):315-326.
[5] Zhou CF. Prokaryotic expression, antibody preparation and preliminary application of influenza A virus (H1N1) (2009). Zhengzhou: Henan University of Technology, 2011. (in Chinese)
周春峰. 甲型H1N1(2009)流感病毒HA的原核表达、抗体制备及初步应用. 郑州: 河南工业大学, 2011.
[6] Ren RM, Wang YL, Zhang YQ, et al. The improved intrasplenic immunization and semi-solid medium to prepare monoclonal antibody. Biotechnol Bull, 2013, 29(8):166-169. (in Chinese)
任瑞敏, 王云龙, 张怡青, 等. 利用改良后的脾内免疫和半固体培养基法制备单克隆抗体. 生物技术通报, 2013, 29(8):166-169.
[7] Liu XB, Cai MY, Wang X, et al. One simple and efficient method for purification of IgG McAb from mice ascites: caprylic acid/ ammonium sulfate precipitation. J West China Univ Med Sci, 1999, 30(4):455-456, 464. (in Chinese)
刘晓波, 蔡美英, 王霞, 等. 一种简单实用纯化腹水McAb方法——辛酸/硫酸铵法. 华西医科大学学报, 1999, 30(4):455-456, 464.
Establishment of ELISA assays for determination of the diphtheria toxoid and tetanus toxoid
TAN Ya-jun, XIA De-ju, LI Zhe, CHAO Zhe, TIAN Lin, DONG Guo-xia, HOU Qi-ming, MA Xiao
Key Laboratory of the Ministry of Health for Research on Quality and Standardization of Biotech Products, National Institutes for Food and Drug Control, Beijing 100050, China
This study aims to establish two enzyme-linked immunosorbent assay (ELISA) methods for quantitative determination of the diphtheria toxoid (DT) and tetanus toxoid (TT), respectively.
The assay system was based on the sandwiching of the antigen between a monoclonal mouse anti-DT or anti-TT antibody pre-coated on a 96-well polystyrene plate, and a polyclone rabbit anti-DT or anti-TT antibody, which was then detected with a peroxidase-labeled goat anti-rabbit antibody. Then the two ELISA assays with parallel lines were validated.
Validation results of the two quantitative ELISA methods were in accordance with the regulations. The limit of quantity of ELISA method for quantitative detection of DT was demonstrated to be 8.90 × 10-4Lf/ml, and its average recovery rate was 98.35%. The intra-assay coefficient of variation (CV) and inter-assay CV of this DT assay were less than or equal to 10.59%, and 13.51%,respectively. The limit of quantity of ELISA method for quantitative detection of TT was also demonstrated to be 2.13 × 10-3Lf/ml, and its average recovery rate was 107.28%. The intra-assay CV and inter-assay CV of this TT assay were less than or equal to 13.96% and 10.06%, respectively.
The two ELISA methods for quantitative determination of the diphtheria toxoid and tetanus toxoid are specific, accurate and reproducible, which may be used for the quality control of diphtheria and tetanus vaccines and production process control.
Diphtheria; Tetanus; Antigen; Diphtheria-tetanus vaccine; Enzyme-linked immunosorbent assay
MA Xiao, Email: maxiao421@sina.cn; XIA De-ju, Email: xiaju2007@126.com
“十三五”国家科技重大专项(2018ZX09738005)
马霄,Email:maxiao421@sina.cn;夏德菊,Email:xiaju2007@126.com
2018-06-29
10.3969/j.issn.1673-713X.2018.06.002
