呼吸道合胞病毒抑制剂的研究进展
2018-12-11李强张国宁张煊笛王玉成
李强,张国宁,张煊笛,王玉成
呼吸道合胞病毒抑制剂的研究进展
李强,张国宁,张煊笛,王玉成
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所合成室
人呼吸道合胞病毒(respiratory syncytial virus,RSV)是一种导致婴幼儿、老年人和免疫力低下的成年人下呼吸道疾病的重要 RNA 病毒[1-4]。据估计全球每年有超过 3300 万 5 岁以下的儿童感染呼吸道合胞病毒,其中约 10% 会引起急性下呼吸道感染,死亡人数为 6.6 万~ 19.9 万[5]。其中1 岁以下婴儿下呼吸道感染死亡病例中三分之一是 RSV 感染造成的,RSV 感染是婴幼儿死亡的重要原因[6]。RSV 感染患者在一生中可能反复感染该病毒,研究表明几乎 100% 的婴幼儿都会至少感染过一次 RSV[7]。另外,RSV 感染患者康复后易发生肺功能异常、支气管哮喘等肺部疾病[2, 8]。
尽管 RSV 感染的现状非常严峻,但目前美国食品药品监督管理局批准用于呼吸道合胞病毒感染防治的药物仅有帕利珠(palivizumab,Synagis)[9]和利巴韦林(ribavirin)两种。帕利珠是一种人源化单克隆抗体,主要用于预防患有慢性肺部疾病和先天性心脏病高危儿童以及早产儿的呼吸道合胞病毒感染,并不能用于呼吸道合胞病毒感染后治疗,且需要反复注射、费用昂贵。利巴韦林气雾剂是 1986 年被批准用于治疗住院儿童严重 RSV 感染的药物。但由于该药物存在疗效一般及副作用大等问题[10-11],美国儿科协会并不推荐将利巴韦林用于呼吸道合胞病毒感染患儿的治疗。因此,开展抗 RSV 药物的研究具有重要意义。
1 治疗 RSV 感染的已上市药物
尽管呼吸道合胞病毒已经被发现 50 多年了,人们对其治疗也进行了广泛而深入的研究,但是目前 FDA 批准用于其防治的药物只有帕利珠和利巴韦林两种,对其最有效的治疗方法仍是针对症状的支持治疗。
1.1 帕利珠
帕利珠是 1998 年由 MedImmune 开发的一种人源化 IgG1 单克隆抗体,与位于 RSV F 蛋白的抗原性位点 II 中的保守表位相结合,是迄今为止唯一获得临床认可的高危婴儿预防RSV感染的药物。帕利珠对 RSV 感染的预防只能部分有效,在 RSV 季节期间每月注射帕利珠单抗一次,与安慰剂相比能减少 50% RSV 感染引起的住院。2014 年帕利珠单抗的给药标准发生了变化,取消了对没有慢性肺病的 29 ~ 35 周出生的早产儿的常规给药,并且对所有感染过 RSV 的儿童停止了预防给药,这导致帕利珠的适用人群大大减少。由于其成本高昂且需要多次给药,帕利珠目前仅被批准用于妊娠 < 29 周的早产儿、患有慢性肺疾病的早产儿、先天性心脏疾病和影响气道清除的神经肌肉疾病的早产儿的 RSV 预防[12]。
1.2 利巴韦林
利巴韦林(图 1)是一种鸟苷类似物类广谱的抗病毒药物,是目前 FDA 批准的唯一一种用于 RSV 感染治疗的小分子药物,该药物气雾剂剂型批准用于 RSV 感染治疗,但治疗效果存在争议。利巴韦林的抗病毒作用机制有多种报道,包括抑制宿主细胞酶肌苷5-单磷酸脱氢酶(IMPDH)、抗病毒先天免疫调节和细胞应答、病毒 RNA 合成期间的 链终止、抑制病毒 mRNA 封闭以及病毒基因组中突变的积聚[13]。虽然利巴韦林可能降低死亡率,但其疗效和安全性仍存在争议。

图 1 利巴韦林的结构
2 处于临床研究的 RSV 抑制剂
2.1 Lumicitabine
Lumicitabine(ALS-8176)(图 2)是由 Alios 开发的一种有效的口服核苷类似物L 蛋白抑制剂,用于治疗由呼吸道合胞病毒、偏肺病毒和副流感病毒引起的感染。该化合物是通过对一系列 4'-胞嘧啶核苷类似物进行药效和药代动力学性质筛选得到的一种抗病毒化合物。这些4'-胞嘧啶核苷类似物中活性最好的ALS-8112 对 RSV RNA 复制抑制作用的 IC50为 0.15 μmol/L,其 5'-三磷酸酯对 RSV RNA 复制抑制作用的 IC50达 0.02 μmol/L,且在 100 μmol/L 未见对人 DNA 和 RNA 聚合酶的抑制作用[14]。ALS-8176 是 ALS-8112 的 3',5'-氧-二异丁酸酯前药,在体内具有良好的生物利用度并且能够较容易转化为活性形式前体药物的 5'-三磷酸酯。ALS-8176 是第一类核苷 RSV 聚合酶抑制剂(全新的结构和全新的靶标),已完成 II 期临床试验,结果表明 ALS-8176 显示出优异的药效和安全性,但是目前完整结果还未公开[15]。
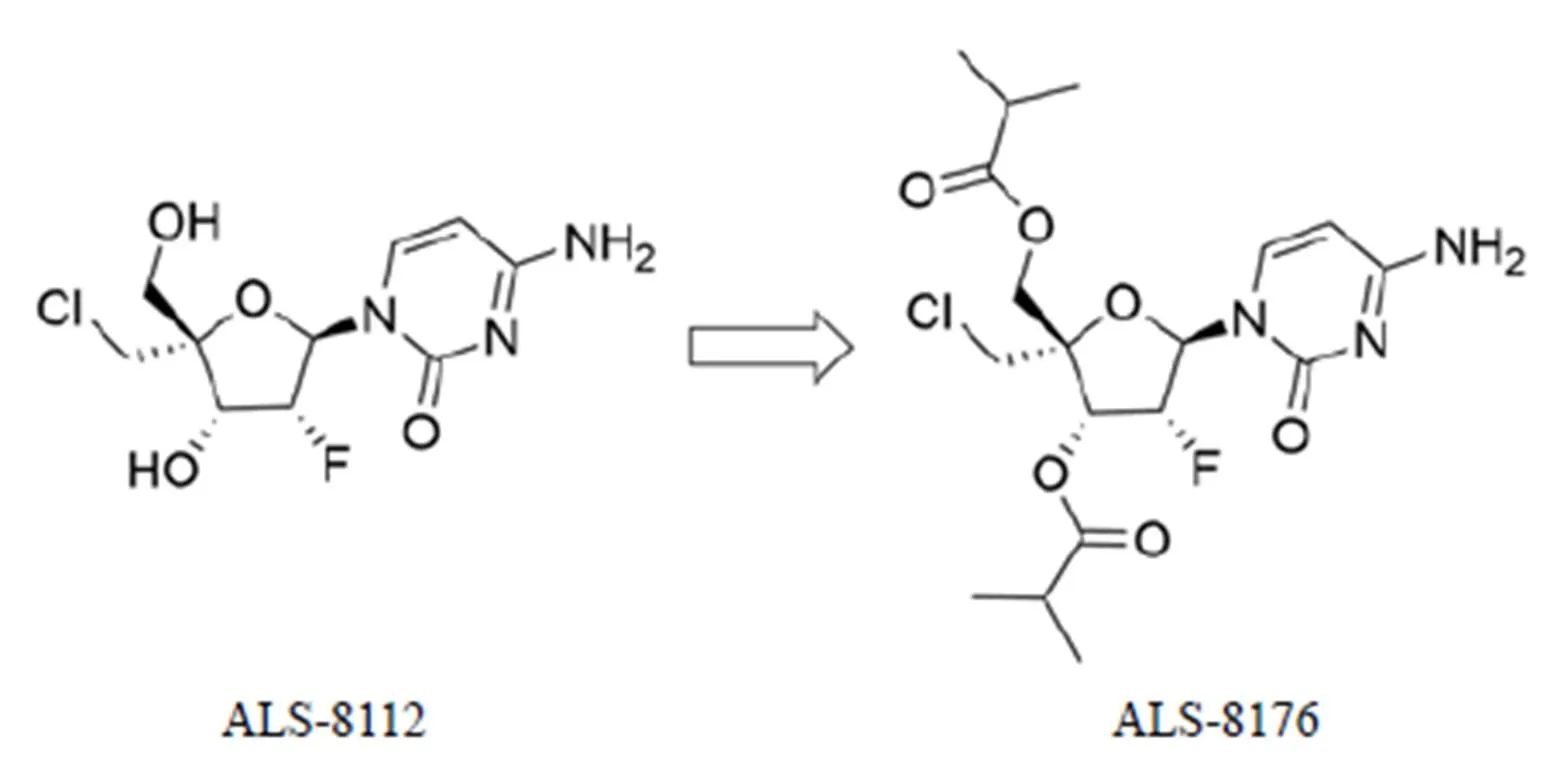
图 2 ALS-8112 和ALS-8176 的结构
2.2 Presatovir
Presatovir(GS-5806)(图3)是吉利德科学公司开发的一种口服 RSV F 融合蛋白抑制剂,目前处于 II 期临床研究阶段。该化合物是在基于 RSV 感染表型高通量筛选得到的 hit 基础上,对其活性、溶解性、渗透性及药代动力学等性质优化得到的。该化合物可以配制成溶液,满足每日一次口服给药的婴幼儿用药需求[16]。在 RSV 感染的棉鼠模型中,GS-5806 对临床发现的 75 种 RSV A 型和 B 型病毒都具有剂量依赖性的抑制作用,其抗病毒效力的平均 EC50为 0.43 nmol/L(n = 75),但是病毒 F 蛋白突变会导致其对 GS-5806 耐药[16-17]。在用 RSV 实验性感染的健康人类志愿者中,该化合物表现出较强的抗病毒作用,与安慰剂相比,峰值病毒载量平均减少 4.2 log10(给药组峰值病毒载量为安慰剂组的 1/15849),疾病严重度显著降低[16]。在 I 期临床试验中,presatovir 表现出有利的安全性和药代动力学特征,支持每日一次给药[18]。最新的临床试验显示,presatovir 并不能明显降低 RSV 感染住院患者的病毒载量,也不能改善患者的临床症状[19],这一结果对 presatovir 是否能进一步开发造成挑战。

图 3 Presatovir(GS-5806)的发现
2.3 PC-786
PC-786(图 4)是 Pulmocide 公司开发的用于治疗 RSV 感染的小分子类大聚合酶 L 蛋白聚合酶抑制剂,目前处于 II 期临床研究阶段[20]。它可以以混悬液形式用雾化器雾化吸入,直接给予肺部,因此避免了系统性用药。PC-786 对于实验室驯化和临床分离的 RSV A 及 RSV B 病毒抑制活性的 IC50分别为(0.09 ~ 0.71)nmol/L 和(1.3 ~ 50.6)nmol/L[21]。PC-786 每天一次的鼻内给药能够将 RSV 感染的小鼠和棉鼠的肺匀浆中的病毒载量降低至不可检测的水平。PC-786 在 HEp-2 细胞的无细胞酶测定和最小基因组测定中有效地抑制 RSV 的 RNA 依赖性 RNA 聚合酶(RdRp)活性(IC50分别为 2.1 nmol/L 和 0.5 nmol/L)。用 GS-5806 进行的晚期干预没有显示出显著的抗 RSV 病毒作用,但 PC-786 产生了强效的、浓度依赖性的病毒复制抑制作用,在气道上皮细胞中病毒载量给药后 3 d 降至可检测限度以下,这些效果明显优于 ALS-8112。PC-786 显示出对 RSV 诱导的 CCL5、IL-6、双链 DNA 和黏蛋白增加具有抑制活性[22]。因此,PC-786 通过抑制 RdRp 活性被证明是有效的抗 RSV 剂,使得该化合物局部使用成为用于治疗人 RSV 感染的新型潜在疗法。
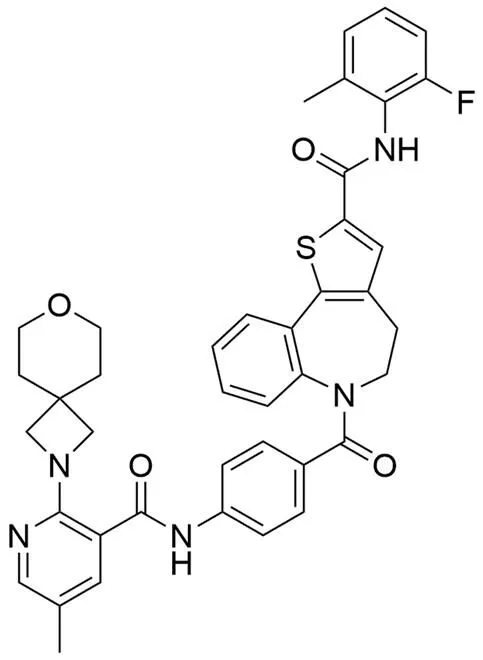
图 4 PC-786的结构
2.4 JNJ-678
JNJ-678(JNJ-53718678)(图5)是由 Janssen Pharmaceutica & Janssen-Cilag 开发的用于治疗 RSV 感染的强效选择性的小分子融合抑制剂。在体外对呼吸道合胞病毒抑制 IC50在纳摩尔水平[23]。在感染 RSV 的健康志愿者中进行的研究显示,JNJ-678 降低了 RSV 病毒载量和疾病严重程度,并缩短了症状持续时间,并且 JNJ-678 在500 mg 多次给药的情况下安全耐受性良好[24]。目前JNJ-678 正在进行非住院成人 RSV 感染人群抗病毒活性、临床结果、安全性、耐受性和药代动力学性质评价[25]。

图 5 JNJ-678(JNJ-53718678)的结构
2.5 AK-0529
AK-0529(图 6)是 Ark Biosciences 公司开发的 RSV 抑制剂,它通过阻断病毒进入和合胞体形成来抑制 RSV 复制。在一项随机、双盲、安慰剂对照的 I 期口服 AK-0529 研究中,评估了其安全性、耐受性和药代动力学。试验中未见药物直接相关的不良反应发生,AK-0529 耐受性良好,安全性极高[26]。目前,AK-0529 正在进行的II期临床试验被命名为“儿童呼吸道合胞病毒感染治疗中的病毒抑制”,相关结果未公开[27]。

图 6 AK-0529 的结构
2.6 BTA-C585
BTA-C585(Biota / Aviragen)(图 7)是一种 RSV F 蛋白抑制剂,在体外实验中能够抑制包括临床分离株在内的 RSV-A 和 RSV-B 的复制(EC50< 100 nmol/L)。该化合物与其他 F 融合抑制剂(例如 MDT-637 和 BMS-433771)具有交叉耐药现象。在 RSV 棉鼠模型中,在用 104PFU/ml 的 RSV-A 菌株感染前 2 h,口服给药 BTA-C585(25、50、100、250 mg/kg)感染后5 d 在肺中检测到的病毒 mRNA 减少 3 个数量级[28]。BTA-C585 在 2018 年 5 月 30 日已完成 II 期临床研究[29],目前未开展进一步研究,具体原因不明。
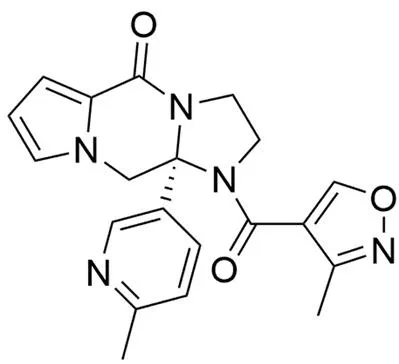
图 7 BTA-C585 的结构
2.7 RFI-641
RFI-641(图 8)是 Wyeth 公司开发的一种树枝状大分子样化合物,对 RSV-A 和 RSV-B 实验室驯化株和临床分离株具有有效的体外活性,其 IC50值约为 20 nmol/L[30]。该化合物通过抑制 RSV 与细胞的结合以及融合产生抗病毒作用,它对在 F 蛋白 446 位发生突变的病毒仍具有活性。在 RSV 感染的小鼠模型中,感染前 2 h 经鼻给予 RFI-641 使肺中的病毒滴度降低 0.63 ~ 1.53 个 log 值;在非洲绿猴中,在鼻和咽喉样品中分别降低 2.1 和 3.1 个 log 值,并且在感染后 24 h 给药也有效。目前该化合物已被 Wyeth 中止临床研究[31]。
2.8 VP-14637
VP-14637(由MDT-637 更改剂型,图 9)是 ViroPharma 开发的一种呼吸道合胞病毒 F 融合蛋白抑制剂,已被证明可在临床前试验中阻断 RSV 感染。这种药物在体外对 75 株 RSV A 和 B临床分离株具有抗病毒活性(EC50为 1.72 nmol/L)[17],在棉鼠模型中,RSV-A 或RSV-B 感染后 1 d 开始分次给予气雾剂仅(126 ± 1)mg/kg 剂量,平均肺 RSV 滴度、组织病理学评分与模拟组相比显著降低[32]。在 2012 年启动了 VP-14637(MDT-367)在健康受试者中抗感染 RSV 的功效的临床研究,但由于未知原因停止。

图 8 RFI-641 的结构

图 9 VP-14637 的结构
2.9 TMC353121
TMC353121(图 10)是 Johnson & Johnson 公司开发的吗啉丙基氨基苯并咪唑类抗 RSV 感染候选物,它是通过对 JNJ-2408068 结构衍生化得到的,其前体化合物组织保留时间较短。在体外实验中,TMC353121 能够结合于融合蛋白 F 的 HR1 区(Y198)和 HR2 区(D486),抑制病毒-细胞以及细胞-细胞融合[33]。越来越多的数据表明了另一种潜在的作用机制:其通过阻止 F 蛋白的亚稳定前体触发融合确认来拮抗融合[34]。在 BALB/c 小鼠模型中,用 RSV-A2 鼻内感染并给予 TMC353121 处理(剂量范围从 0.25 ~ 10 mg/kg),如果在感染的两天内开始治疗,肺中的病毒载量明显降低。在 RSV 棉鼠和非洲绿猴模型中,TMC353121 以剂量依赖性减少病毒载量[35]。

图 10 JNJ-2408068 和TMC353121 的结构
3 结语
尽管 RSV 感染的形式非常严峻,但是目前 FDA 批准用于其防治的药物只有帕利珠和利巴韦林,而两者都存在着明显的缺陷。近 30 年来,人们对 RSV 感染宿主细胞的过程和生命周期进行了广泛而深入的研究,针对其生命周期的不同蛋白开发了多种小分子和大分子的抑制剂,其研究方向主要集中在 RSV 融合 F 蛋白抑制剂、RNA 聚合酶复合物 L 蛋白抑制剂以及 F 蛋白的亚稳定前体抑制剂,其中研究最为前沿的候选物已完成临床 II 期阶段,有望成为新型治疗 RSV 感染的药物。然而,RSV 融合 F 蛋白抑制剂会出现交叉耐药的现象,并且涉及到婴幼儿和老年人等特殊的用药人群,RSV 感染药物的开发面临着巨大的挑战。而目前临床上针对 RSV 感染仍缺乏有效的诊断和治疗药物,常将其按“普通感冒”或“病毒性感染”进行治疗。因此,应积极推进抗 RSV 病毒药物的研发,以满足婴幼儿、老年人以及免疫缺陷患者的用药需求。
[1] Anderson LJ, Dormitzer PR, Nokes DJ, et al. Strategic priorities for respiratory syncytial virus (RSV) vaccine development. Vaccine, 2013, 31 Suppl 2:B209-B215.
[2] Graham BS. Biological challenges and technological opportunities for respiratory syncytial virus vaccine development. Immunol Rev, 2011, 239(1):149-166.
[3] Jorquera PA, Anderson L, Tripp RA. Understanding respiratory syncytial virus (RSV) vaccine development and aspects of disease pathogenesis. Expert Rev Vaccines, 2016, 15(2):173-187.
[4] Modjarrad K, Giersing B, Kaslow DC, et al. WHO consultation on respiratory syncytial virus vaccine development report from a World Health Organization meeting held on 23-24 March 2015. Vaccine, 2016, 34(2):190-197.
[5] Nair H, Nokes DJ, Gessner BD, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet, 2010, 375(9725):1545-1555.
[6] Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet, 2012, 380(9859):2095-2128.
[7] Borchers AT, Chang C, Gershwin ME, et al. Respiratory syncytial virus--a comprehensive review. Clin Rev Allergy Immunol, 2013, 45(3):331-379.
[8] Anderson LJ. Respiratory syncytial virus vaccine development. Semin Immunol, 2013, 25(2):160-171.
[9] Meissner HC, Long SS, American Academy of Pediatrics Committee on Infectious Diseases and Committee on Fetus and Newborn. Revised indications for the use of palivizumab and respiratory syncytial virus immune globulin intravenous for the prevention of respiratory syncytial virus infections. Pediatrics, 2003, 112(6 Pt 1): 1447-1452.
[10] Empey KM, Peebles RS Jr, Kolls JK. Pharmacologic advances in the treatment and prevention of respiratory syncytial virus. Clin Infect Dis, 2010, 50(9):1258-1267.
[11] Glanville AR, Scott AI, Morton JM, et al. Intravenous ribavirin is a safe and cost-effective treatment for respiratory syncytial virus infection after lung transplantation. J Heart Lung Transplant, 2005, 24(12):2114-2119.
[12] Grindeland CJ, Mauriello CT, Leedahl DD, et al. Association between updated guideline-based palivizumab administration and hospitalizations for respiratory syncytial virus infections. Pediatr Infect Dis J, 2016, 35(7):728-732.
[13] Beaucourt S, Vignuzzi M. Ribavirin: a drug active against many viruses with multiple effects on virus replication and propagation. Molecular basis of ribavirin resistance. Curr Opin Virol, 2014, 8:10-15.
[14] Wang G, Deval J, Hong J, et al. Discovery of 4'-chloromethyl- 2'-deoxy-3',5'-di-O-isobutyryl-2'-fluorocytidine (ALS-8176), a first- in-class RSV polymerase inhibitor for treatment of human respiratory syncytial virus infection. J Med Chem, 2015, 58(4):1862-1878.
[15] Deval J, Hong J, Wang G, et al. Molecular basis for the selective inhibition of respiratory syncytial virus RNA polymerase by 2'-fluoro-4'-chloromethyl-cytidine triphosphate. PLoS Pathog, 2015, 11(6):e1004995.
[16] Mackman RL, Sangi M, Sperandio D, et al. Discovery of an oral respiratory syncytial virus (RSV) fusion inhibitor (GS-5806) and clinical proof of concept in a human RSV challenge study. J Med Chem, 2015, 58(4):1630-1643.
[17] Perron M, Stray K, Kinkade A, et al. GS-5806 inhibits a broad range of respiratory syncytial virus clinical isolates by blocking the virus-cell fusion process. Antimicrob Agents Chemother, 2015, 60(3): 1264-1273.
[18] German P, Xin Y, Chien JW, et al. Phase 1 first-in-human, single- and multiple-ascending dose, and food effect studies to assess the safety, tolerability, and pharmacokinetics of presatovir for the treatment of respiratory syncytial virus infection. J Clin Pharmacol, 2018, 58(8): 1025-1034.
[19] Hanfelt-Goade D, Maimon N, Nimer A, et al. A phase 2b, randomized, double-blind, placebo-controlled trial of presatovir (gs-5806), a novel oral rsv fusion inhibitor, for the treatment of respiratory syncytial virus (RSV) in hospitalized adults. Am J Respir Crit Care Med, 2018, 197:A4457.
[20] Pulmocide Ltd. A study of PC786 to evaluate the antiviral activity, safety and pharmacokinetics of multiple doses in an RSV challenge study. 2017-10-22 (2018-05-16) [2018-10-25]. https://clinicaltrials. gov/ct2/show/NCT03382431.
[21] Coates M, Brookes D, Kim YI, et al. Preclinical characterization of PC786, an inhaled small-molecule respiratory syncytial virus L protein polymerase inhibitor. Antimicrob Agents Chemother, 2017, 61(9):e00737.
[22] Brookes DW, Coates M, Allen H, et al. Late therapeutic intervention with a respiratory syncytial virus L-protein polymerase inhibitor, PC786, on respiratory syncytial virus infection in human airway epithelium. Br J Pharmacol, 2018, 175(12):2520-2534.
[23] Roymans D, Alnajjar SS, Battles MB, et al. Therapeutic efficacy of a respiratory syncytial virus fusion inhibitor. Nat Commun, 2017, 8(1): 167.
[24] Israel S, Rusch S, DeVincenzo J, et al. Effect of oral JNJ-53718678 (JNJ-678) on disease severity in healthy adult volunteers experimentally inoculated with live respiratory syncytial virus (RSV): a placebo-controlled challenge study//Oh, Those Pesky Viruses! 2016. https://idsa.confex.com/idsa/2016/webprogram/Paper59339.html.
[25] Janssen Research & Development, LLC. A study to assess the relative oral bioavailability of a single dose of JNJ-53718678 administered as oral concept formulation compared to the current oral solution and to assess the effect of food on the pharmacokinetics of oral concept formulation. 2016-10-26 (2018-04-13) [2018-10-25]. https://clinicaltrials. gov/ct2/show/NCT02945007.
[26] Toovey S, Wu J, Wang V, et al. Safety and pharmacokinetics in healthy volunteers of the anti-RSV antiviral AK0529//1st International Meeting on Respiratory Pathogens, Singapore 2015.
[27] Ark Biosciences Inc. Viral inhibition in children for treatment of RSV. 2016 (2018-07-02) [2018-10-25]. https://clinicaltrials.gov/ct2/show/ NCT02654171.
[28] A Draffan, S Bond, J Fenner, et al. (Eds.), Preclinical characterization of an orally bioavailable fusion inhibitor, BTAC585, for the treatment of RSV infection//54th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC) Meeting, Washington, DC, 2014.
[29] Vaxart (Biota Pharma Europe Limited). Safety, efficacy and pharmacokinetics of BTA-C585 in a RSV viral challenge study. 2016-05-24 (2018-05-30) [2018-10-25]. https://clinicaltrials.gov/ct2/ show/NCT02718937.
[30] Nikitenko AA, Raifeld YE, Wang TZ. The discovery of RFI-641 as a potent and selective inhibitor of the respiratory syncytial virus. Bioorg Med Chem Lett, 2001, 11(8):1041-1044.
[31] Olszewska W, Openshaw P. Emerging drugs for respiratory syncytial virus infection. Expert Opin Emerg Drugs, 2009, 14(2):207-217.
[32] Wyde PR, Laquerre S, Chetty SN, et al. Antiviral efficacy of VP14637 against respiratory syncytial virus in vitro and in cotton rats following delivery by small droplet aerosol. Antivir Res, 2005, 68(1):18-26.
[33] Roymans D, De Bondt HL, Arnoult E, et al. Binding of a potent small-molecule inhibitor of six-helix bundle formation requires interactions with both heptad-repeats of the RSV fusion protein. Proc Natl Acad Sci U S A, 2010, 107(1):308-313.
[34] Battles MB, Langedijk JP, Furmanova-Hollenstein P, et al. Molecular mechanism of respiratory syncytial virus fusion inhibitors. Nat Chem Biol, 2016, 12(2):87-93.
[35] Ispas G, Koul A, Verbeeck J, et al. Antiviral activity of TMC353121, a respiratory syncytial virus (RSV) fusion inhibitor, in a non-human primate model. PLoS One, 2015, 10(5):e0126959.
国家自然科学基金(81473098、81473099、81703366);北京协和医学院协和青年科研基金(青年教师创新项目)(2017350010)
王玉成,Email:wyc9999@126.com
2018-07-11
10.3969/j.issn.1673-713X.2018.06.010
