重组纤溶酶抑制剂Textilinin-1蛋白含量测定方法的对比研究
2018-12-11兰海英康乐陈宏超李娜徐梅
兰海英,康乐,陈宏超,李娜,徐梅
重组纤溶酶抑制剂Textilinin-1蛋白含量测定方法的对比研究
兰海英,康乐,陈宏超,李娜,徐梅
110171 沈阳,辽宁远大诺康生物制药有限公司
Textilinin-1 是从拟眼镜蛇中提取的 Kunitz 型蛋白酶抑制剂,具有纤溶酶抑制活性,可抑制基于纤溶酶被激活导致纤维蛋白溶解所导致的出血,因此具有开发为止血药的潜力,可以作为外科手术中抑肽酶的替代药物[1]。目前已有含 Textilinin-1 基因的重组毕赤酵母菌种,能高效表达目的蛋白[2]。
蛋白质含量测定是重组蛋白类药物质量控制中的重要指标之一,准确的蛋白质含量测定对产品的分装、比活性计算、残留杂质的限量控制以及其他理化特性测定均具有重要意义[3]。在研究过程中,我们发现不同方法测定的 Textilinin-1 蛋白含量结果差异很大,表明结果的准确与使用的方法有相关性。为了提高产品质量指标的准确性以及未来生产中的工作效率,我们比较分析了凯氏定氮法、BCA 法和紫外吸收法在 Textilinin-1 蛋白含量测定中的精确性和准确性,结果表明紫外吸收法是更适合于测定 Textilinin-1 蛋白含量的质量控制方法。
1 材料与方法
1.1 材料
1.1.1 供试品 中试生产的 3 个批次的 Textilinin-1 蛋白原液 20160804、20160810 和 20160819;对照品牛血清白蛋白(BSA)购自美国 Sigma 公司,批号 WXBC3531V。
1.1.2 主要试剂及仪器 BCA 蛋白质定量检测试剂盒购自生工生物工程(上海)公司;盐酸标准滴定液购自沈阳化学试剂厂;催化剂片购自丹麦福斯公司;浓硫酸、盐酸、三羟甲基氨基甲烷(Tris)等试剂均为国产分析纯;KjeltecTM8400 凯氏定氮仪和 TecatorTMDigestor 消化炉购自丹麦福斯公司;Biotek Epoch2 多功能酶标仪购自美国伯腾仪器有限公司;UV5Bio 紫外分光光度计购自美国梅特勒公司。
1.2 方法
1.2.1 样品 50 mmol/L 的 Tris-HCl(pH 7.5)为空白对照;供试品为 3 批次 Textilinin-1 蛋白原液;BSA 用空白对照液溶解配成 40 mg/ml 的溶液作为对照品。
1.2.2 凯氏定氮法 按照 KjeltecTM8400 自动定氮仪使用操作规程对样品定氮。上述样品分别准确量取 2 ml 加入消化管,同时加入一片催化剂片及 10 ml 浓硫酸,置消化炉上,采取逐步升高温度的方法 250 ℃ 30 min,330 ℃50 min,420 ℃ 2 h 进行消化后冷却至室温。将样品置于凯氏定氮仪上定氮,供试品和对照品测定结果分别除以各自蛋白的氮含量系数 15.90%(Textilinin-1)和 16.45%(BSA 蛋白),即得到供试品和对照品的蛋白质含量。供试品和对照品都平行测定 3 次。
1.2.3 BCA 法 按照 BCA 蛋白质定量检测试剂盒的说明书进行操作。562 nm 检测波长下,采用酶标板法在酶标仪中进行测定,3 批次供试品的检测值应该落在标准曲线范围内,最终的稀释倍数为 20160804 稀释 400 倍,20160810 稀释 240 倍,20160819 稀释 504 倍,对照品稀释 100 倍,所有检测样品均进行 3 个平行稀释。根据标准曲线,得到稀释样品的蛋白浓度,再乘以稀释倍数得到样品浓度。
1.2.4 紫外吸收法 将 3 批次供试品 20160804 稀释 100 倍,20160810 稀释 60 倍,20160819 稀释 126 倍,对照品稀释 40 倍,所有检测样品均进行 3 个平行稀释。用 1.0 cm 光程的石英比色皿进行检测。在全波长扫描模式下进行扫描,得到 Textilinin-1 蛋白和 BSA 蛋白的最大吸收波长(277 nm 和 278 nm)。在各自的最大吸收波长下,确保吸光值()在 0.3 ~ 0.7 之间。根据朗伯-比尔定律C =(/ ε)× 10 求得蛋白浓度。ε 为蛋白的百分比消光系数。Textilinin-1 蛋白的 ε 经本实验室前期工作确证为 7.3,BSA 蛋白的 ε 为 6.6[4]。
2 结果
2.1 BCA 法的标准曲线
以试剂盒中的 BSA 标准品浓度为横坐标,以其各浓度在 562 nm 处吸光值为纵坐标,绘制标准曲线(图 1)。得到回归方程 y = 0.952x + 0.121,线性相关系数2= 0.997,表明线性关系良好。
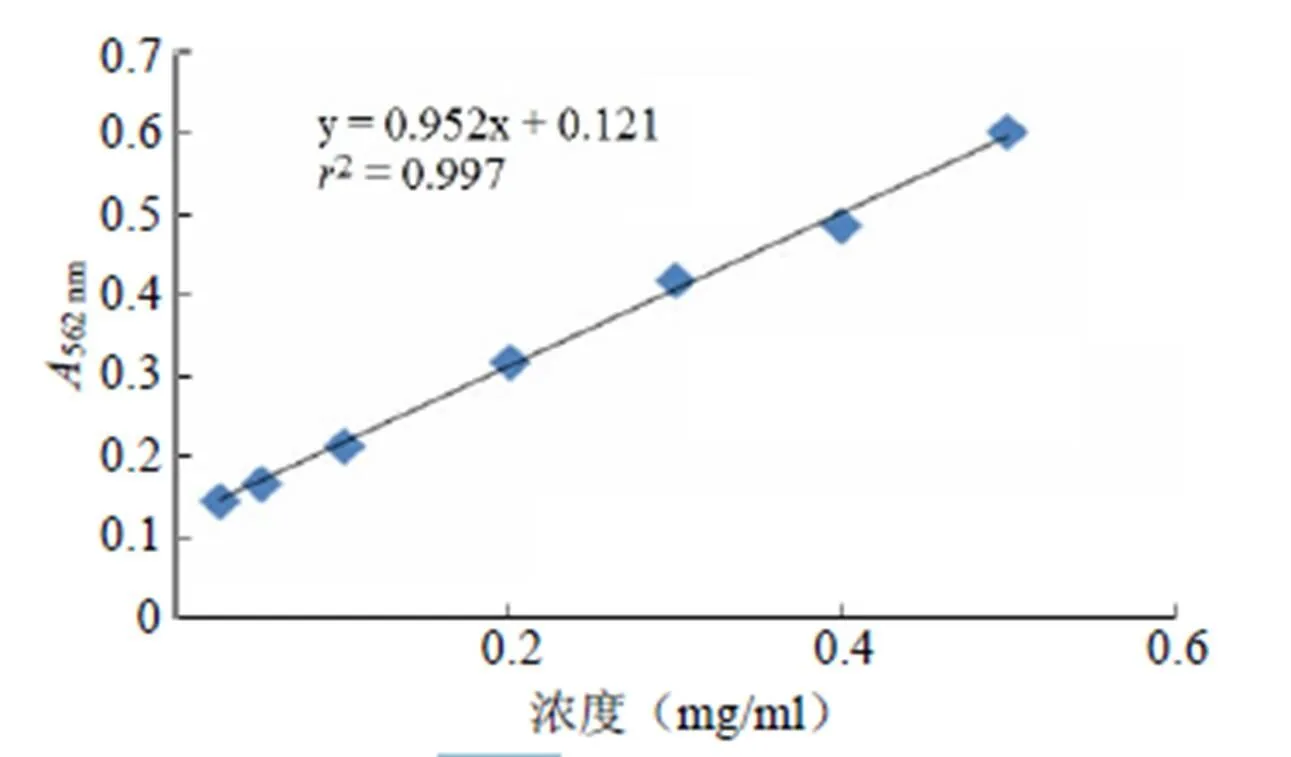
图 1 BCA 法标准曲线图
2.2 3 种检测方法对蛋白含量测定结果比较
3 种检测方法对蛋白含量测定结果见表 1。
由表 1 结果可以看出,3 个平行检测值的变异系数均 < 5%,说明实验操作过程误差小,实验结果可靠。对照品 BSA 溶液的 3 种检测方法的蛋白含量结果接近一致,而3 批原液的检测结果,凯氏定氮法与紫外吸收法检测结果接近,BCA 法则比其他两种方法检测值高出 50% 以上,详细的比较结果见表 2。
对供试品 Textilinin-1 蛋白与标准品 BSA 蛋白的还原性氨基酸数量进行比较分析,结果见表 3。Textilinin-1 蛋白中含有的还原性氨基酸比例为 15.25%,BSA 蛋白的比例为 9.78%。
3 讨论
曲耀成和姚雪[5]将蛋白含量测定方法系统地分成 3 类:标准定量法(包括凯氏定氮法和氨基酸分析法)、比色分析法(包括 Lowry 法、双缩脲法、BCA 法和 Bradford 法)以及紫外吸收法。本实验采取的 3 种检测分属于此 3 类方法。
凯氏定氮法是一种通过含氮量分析进行蛋白质含量测定的经典方法,其优点是定量准确,重现性好,被国际国内作为法定的标准检验方法。其缺点是操作复杂费时,试剂消耗量大。本实验对样品进行的凯氏定氮测定结果可以作为标准定量,以寻找更简便、快速、准确的方法。

表 1 3 种蛋白含量测定方法的测定结果

表 2 3 种检测方法的蛋白含量差异率的比较

表 3 Textilinin-1 蛋白和 BSA 蛋白中还原性氨基酸数量的比较
BCA 法反应原理为蛋白质将二价铜离子还原成亚铜离子,后者在碱性条件下与 BCA 络合生成紫红色络合物。此化合物在 562 nm 处有最大吸收波峰,反应物的颜色和蛋白浓度在一定范围内具有线性关系。BCA 法反应原理包括两个方面:一是蛋白中的肽键将 Cu2+还原为 Cu+,并且在60 ℃条件下,肽键将 Cu2+还原为 Cu+的作用比在室温更大;二是蛋白中的色氨酸(Trp)、酪氨酸(Tyr)、半胱氨酸(Cys)等还原性氨基酸将 Cu2+还原为 Cu+,这一反应与温度关系不大[6]。本研究中,3 批原液的 BCA 法检测值均高于凯氏定氮法检测值的 50% 以上,说明 BCA 法中使用的标准品 BSA 蛋白不能准确地定量供试品蛋白,其原因是两种蛋白之间的差异性较大,这些差异可能与蛋白质的氨基酸序列、等电点、蛋白质结构以及能够引起蛋白颜色反应产生显著变化的侧链或辅基等有关[7]。表 3 中供试品蛋白含有的还原性氨基酸比例为 15.25%,而标准品 BSA 蛋白的比例仅为 9.78%。因此, BCA 法检测供试品蛋白含量偏高的主要原因可能是因为供试品中还原性氨基酸含量比标准品 BSA 中还原性氨基酸含量高 50% 以上,从而增加了 Cu2+还原为 Cu+的数量,因此 Cu+与 BCA 络合生成紫红色络合物的产物就增加了,相应的检测值就高。
比色分析法中的其他方法的蛋白含量测定原理和 BCA 法相似,因此,通过BCA 法实验结果可以得到如下提示:在采用比色分析法之前,可以先对待测样品与标准品的氨基酸序列进行比较,如果待测样品的还原性氨基酸的含量与标准品相差较大时,就不适宜采用比色分析法进行测定。如果想要采用比色分析法定量,只有采用与待测样品相同的蛋白质作为标准品,才能有效避免实验误差。
紫外吸收法的原理是由于色氨酸、酪氨酸以及苯丙氨酸结构中的苯环含有共轭双键,因此赋予了蛋白质在 280 nm 处的紫外吸收特性。根据朗伯-比尔定律,在已知光程和消光系数的前提下,通过测定蛋白样品在波长 280 nm 的吸收值,即可获得蛋白含量。本实验结果表明用紫外吸收法与凯氏定氮法测定供试品蛋白含量差异小于 5%,其结果接近准确值。同时,与其他方法相比较,紫外吸收法还具有操作简单、快速、成本低、无污染的优势,并且测定后样品还可以回收使用。本方法的核心问题就是消光系数的确定,一般来说,通过基因重组技术获得的蛋白质药物,其序列信息已知,可以通过 Edelhoch 公式即 ε280=(5500 × nTrp)+(1490 × nTyr)+(125 × n S-S)计算蛋白的理论摩尔消光系数[8]。同时,在一般情况下获得的重组蛋白的纯度较高,通过凯氏定氮法准确定量蛋白质量,通过朗伯-比尔定律计算得到实测消光系数,并与理论消光系数对比,可以进一步确证消光系数,这样就能保证紫外吸收法测定蛋白含量的准确性。本实验的供试品蛋白为含有 59 个氨基酸的蛋白质,根据其 Trp、Tyr 及形成二硫键的数量,得到的理论摩尔消光系数为 4845,再除以蛋白分子量,得到理论百分比消光系数为 7.2。凯氏定氮法定量的供试品蛋白溶液测定 277 nm 下的紫外吸收值,通过公式计算得到实测的百分比消光系数为 7.3,与理论值相差为 1.4%,考虑到蛋白质在自然状态下的空间结构也许会对消光系数产生影响,因此采用实测百分比消光系数值 7.3。不同的蛋白可能会存在理论值与实测值差异较大的情况,因此,在对消光系数赋值时,都需要进行确证,以保证后续工作的准确性。目前,已有多种重组蛋白和抗体采用紫外吸收法进行蛋白含量的测定[9-11]。
通过对本研究结果进行比较分析,紫外吸收法具有准确、操作简单、快速的优势,因此确定紫外吸收法用于重组纤溶酶抑制剂 Textilinin-1 的蛋白含量测定。
通过对 3 类蛋白质定量检测方法的研究进行如下总结:对于还未获得蛋白标准品的情况下,可以先采用标准定量法(凯氏定氮法或氨基酸分析法)进行标准蛋白的标定及消光系数的测定,并与理论消光系数对比确证。当得到标准蛋白后,蛋白含量的测定可以采用比色分析法;当确证消光系数后,可以采用紫外吸收法。在实际工作中,对于一个全新的蛋白药物,在选择和确定检测方法时,尤其是涉及建立质量标准的研究,都需要根据目标蛋白的属性选择不同原理的方法、不同厂家的试剂进行系统分析和对比研究,最终确定合适的测定方法,保证实验结果的科学性和准确性。
[1] Masci PP, Whitaker AN, Sparrow LG, et al. Textilinins from Pseudonaja textilis textilis. Characterization of two plasmin inhibitors that reduce bleeding in an animal model. Blood Coagul Fibrinolysis, 2000, 11(4):385-393.
[2] Wang HY, Li N, Li XN, et al. Expression and application of textilinin-1, a plasmin inhibitor, in Pichia pastoris. J Snake, 2014, 26(3):273-277. (in Chinese)
王宏英, 李娜, 李秀娜, 等. 纤溶酶抑制剂textilinin-1在毕氏酵母的表达及应用. 蛇志, 2014, 26(3):273-277.
[3] Gao K, Ding YX, Zhang Y, et al. Establishment and calibration of the fourth batch national standard substance for protein content determination. Chin J Pharml Anal, 2007, 27(8):1215-1217. (in Chinese)
高凯, 丁有学, 张翊, 等. 第4批蛋白含量测定国家标准品的制备和标定. 药物分析杂志, 2007, 27(8):1215-1217.
[4] Gill SC, von Hippel PH. Calculation of protein extinction coefficients from amino acid sequence data. Anal Biochem, 1989, 82(2):319-326.
[5] Qu YC, Yao X. Research progress of methods for protein content determination in recombinant protein drugs. J Pharm Res, 2018, 37(3): 174-177. (in Chinese)
曲耀成, 姚雪. 重组蛋白类药物蛋白含量测定方法研究进展. 药学研究, 2018, 37(3):174-177.
[6] Smith PK, Krohn RI, Hermanson GT, et al. Measurement of protein using bicinchoninic acid. Anal Biochem, 1985, 150(1):76-85.
[7] Wiechelman KJ, Braun RD, Fitzpatrick JD, et al. Investigation of the bicinchoninic acid protein assay: Identification of the groups responsible for color formation. Anal Biochem, 1988, 175(1):231-237.
[8] Pace CN, Vajdos F, Fee L, et al. How to measure and predict the molar absorption coefficient of a protein. Protein Sci, 1995, 4(11):2411- 2423.
[9]Zhang GT, Yang Y, Li QC, et al. Content determination of recombinant human erythropoietin (Fc) fusion protein by ultraviolet spectrophotometry. Guide China Med, 2015, 13(10):65-66. (in Chinese)
张桂涛, 阳勇, 李庆昌, 等. 紫外法测定重组人红细胞生成素(Fc)融合蛋白的含量. 中国医药指南, 2015, 13(10):65-66.
[10] Wang L, Wu G, Yu CF, et al. Comparison between the theoretical and experimental extinction coefficient of a monoclonal antibody product. Chin Pharm J, 2016, 51(17):1508-1512. (in Chinese)
王兰, 武刚, 于传飞, 等. 一种单抗制品理论消光系数与实验确证结果的比较. 中国药学杂志, 2016, 51(17):1508-1512.
[11] Miranda-Hernández MP, Valle-González ER, Ferreira-Gómez D, et al. Theoretical approximations and experimental extinction coefficients of biopharmaceuticals. Anal Bioanal Chem, 2016, 408(5):1523-1530.
徐梅,Email:xumei@nkbp.com
2018-05-31
10.3969/j.issn.1673-713X.2018.06.015
