复合免疫亲和柱-高效液相色谱法同时测定谷物及其制品中9种真菌毒素
2018-12-06王韦岗端礼钦
王韦岗, 强 敏, 端礼钦
(1. 镇江市产品质量监督检验中心, 江苏 镇江 212132; 2. 徐州市农水畜禽产品质量检测中心, 江苏 徐州 221006)
真菌毒素是由产毒真菌在适宜的环境条件下产生的有毒代谢产物,广泛存在于粮食和饲料中。目前已知的真菌毒素有400多种,其中对人类健康影响较大的有黄曲霉毒素(AFT)、赭曲霉毒素A(OTA)、玉米赤霉烯酮(ZEN)和脱氧雪腐镰刀菌烯醇(DON)等[1,2],超过一定摄入量后会损坏人的肝功能、致癌、致畸并诱发免疫抑制性疾病[3]。世界卫生组织已将真菌毒素纳入食品安全体系重点监测对象[4],我国GB 2761-2017《食品安全国家标准食品中真菌毒素限量》也对上述几种真菌毒素在食品中的限量指标有严格的规定。随着食品中真菌毒素风险评估工作的不断深入,其限量指标也将进一步完善,对检测方法的准确性和灵敏度都提出了更高要求。百奥明公司的调查研究发现[5],一些粮食在生长和贮存过程中,经常被多种真菌毒素污染,因此,有必要建立对多种真菌毒素同时检测的方法。
真菌毒素的检测方法主要有酶联免疫法[6]、荧光光度法[7,8]、高效液相色谱法[9-11]和液相色谱-质谱联用法[12-14]等。酶联免疫法每次只能检测一种真菌毒素,通常用于快速筛查;荧光光度法易受基质干扰,测定黄曲霉毒素时需要进行化学衍生;液相色谱-质谱联用法由于设备较为昂贵,不利于检测方法的普及与推广;高效液相色谱法具有选择性好、抗干扰能力强、灵敏度高等优点,是目前测定真菌毒素使用最为普遍的方法之一。采用高效液相色谱法测定真菌毒素时,需要从复杂的样品基质中分离和富集待测组分,已有的文献报道中通常采用多功能净化柱[15,16]、固相萃取柱[17-19]或免疫亲和柱串联[20]的方式对提取的样品溶液进行净化处理,但是前两种方法受样品基质效应影响较大,净化不够彻底,容易产生干扰;当需要测定的真菌毒素种类较多时,免疫亲和柱串联的方式也难以适用。近些年,复合免疫亲和柱成了研究的热点[21-23],然而受到抗体种类的影响,商品化复合免疫亲和柱的使用仍有一定的局限性。
本实验有针对性地从商品化免疫亲和柱中获取所需填料,混匀并重新装填后制成真菌毒素复合免疫亲和柱,在此基础上,建立了在线光化学衍生-高效液相色谱同时测定谷物及其制品中黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、黄曲霉毒素M1(AFM1)、黄曲霉毒素M2(AFM2)、赭曲霉毒素A(OTA)、赭曲霉毒素B(OTB)和玉米赤霉烯酮(ZEN)的检测方法,并对实验条件进行了优化,该方法具有重现性好、灵敏度高、结果准确的特点,适用于实验室日常分析检测。
1 实验部分
1.1 仪器与设备
Waters e2695高效液相色谱仪、2475荧光检测器(美国Waters公司); ToxinFast光化学衍生器(由254 nm紫外灯、聚四氟乙烯反应管组成,北京华安麦科生物技术有限公司); 3-30K离心机(美国Sigma公司); CNW 12位固相萃取真空装置、ANPEL氮气吹干仪(上海安谱实验科技股份有限公司); Milli-Q Advantage A10超纯水系统(美国Millipore公司)。
1.2 材料与试剂
黄曲霉毒素总量免疫亲和柱(B1、B2、G1和G2)、黄曲霉毒素M族免疫亲和柱、赭曲霉毒素免疫亲和柱、玉米赤霉烯酮免疫亲和柱(均为0.2 mL胶/支,1 mL,美国Beacon公司);真菌毒素六合一免疫亲和净化柱(1.0 mL胶/支,6 mL,北京华安麦科生物技术有限公司);真菌毒素复合免疫亲和柱(0.8 mL胶/支,6 mL,实验室制备);乙腈、甲醇和乙酸(均为色谱纯,美国Tedia公司);氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、盐酸和吐温-20(均为分析纯,国药集团化学试剂有限公司);实验用水为Millipore超纯水系统制备的超纯水。
标准物质:黄曲霉毒素B1、B2、G1和G2(均为3 mg/L,美国o2si公司);黄曲霉毒素M1、赭曲霉毒素A和B(均为10 mg/L,美国o2si公司);玉米赤霉烯酮(50 mg/L,美国o2si公司);黄曲霉毒素M2(10 mg/L,美国Supelco公司)
1.3 测定条件
色谱柱:Venusil XBP C18 (250 mm×4.6 mm, 5 μm);流动相:A为甲醇,B为水(乙酸调节pH=3.0)。梯度洗脱:0~23 min, 36%A; 23~34 min, 36%A~80%A; 34~45 min, 80%A。流速:0.8 mL/min;进样体积:20 μL;柱温:30 ℃;荧光检测器:激发波长320 nm,发射波长450 nm。光化学衍生系统:光化学衍生器(254 nm紫外灯,连接于色谱柱,然后通向荧光检测器)。
1.4 溶液的配制
磷酸盐缓冲溶液(PBS):称取8.0 g氯化钠、1.2 g磷酸氢二钠、0.2 g磷酸二氢钾、0.2 g氯化钾,用900 mL水溶解,用盐酸调节pH至7.4,加水稀释至1 L。
含1%(体积分数,下同)吐温-20的PBS:取10 mL吐温-20,用PBS稀释至1 L。
9种真菌毒素混合标准溶液的配制:分别准确移取一定体积真菌毒素标准溶液于棕色容量瓶中,用乙腈稀释至刻度,制备成9种真菌毒素混合标准储备溶液,密封后避光于-20 ℃冰箱中保存。其中黄曲霉毒素B1、G1和M1的质量浓度为300 μg/L,黄曲霉毒素B2和G2的质量浓度为30 μg/L,黄曲霉毒素M2、赭曲霉毒素A和B的质量浓度为100 μg/L,玉米赤霉烯酮的质量浓度为2 mg/L。临用前,分别准确吸取一定体积的9种真菌毒素混合标准储备溶液,用初始流动相(甲醇:水(乙酸调节pH=3.0)=36∶64)逐级稀释,配制成相应浓度的混合标准工作溶液。
1.5 样品前处理
1.5.1真菌毒素复合免疫亲和柱的制备
取6 mL固相萃取柱空柱管,在底部铺上筛板,分别将黄曲霉毒素总量免疫亲和柱(B1、B2、G1、G2)、黄曲霉毒素M族免疫亲和柱、赭曲霉毒素免疫亲和柱、玉米赤霉烯酮免疫亲和柱中的填料全部转移至空柱管中,用PBS冲洗并使填料在柱内混合均匀,混匀后用真空泵将填料抽至近干,并用筛板将填料压实、压平,制成0.8 mL胶/支的真菌毒素复合免疫亲和柱。若长时间不用,需重新用PBS浸润填料,并放置于4 ℃冰箱中避光保存。
1.5.2样品提取与净化
称取(5.00±0.01) g预先粉碎并充分混匀的谷物及其制品于50.0 mL聚丙烯离心管中,加入20.0 mL乙腈-水(80∶20, v/v)提取液,涡旋振荡提取20 min,以6 000 r/min的速度离心5 min,上清液经玻璃纤维滤纸过滤后备用。
准确移取5.0 mL上清液,加入45.0 mL含1%吐温-20的PBS,混匀。以1~2滴/s的速度将上述混匀后的溶液全部通过真菌毒素复合免疫亲和柱,分别加入5.0 mL含1%吐温-20的PBS和10.0 mL水淋洗免疫亲和柱,待水滴完后,用真空泵抽干免疫亲和柱。用2.0 mL甲醇以1~2滴/s的速度洗脱免疫亲和柱,收集全部洗脱液至试管中。在50 ℃下用氮气缓缓地将洗脱液吹至近干,加入1.0 mL初始流动相,涡旋30 s溶解残留物,经0.22 μm尼龙滤膜过滤,收集滤液于进样瓶中以备进样。
2 结果与讨论
2.1 扫描波长的选择
采用Waters 2475荧光检测器3D(three-dimensional)扫描功能分别在波长250~400 nm和350~600 nm范围内对9种真菌毒素混合标准工作溶液进行扫描,测定9种真菌毒素光化学衍生产物的激发波长和发射波长,扫描结果见图1。结果表明,经光化学衍生后,黄曲霉毒素B1、B2、G1、G2、M1、M2、玉米赤霉烯酮、赭曲霉毒素A和B的最佳激发波长分别为355、355、362.5、355、362.5、355、310、332.5和310 nm;最佳发射波长分别为412.5、412.5、437.5、412.5、450、412.5、450、450和450 nm。综合考虑后选择激发波长320 nm、发射波长450 nm作为扫描波长,此时9种真菌毒素均具有较高的响应值。

图 1 9种真菌毒素光化学衍生后的激发和发射光谱图
2.2 流动相条件的选择
分别以乙腈-水、甲醇-水和甲醇-水-乙酸作为流动相,考察了不同流动相条件对9种真菌毒素峰形及分离情况的影响。以乙腈-水为流动相时,由于乙腈的洗脱能力较强,各组分之间不能完全分离;以甲醇-水为流动相时,通过调节流动相之间的比例能够使9种真菌毒素实现基线分离。然而,在此流动相条件下赭曲霉毒素B的响应较低,峰变宽,峰形较差,难以满足赭曲霉毒素B残留的检测要求。进一步优化流动相条件,发现往水相中加入少量乙酸溶液后,赭曲霉毒素B的响应明显增加,展宽消失,同时赭曲霉毒素A和B的保留时间都发生了变化,而其他几种真菌毒素的保留时间和峰形均无影响。调节水相中乙酸溶液的加入量,改变流动相的pH值,考察pH值对9种真菌毒素测定结果的影响。结果(见图2)表明,流动相pH值对9种真菌毒素的峰形、分离度和响应值有很大影响。当pH=3.5时,赭曲霉毒素B与玉米赤霉烯酮的保留时间完全重合;随着水相中乙酸溶液加入量的增加,流动相pH值减小,赭曲霉毒素A和B的保留时间变短,当pH=3.0时,9种真菌毒素实现基线分离,且峰形和响应值均能满足检测要求;继续减小流动相pH值,当pH=2.8时,黄曲霉毒素的保留时间变短,响应值降低,同时赭曲霉毒素A与玉米赤霉烯酮的保留时间完全重合。因此,确定以甲醇-水作为流动相,并用乙酸调节水相pH=3.0,在此条件下对9种真菌毒素进行测定。
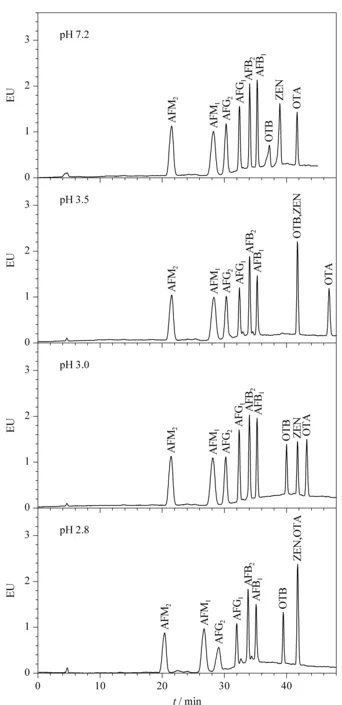
图 2 流动相pH值对9种真菌毒素测定结果的影响
2.3 光化学衍生对测定结果的影响
9种真菌毒素中黄曲霉毒素B1和G1在水溶液中会发生荧光淬灭,直接测定时荧光强度较弱,因此需要采用衍生的方法增强黄曲霉毒素B1和G1的荧光强度。常用的衍生方法有:柱前三氟醋酸衍生、柱后溴衍生和柱后碘衍生[24,25]等,其衍生过程、检测灵敏度及重现性易受衍生温度、时间和衍生试剂等因素影响。本试验利用环状化合物在紫外光照射下能产生荧光这一特性,采用在线光化学衍生技术,以流动相中的水作为衍生剂,对黄曲霉毒素B1和G1进行衍生化处理,使流动相中的水与黄曲霉毒素B1和G1作用,在芳烃上导入给电子基团-OH,生成荧光更强、更稳定的化合物,从而解决了黄曲霉毒素B1和G1在水溶液中发生荧光淬灭的问题,增强了黄曲霉毒素的荧光强度[26]。图3为光化学衍生前后9种真菌毒素混合标准工作溶液测定色谱图。从图中可以看出,经光化学衍生之后黄曲霉毒素B1和G1的荧光响应强度明显提高,其他7种真菌毒素的荧光响应影响较小。

图 3 光化学衍生前后9种真菌毒素混合标准工作溶液的色谱图
2.4 自制真菌毒素复合免疫亲和柱性能评价
吸取1.0 mL相应浓度的9种真菌毒素混合标准工作溶液于50 mL聚丙烯离心管中,加入50.0 mL含1%吐温-20的PBS,混匀,分别采用自制真菌毒素复合免疫亲和柱、商品化的真菌毒素六合一免疫亲和净化柱按照1.5.2节的方法进行过柱、淋洗、洗脱和测定,每种免疫亲和柱平行测定3次,测定结果见表1。从表中可以看出,自制复合免疫亲和柱与商品化复合免疫亲和柱均具有较好的回收率,回收率均大于85%,自制复合免疫亲和柱的相对标准偏差(RSD)为0.7%~2.2%,略低于商品化复合免疫亲和柱(RSD值为0.6%~1.7%)。结果表明,自制复合免疫亲和柱的回收率和精密度能够满足实验要求。
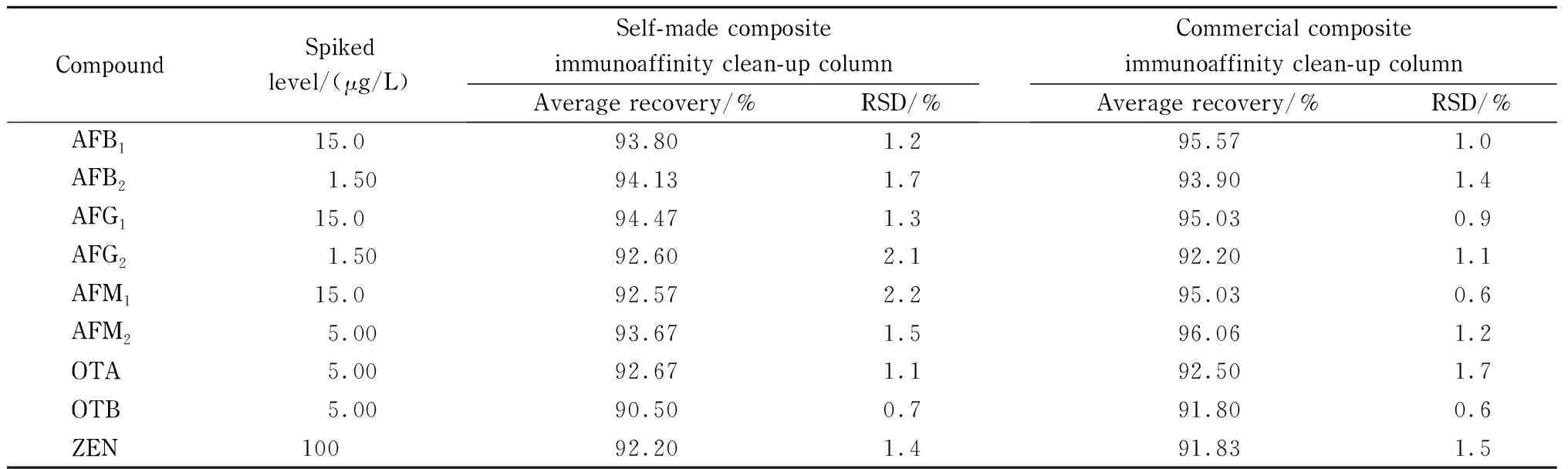
表 1 9种真菌毒素在不同免疫亲和柱上的平均回收率和精密度(n=3)
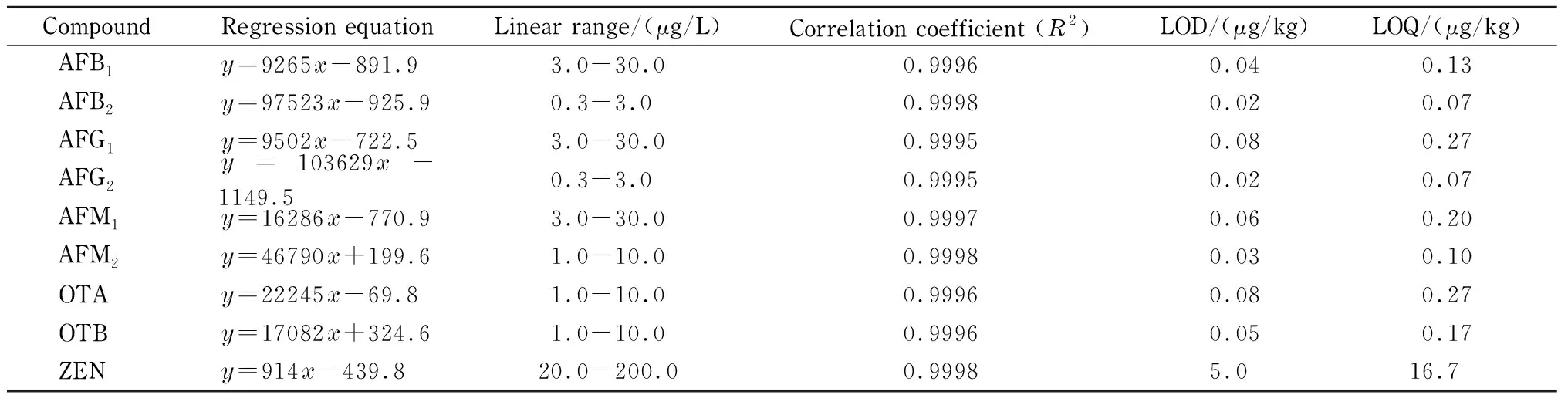
表 2 方法的回归方程、线性范围、相关系数、检出限(LOD)和定量限(LOQ)
y: peak area;x, mass concentration, μg/L.
2.5 标准曲线、线性范围及检出限
分别准确吸取适量体积的9种真菌毒素混合标准储备液,用初始流动相逐级稀释成一定浓度的混合标准工作溶液,按1.3节优化后的实验条件进行测定,以峰面积(y)对质量浓度(x, μg/L)作图,所得回归方程、线性范围和相关系数(R2)如表2所示。向空白样品中添加低浓度水平的9种真菌毒素混合标准溶液,采用自制真菌毒素复合免疫亲和柱,按照1.5.2节的方法进行样品前处理后上机检测,以S/N=3确定检出限(LOD),S/N=10确定定量限(LOQ)。结果(见表2)表明,采用外标峰面积法定量,9种真菌毒素在相应的浓度范围内均具有良好的线性关系,相关系数(R2)大于0.999,该方法线性范围良好,检出限低,可满足实际样品的检测。
2.6 方法的加标回收率和精密度
分别向预先粉碎并混匀的空白大米、小麦粉和玉米样品中加入低、中、高3种质量浓度的9种真菌毒素混合标准工作溶液,采用自制真菌毒素复合免疫亲和柱进行样品前处理,并按照1.3节方法进行测定,考察方法的回收率。对加标样品重复测定6次,考察方法的精密度。结果表明,9种真菌毒素的回收率均在80%以上,RSD为1.0%~5.6%,详细结果见表3。

表 3 大米、小麦粉和玉米中9种真菌毒素在不同加标水平下的加标回收率和精密度(n=6)
2.7 实际样品分析
从超市随机购买50批谷物及其制品,包含大米、小麦粉、麦片、玉米和玉米面等,采用该方法测定样品中9种真菌毒素的残留量。在2个麦片样品和3个玉米制品中检出了黄曲霉毒素B1,含量分别为0.25、0.58、0.22、0.31和0.71 μg/kg,玉米赤霉烯酮的检出率较高,在小麦粉、玉米和玉米淀粉等9个样品中均有检出,含量从19.17至53.06 μg/kg不等,未超过GB 2761-2017规定的限量指标,除此之外的其他7种真菌毒素均未检出。分别采用GB 5009.22-2016第三法和5009.209-2016第一法测定阳性样品中的黄曲霉毒素B1和玉米赤霉烯酮[25,27],测得黄曲霉毒素B1的含量为0.24~0.73 μg/kg,玉米赤霉烯酮的含量为19.62~55.35 μg/kg。结果表明,本文建立的在线光化学衍生-高效液相色谱同时测定谷物及其制品中9种真菌毒素的方法及自制真菌毒素复合免疫亲和柱能够满足食品安全国家标准规定要求。
3 结论
本文采用自制真菌毒素复合免疫亲和柱净化样品,富集谷物及其制品提取液中的9种真菌毒素,并基于紫外光照射能够增强黄曲霉毒素B1和G1的荧光强度,建立了在线光化学衍生-高效液相色谱同时测定谷物及其制品中9种真菌毒素的方法。采用本方法,可以依据真菌毒素种类选择合适填料自制真菌毒素复合免疫亲和柱,既能减少抗体的浪费,同时还能够利用抗体抗原的特异性和高选择性从复杂的待测样品中提取目标化合物,避免无关待测物质对目标化合物的干扰。该方法的各项指标能够满足谷物及谷物制品中9种真菌毒素检测的要求。
猜你喜欢
杂志排行
色谱的其它文章
- 获2017年度领跑者5000
--中国精品科技期刊顶尖学术论文入选证书的《色谱》论文名单 - Determination of airborne formaldehyde and ten other carbonyl pollutants using programmed temperature vaporization-large volume injection-gas chromatography
- 重组含糖识别结构域的人源半乳糖凝集素-3在糖蛋白/糖肽富集中的应用
- QuEChERS-液相色谱-串联质谱法测定蔬菜中105种农药残留
- 超高效液相色谱-串联质谱法测定热带水果中杀虫双残留
- 高效液相色谱-串联质谱法分析毛发中甲基苯丙胺和苯丙胺手性对映异构体
