四川地区一株猪源鼠伤寒沙门菌的分离与鉴定
2018-12-05,,,,,,,,
, , , , , , , ,
(四川省动物疫病预防控制中心,四川 成都 610041)
0 引言
沙门菌(Salmonellae)是革兰阴性杆菌,兼性厌氧,隶属肠杆菌科、沙门菌属。沙门菌是一种重要的人兽共患病病原,每年全世界会有数千人因沙门菌感染而住院或死亡。沙门菌依据不同的O抗原和H抗原,迄今已检出2 500种以上的血清型。人最常见的是鼠伤寒沙门菌和肠炎型沙门菌。猪可感染多个血清型,除鼠伤寒沙门菌和猪霍乱沙门菌外,很少有其他血清型能引起猪临床发病[1-2]。20世纪90年代初,沙门菌耐药性已成为一个全球性问题。临床上由于长期或超量使用抗生素沙门菌感染被有效控制的同时也加剧了细菌耐药性的产生[3]。因此,研究沙门菌的耐药性对于兽医临床用药风险的评估及指导兽医科学合理用药具有十分重要的意义。
本研究对分离自四川省资阳市某规模猪场的一株沙门菌进行了分离鉴定,采用全自动微生物分析系统对分离株的耐药情况进行分析,并从分子水平对其毒力基因的携带情况进行调查,从而为养猪生产中有效控制沙门菌感染以及合理使用抗生素提供科学依据,为四川省养猪业的健康可持续发展奠定基础。
1 材料与方法
1.1 主要仪器和试剂
PCR仪购自美国伯乐公司;VITEK 2 COMPACT 全自动微生物分析系统购自生物梅里埃公司;缓冲蛋白胨水(BPW)、木糖赖氨酸脱氧胆盐(XLD)琼脂、胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)、革兰氏染色液试剂盒购自青岛海博生物有限公司;沙门氏菌属诊断血清(60种)购自宁波天润生物药业有限公司;VITEK- 2 AST-GN13药敏卡购自四川德佩莱科技有限公司;premix Taq(Ex Taq Version 2.0)购自大连宝生物工程有限公司;引物合成自生工(上海)生物工程有限公司。
1.2 样品采集
样品于2017年9月采集自资阳市某规模猪场。用棉拭子随机采集不同阶段表观健康猪直肠粪便样本30份,随即接种于含3mL BPW培养基的试管中,带回实验室置于42℃摇床上震摇24~48 h预增菌,另取空白BPW培养基作为空白对照。
1.3 分离纯化
吸取适量预增菌液划线接种于XLD平板,37℃培养过夜;挑取可疑菌落,再次在XLD平板上划线纯化,37℃培养过夜;挑取单菌落进行革兰染色镜检,将疑似沙门菌的单菌落接种于TSB液体培养基和TSA平板,37℃培养过夜,待用。
1.4 InvA基因PCR鉴定及16S rDNA测序
以菌液为模板,利用沙门菌特异性基因invA引物[4]及16S rRNA通用引物进行PCR扩增(引物序列见表1)。PCR反应体系为:2×PCR premix 12.5 μL,上下游引物各1μL,DNA模板2μL,补灭菌超纯水使最终反应体系为25μL。PCR产物于1.5%琼脂糖凝胶电泳30min后分析结果。同时,16S rRNA基因PCR产物送上海生工公司测序,测序结果在GenBank上进行序列比对。
1.5 血清型鉴定
按照GB 4789.4-2016的方法,用沙门氏菌属诊断血清(60种)对分离的沙门菌进行血清型鉴定。运用玻板凝集法,先进行O抗原的鉴定,采用A-F多价O血清及单因子O血清判断菌株所属血清群;再采用H因子血清鉴定其鞭毛抗原,判断菌株种属。
1.6 耐药性检测
使用VITEK 2 COMPACT 全自动微生物分析系统对分离的菌株进行耐药性检测,方法按照VITEK- 2 AST-GN13药敏卡操作说明书进行。
1.7 毒力基因检测
根据文献设计沙门菌毒力质粒(spvA、spvB、spvC、spvD、spvR)[5,6]和毒力岛(SPI)(ssaQ、sscA、sseC、sseD、sseE、sopB、mgtC)[5-7]两大类毒力基因引物,由生工(上海)生物工程有限公司合成(引物序列见表1)。PCR反应体系为:2×PCR premix 12.5μL,上下游引物各1μL,DNA模板2μL,补灭菌超纯水使最终反应体系为25μL。PCR产物于1.5%琼脂糖凝胶电泳30min后分析结果。

表1 PCR所用引物序列
2 结果
2.1 细菌分离培养
从采集的表观健康猪直肠粪便样本中分离到疑似沙门菌1株。分离株在XLD平板上生长良好,呈现为带有黑色金属光泽的中等大小菌落,菌落周围培养基呈粉红色(图1);在TSA平板上生长良好,呈现为乳白色的中等大小菌落,边缘光滑(图2)。革兰染色镜检为革兰阴性、两端钝圆、短小杆菌、无荚膜、不形成芽孢(图3),与沙门菌的特征一致。

图1 分离株在XLD平板上的形态

图2 分离株在TSA平板上的形态
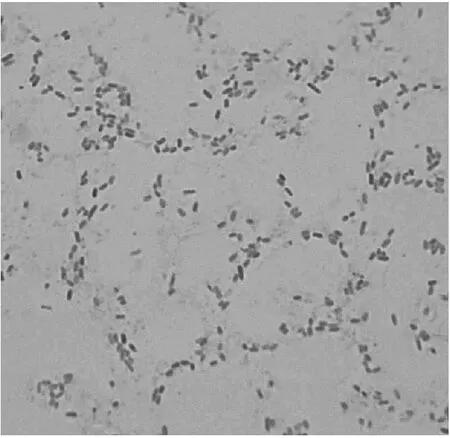
图3 分离株革兰染色形态
2.2 PCR鉴定及测序
以分离株纯培养菌液为模板,PCR扩增后在1.5%琼脂糖凝胶上进行电泳,可见invA基因约280bp、16S rRNA基因约1500bp的特异性条带,扩增产物的大小与预期结果一致(图4)。16S rRNA基因PCR产物经测序后比对,结果表明该序列与NCBI上沙门菌的16S rRNA基因序列的同源性达到99%,由此确定分离株为沙门菌。

M:100bp DNA Ladder; 泳道1:invA; 泳道2:16S rRNA; 泳道3:spvA; 泳道4:spvB; 泳道5:spvC; 泳道6:spvD; 泳道7:spvR; 泳道8:ssaQ; 泳道9:sscA; 泳道10:sseC; 泳道11:sseD; 泳道12:sseE; 泳道13:sopB; 泳道14:mgtC.
图4 PCR扩增电泳图
2.3 血清型鉴定结果
分离株能与O多价A-F群血清发生凝集反应,经血清型鉴定为鼠伤寒沙门菌,其血清型抗原式为O4Hi。
2.4 耐药性检测结果
根据VITEK 2 COMPACT 全自动微生物分析系统耐药性检测结果,分离株对哌拉西林、头孢他啶、头孢曲松、头孢吡肟、氨曲南、厄他培南、亚胺培南、环丙沙星、左氧氟沙星、呋喃妥因、复方新诺明敏感,对氨苄西林、舒巴坦、头孢唑啉、头孢替坦、阿米卡星、庆大霉素、妥布霉素耐药(表2)。

表2 分离株对不同抗菌药的耐药情况
注:S:敏感;R:耐药;*R:检测结果经VITEK2高级专家系统 (AES)修订后认定为耐药。
2.5 毒力基因携带情况
毒力基因检测结果表明,分离株不携带spvA、spvB、spvC、spvD、spvR 5个spv毒力质粒基因,而对ssaQ、sscA、sseC、sseD、sseE、sopB、mgtC 等7个SPI基因的检测结果均为阳性。
3 讨论
本文分离的沙门菌菌株属于肠道沙门菌肠道亚种鼠伤寒血清型。鼠伤寒沙门菌具有较广泛的宿主范围,可引起多种动物的小肠结肠炎和败血症,也是导致人类食物中毒的主要细菌,对公众健康具有潜在的威胁。沙门菌致病机制较为复杂,具有多种毒力基因,主要存在于毒力质粒和染色体上的SPI中。在沙门氏菌的毒力质粒中,spv与细菌的毒力表型关系最为密切,包括spvA、spvB、spvC、spvD、spvR基因等,其编码的产物能增强细菌在宿主细胞内生长,与肠系膜淋巴结、脾、肝等肠道外组织感染有关[8]。程琼等[5]的研究结果表明,spv的存在能增强沙门菌菌株的致病力。除spv外,沙门菌大多数毒力基因由染色体上的SPI编码。目前已发现的SPI有十几个。其中,本研究中检测的ssaQ、sscA、sseC、sseD、sseE为SPI2的主要基因,编码与系统感染有关的Ⅲ型分泌系统;mgtC位于SPI3,与细菌在宿主巨噬细胞内生存以及系统感染阶段细菌在低Mg2+环境中的生长有关;sopB位于SPI5,主要与肠道疾病的发生有关,参与炎症和氯化物分泌[7]。本研究的检测结果表明,分离株携带有毒力岛SPI2、SPI3、SPI5,但不携带毒力质粒spv。毒力质粒spv的缺失是否对分离株致病性有所影响还需通过动物试验进一步验证。
本研究对分离的猪源鼠伤寒沙门菌进行了18种抗菌药的耐药性分析。结果表明,分离株对其中大部分抗菌药表现出较高的敏感性,可为临床用药提供参考;但对氨苄西林、舒巴坦、头孢唑啉等7种抗菌药表现出不同程度的耐药,临床上应慎用。近年来,随着养殖业规模化、集约化的不断发展,猪群在应激、免疫抑制等不利因素作用下,很容易发生沙门菌的继发、并发感染。由于抗生素的滥用和不规范使用,沙门菌的耐药性不断增强,使抗生素在沙门菌病防控中的作用大打折扣;加之沙门菌血清型众多,使用疫苗防控的难度亦较大。因此,猪场在防控沙门菌病时,应以加强饲养管理、定期消毒为主,并结合药敏试验筛选敏感药物等综合措施,才能取得较好防控的效果。
