沉默Chk2基因对DADS阻滞人胃癌BGC823细胞G2/M期的影响
2018-12-04,,,,,,*
, , , , , , *
(1.湖南省肿瘤细胞与分子病理学重点实验室,湖南省胃癌研究中心,南华大学肿瘤研究所, 湖南 衡阳 421001;2.湖南省中医高等专科学校附属一医院肿瘤科)
研究表明,在对DNA损伤的反应中,细胞周期检查点可在G1期、S期和G2/M过渡中激活,检查点激酶1(checkpoint kinase1,Chk1)与检查点激酶2(checkpoint kinase 2,Chk2)是G2/M期检查点的两个关键激酶。近年来,采取DNA损伤药物与靶向Chk1/2药物相结合,显著提高治疗效果[1]。
二烯丙基二硫(diallyl disulfide, DADS)是一种从大蒜中提取的脂溶性有机硫化合物,可抑制多种恶性肿瘤细胞增殖[2]。本实验室前期工作表明,DADS能明显抑制人胃癌MGC803细胞增殖和阻滞G2/M期,与激活p38通路、抑制ERK/AP-1通路有关[3-4]。并且,Chk2基因高表达可促进DADS阻滞MGC803细胞G2/M期的作用[5]。本文研究沉默Chk2基因对DADS阻滞人胃癌BGC823细胞G2/M期的影响。
1 材料与方法
1.1细胞与试剂人低分化胃癌细胞株BGC823由本实验室保存。DADS为Fluka公司产品。BCA蛋白定量试剂盒为Pierce公司产品。siRNA转染试剂、siRNA转染培养基及Chk2 siRNA、Lipofectamine2000、Chk2、Cyclin B1与β-actin抗体及ECL发光检测试剂盒购自Santa Cruz公司。Cdc25C鼠单克隆抗体(NeoMarkers公司)。新生牛血清购自杭州四季青生物工程公司。引物利用Primer Premier 5.0软件进行引物设计,由上海生工公司合成。
1.2细胞培养BGC823细胞用含10%小牛血清的RPMI-1640培养液培养于37 ℃,含5%CO2,恒湿恒温培养箱中培养。细胞铺满培养瓶后传代,0.175%胰蛋白酶消化3 min,倾去胰酶,加适量含血清培养液吹打成单细胞悬液,按所需浓度接种。转染Chk1 BGC823细胞用含200 μg/mL G418、10%小牛血清的RPMI-1640培养液培养于37 ℃,含5%CO2,恒湿恒温培养箱中培养。细胞呈单层生长,铺满培养瓶后传代,传代时常规吸去培养液,用0.175%胰蛋白酶消化3 min,倾去胰酶,加适量含血清培养液吹打成单细胞悬液,按所需浓度接种。
1.3 siRNA沉默Chk2基因Chk1小干扰RNA (siRNA)按照说明书,3×105/孔BGC823细胞接种于6孔板中,siRNA稀释于siRNA转染培养基中,与Lipofectamine2000混合,在siRNA最终浓度为100 nmol/L时进行转染,非特异性siRNA转染作为对照。qRT-PCR和Western blot检测RNA干扰的效果。设计并合成q-PCR引物:Chk2:F 5-′CTCG GGAGTCGGATGTTGAG-3′,R 5′-GA GTTTGGCAT CGTGCTGGT-3′,产物长度142 bp;β-actin:F 5′ATCTGGCACCAC ACCT3′,R 5′CGTCATACTCCTGCTT3′,产物长度203 bp。各基因扩增条件:Chk2:95 ℃ 5 min,35个PCR循环(95 ℃ 10 s,58 ℃ 15 s,72 ℃ 20 s,86.5 ℃ 5 s;GAPDH:95 ℃ 5 min,35个PCR循环(95 ℃ 10 s,58 ℃ 15 s,72 ℃ 20 s,86 ℃ 5 s。检测结果进行标准曲线分析,对待测样品的目的基因进行定量。
1.4流式细胞仪检测收集培养细胞,离心1 000 rpm×5 min,用预冷PBS液重悬细胞,离心1 000 rpm×5 min,重复一次;将收集的细胞用4 ℃预冷的75%乙醇固定细胞,冰盒送检。样本上机前,将乙醇固定的细胞离心洗涤,去上清,摇匀;加RNA酶0.5 mg/mL 50 μL,37 ℃水浴30 min;加碘化丙啶1 mg/mL 50 μL,振荡混匀,置冰箱30 min;300目尼龙网滤过,计数10 000个细胞,上机进行细胞周期和DNA含量分析。
1.5 Western blot检测收集1×106个细胞,加100 μL裂解液,冰上裂解1 h,低温高速离心收集蛋白,BCA蛋白定量测定蛋白浓度。每孔加30 μg蛋白,以5∶1体积与5×SDS缓冲液混合,100 ℃ 5 min,10%SDS-PAGE凝胶电泳后转移至硝酸纤维素膜上,用含5%脱脂牛奶的TBST(Tris-HCl 20 mmol/L,NaCl 137 mmol/L含0.1%Tween-20)封闭2 h,TBST洗膜3次,一抗37 ℃孵育2 h,TBST洗3次,每次15 min,二抗孵育1 h,TBST洗3次,每次10 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定印迹区带的光密度值。
1.6统计学处理所有结果数据以均数±标准差表示,用统计学软件SPSS13.0进行数据分析,采用t检验或one-way ANOVA比较组间差异,P<0.05为差异有显著性。
2 结果
2.1流式细胞检测根据文献[6],采用15 mg/L DADS作用BGC823细胞12 、24 、36 、48 h后,G2/M期细胞分别为20.4%、39.5%、32.8%、20.03%较对照组的10.1%、16.6%、14.7%、13.5%均明显增加(P<0.05),表明DADS可呈时间依赖性阻滞BGC823细胞G2/M期(表1)。
2.2 Chk2沉默对BGC823细胞Chk2表达的影响为了确定Chk2是否影响DADS诱导G2/M阻滞,通过RNA干扰沉默Chk2基因,实验分为对照组、空载体组与Chk2沉默组。q-PCR与Western blot检测结果显示,BGC823细胞经Chk2 siRNA转染24 h后,Chk2 mRNA与蛋白表达下调 (P<0.05)(图1,图2)。
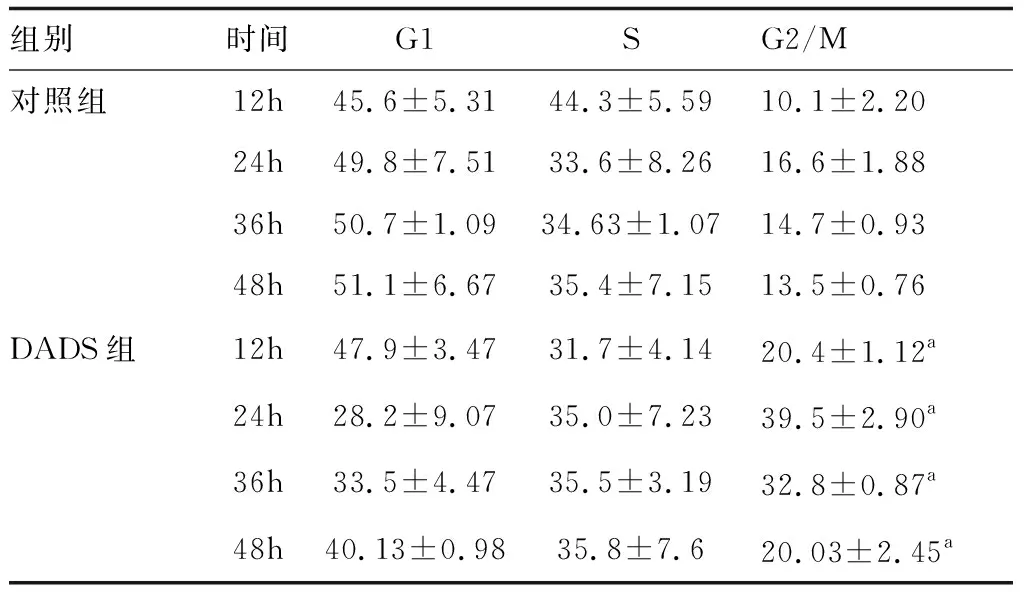
表1 DADS对BGC823细胞周期的影响(n=3)
与对照组相同时间比较,aP<0.05
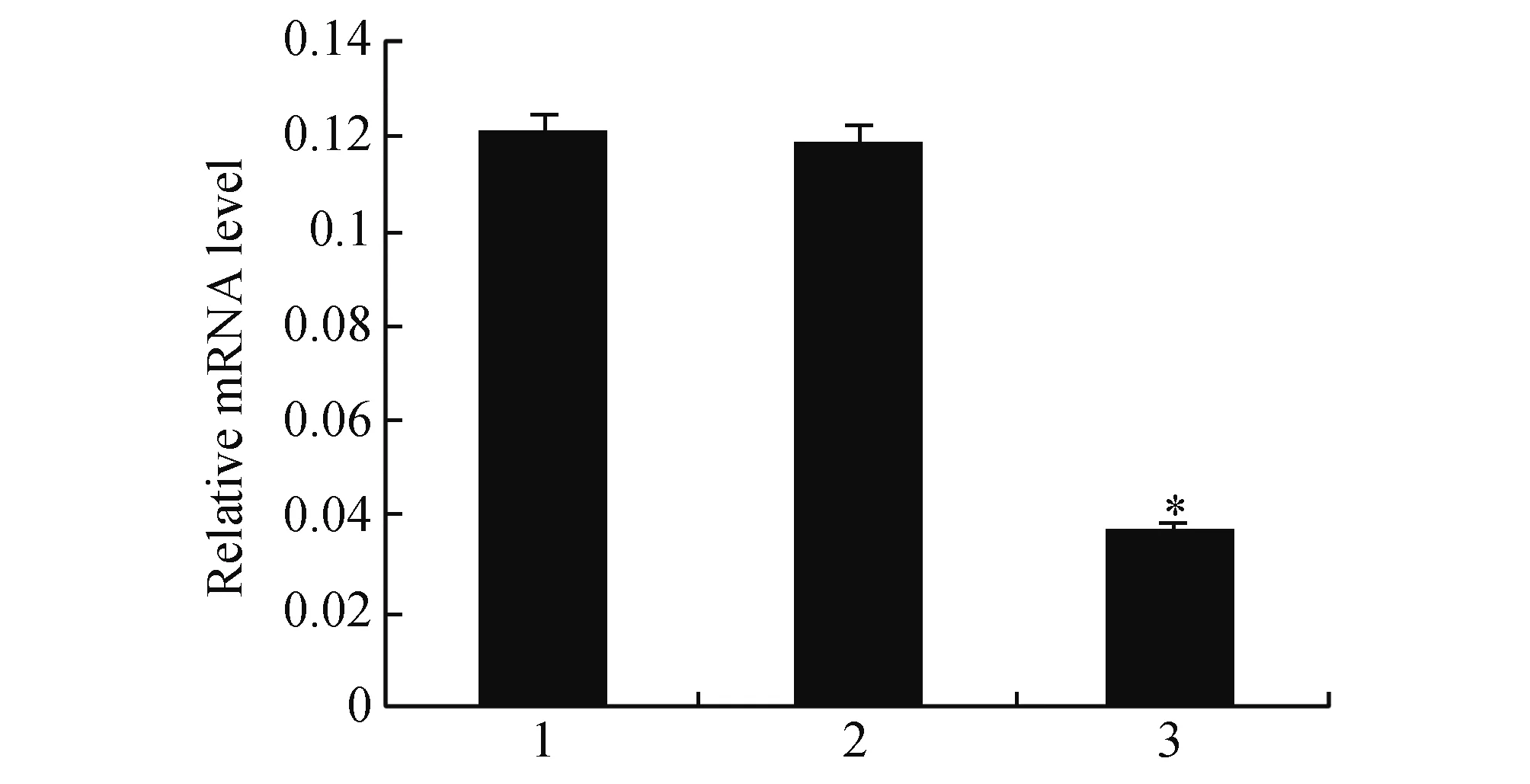
图1 Chk2沉默对BGC823细胞Chk2 mRNA表达的影响1:对照组;2:空载体组;3:si-Chk2沉默组 与对照组和空载体组比较,*P<0.05
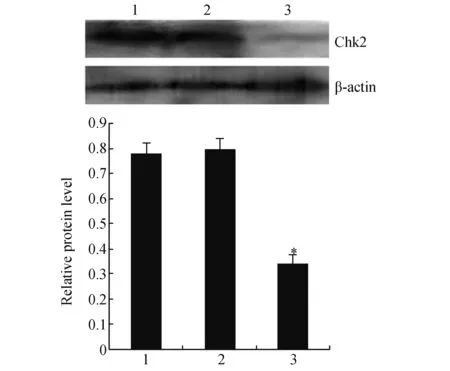
图2 Chk2沉默对BGC823细胞Chk2蛋白表达的影响1:对照组;2:空载体组;3:si-Chk2沉默组 与对照组和空载体组比较,*P<0.05
2.3 Chk2沉默对DADS阻滞BGC823细胞G2/M期的影响结果显示,Chk2沉默组G2/M期细胞15.4%较空载体组14.2%差异无显著性(P>0.05)。经DADS处理后,Chk2沉默组与对照组G2/M期细胞分别为31.1%与33.2%(P>0.05),但是,较未处理Chk2沉默组与对照组明显增加 (P<0.05,见图3)。表明Chk2沉默对BGC823细胞G2/M无影响,也不影响DADS阻滞BGC823细胞G2/M的作用。
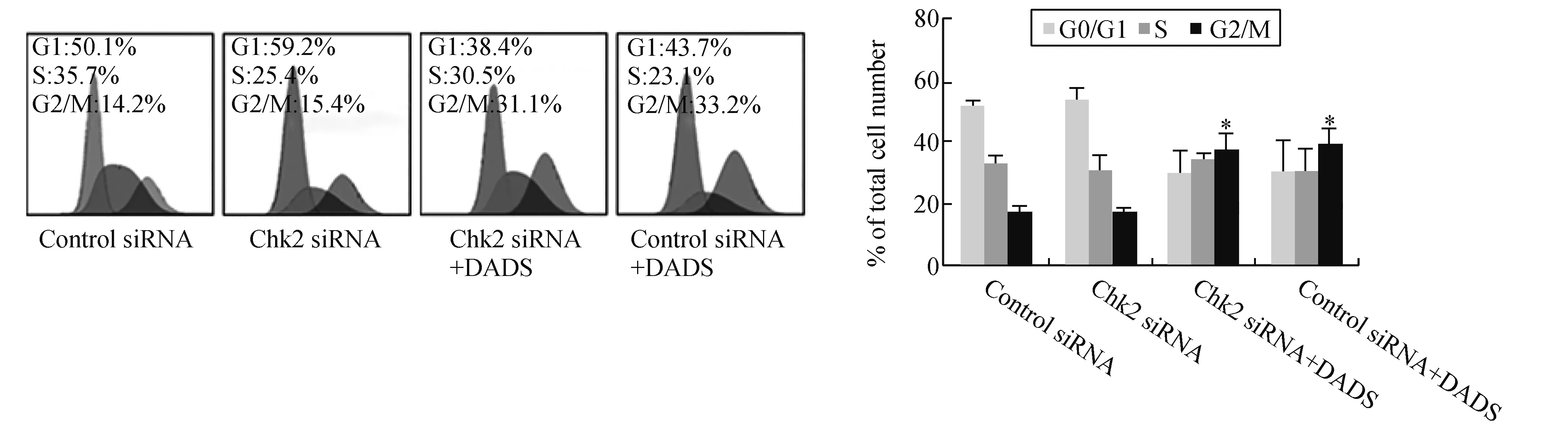
图3 Chk2沉默对DADS阻滞BGC823细胞G2/M期的影响
2.4 Chk2沉默对DADS作用BGC823细胞Cdc25C与cyclin B1表达的影响Western blot检测结果显示,Chk2基因沉默后,CDC25C和CyclinB1表达较对照组差异无显著性(P>0.05)。但是,15 mg/L的DADS处理对照组与Chk2沉默组后,CDC25C和CyclinB1表达水平较对照组明显降低 (P<0.05),而DADS处理对照组与Chk2沉默组之间差异无显著性(P>0.05,见图4)。表明沉默Chk2对CDC25C和CyclinB1表达没有影响,而且对DADS作用也没有影响。
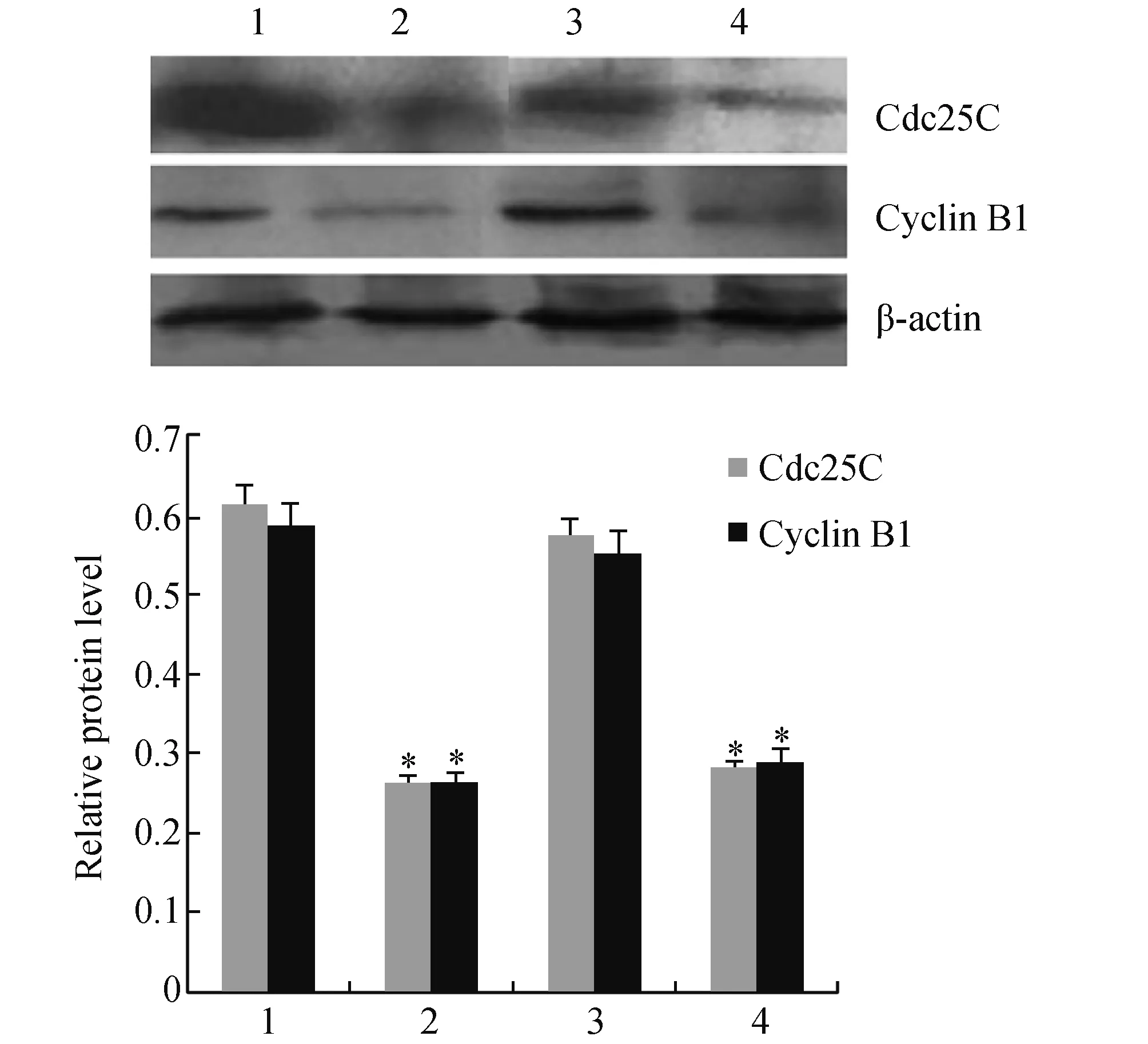
图4 Chk2沉默对DADS作用BGC823细胞 Cdc25C与cyclin B1表达的影响1:对照组;2:DADS组;3:si-Chk2组;4:si-Chk2+DADS组 与对照组比较,*P<0.05
3 讨 论
大量研究表明,许多靶向Chk1/2药物可阻滞肿瘤细胞G2/M,抑制肿瘤细胞增殖。乙酰-大萼香茶菜素B (A-mac B)可激活Chk1/2-Cdc25C-Cdc2/cyclin B1通路诱导G2/M阻滞[7]。Rabdocoestin B通过上调Chk1/Chk2-Cdc25C通路,下调Cdc2/Cyclin B1表达,抑制G2的过渡,阻滞食管癌细胞G2/M[8]。中草药广防风中分离出的ovatodiolide可激活DNA损伤的相关分子ATM/ATR和CHK1/CHK2,下调Cyclin B1和CDC25C阻滞肺癌细胞G2/M[9]。Jaridonin可显著诱导胃癌MGC803细胞中G2/M期阻滞,其机制与激活ATM和Chk1/2以及Cdc2和CDK2磷酸化失活有关[10]。二氢杨梅素通过Chk1/Chk2/Cdc25C通路阻滞G2/M与抑制肝细胞癌细胞增殖[11]。然而,DADS阻滞MGC803细胞G2/M是通过ATR/Chk1/CDC25C/cyclin B1通路,作用靶点是Chk1,与Chk2无关[5]。
研究证明,Chk2在阻滞肿瘤细胞G2/M起着重要作用。SMYD3缺失可以通过ATM-Chk2/p53-Cdc25C途径抑制胃癌细胞的迁移、侵袭和增殖,并阻断G2/M期[12]。硫代苯醚哒嗪酮化合物IMB5043通过激活ATM/Chk2通路阻滞G2/M期,诱导细胞凋亡,抑制肝癌SMMC-7721细胞迁移和侵袭[13]。醉茄素A的亚型W-2b以剂量依赖性的方式促进肿瘤细胞Chk2磷酸化,阻滞G2/M期和上调p21表达[14]。curcumin通过靶向ATM/Chk2/p53信号通路诱导头颈部鳞状细胞癌凋亡、阻滞细胞周期与抑制血管生成,发挥其抗肿瘤活性[15]。鬼臼素类似物4DPG提高p-Chk2、Chk2和抑制Twist1活性,阻滞G2/M期和上调p21表达,显著降低肿瘤生长和转移[16]。引人注目的是,大蒜提取物通过激活ATM和Chk2,抑制Cdc25C和Cdc2磷酸化,下调cyclin B1和上调p21WAF1,显著抑制膀胱癌细胞增殖与阻滞G2/M期[17]。DATS通过ATM-Chk2-Cdc25c-p21WAF1-Cdc2信号通路阻滞膀胱癌EJ细胞G2/M期与抑制生长[18]。
本研究的目的是确定沉默Chk2在DADS阻滞BGC823细胞G2/M发挥什么作用。结果显示,DADS处理前后,Chk2沉默组G2/M期细胞较对照组差异无显著性。Chk2基因沉默后,CDC25C和CyclinB1表达较对照组无明显差异。但是,DADS处理Chk2沉默组后,CDC25C和CyclinB1表达水平较对照组明显降低,而DADS处理对照组与Chk2沉默组之间差异无显著性。表明Chk2沉默对BGC823细胞G2/M与CDC25C和CyclinB1表达无影响,而且对DADS作用也没有影响。
综上所述,Chk2沉默对人胃癌BGC823细胞G2/M阻滞与DADS作用没有影响,DADS阻滞G2/M的检查点不是Chk2。但是,大蒜提取物与DATS可通过ATM-Chk2-Cdc25c通路阻滞膀胱癌细胞G2/M,而Chk2沉默却对DADS阻滞BGC823细胞G2/M与CDC25C和CyclinB1表达无影响,这是否是由于作用的肿瘤细胞不同或DADS有机硫化合物的作用机制不同,阐明这个问题尚待进一步探讨。
