骨髓间充质干细胞移植对脑动脉栓塞大鼠VEGF165、 Notch1表达的影响
2018-12-04,,,,
, ,, ,
(池州市人民医院神经外科,安徽 池州 247000)
动脉栓塞(middle cerebral artery occlusion,MCAO)是指栓子沿血液循环进入脑动脉系统,引起动脉管腔闭塞,致使该动脉供血区局部脑组织的坏死。MCAO是威胁人类健康的一种疾病,近年来发现促进脑内血管生成是一种新的恢复脑梗死的治疗手段。骨髓间充质干细胞(Bone Mesenchymal Stem Cells,BMSCs)是具有自我更新能力的一种细胞,可以多向分化为机体的各种细胞,其在体外诱导可以分化为神经细胞[1],在组织工程、基因工程、细胞移植方面有较好的临床应用前景,BMSCs移植是治疗脑血管疾病一种新的治疗方法。本实验通过建立大鼠脑动脉栓塞模型,观察BMSCs移植后脑组织微血管密度(micro-vascular density,MVD)、血管内皮生长因子(vascular endothelial growth factor,VEGF)165、Notch1的表达,来探究BMSCs促进血管新生的机制。
1 材料与方法
1.1材料与试剂实验动物:45只健康雄性SD大鼠,体质量(260±20)g;10只健康雄性SD大鼠,体质量(90±10)g,购自北京维通利华实验技术有限公司,许可证号SCXK(京)2011-0011。
主要试剂:胎牛血清、DMEM培养基、胰酶、双抗(Gibico,美国);兔抗鼠Ⅷ因子多克隆抗体(Preprotech,美国);小鼠抗大鼠Notch1抗体(Chemicon,美国);兔抗大鼠VEGF抗体(Preprotech,美国);辣根过氧化物标记的羊抗鼠IgG(北京中杉金桥生物技术有限公司);组织蛋白提取试剂盒(北京索莱宝)。主要仪器:光学显微镜(OLYMPUS,日本);低温高速离心机(Thermo,美国);PCR仪(ABI,美国);微量移液器、培养瓶、培养皿等。
1.2 BMSCs的分离培养[2]取体重为(90±10)g SD大鼠,分离其两侧的股骨,以使骨髓腔充分暴露,用DMEM培养基反复冲洗后,将骨髓悬液过滤并离心,弃掉上清,将重悬的细胞移至培养瓶中于细胞培养箱中进行培养。培养24 h后弃掉没有贴壁的细胞,更换新的培养液。在此之后每3天进行1次换液,等到细胞生长融合达到80%~90%时传代培养。取第4代的细胞用于本实验研究来进行移植。
1.3 MCAO模型的建立线栓法制作MCAO模型[3-4]。将大鼠按照1 mL/100 g腹腔注射4%的水合氯醛麻醉。大鼠固定后,在颈部正中切口,分离暴露出右侧颈总、颈内和颈外动脉,结扎颈外动脉远心端、颈总动脉近心端,夹闭颈内动脉,在颈外动脉近心端剪一“V”形切口,将线栓插入距离颈总动脉18 mm处时固定,缝合皮下组织,1个小时后拔线,缝合切口。大鼠即刻出现右侧Horner征即为模型成功。
1.4 MCAO瘫痪程度评分动物麻醉清醒后,参照Zea Longa方法[3],对神经功能缺损进行评分。1~3分者为纳入本实验研究对象,对于神经损伤太重(4分)或太轻(0分)的老鼠弃之不用。
1.5实验分组BMSCs移植组:模型制作成功24小时后,将第4代的BMSCs细胞3×106个混悬于0.6 mL磷酸盐缓冲液(PBS),通过股静脉匀速注入。MACO组,24小时后股静脉匀速注入等量PBS。假手术对照组,只切开颈部皮肤暴露动脉,不插线栓,24小时后股静脉匀速注入等量PBS。各组再按不同时间点随机分为3组,每组5只。BMSCs移植后4天、7天、14天取材。
1.6 MVD检测随机选择各组各时间点脑组织冰冻切片5张,按照免疫荧光染色法Ⅷ因子检测法,每单个内皮细胞或内皮簇为一个血管计数,每个标本取2~3张切片,荧光显微镜下对微血管进行计数。用均值来作为微血管密度。
1.7 Western blot检测VEGF165、Notch1蛋白表达
严格按照试剂盒说明书进行操作来提取各组大鼠脑组织中的总蛋白,并进行蛋白定量。分别制备浓缩胶与分离胶,加样后行蛋白电泳、电转移,5%脱脂奶粉封闭后,加入相应一抗兔抗大鼠VEGF抗体、小鼠抗大鼠Notch1抗体(稀释倍数为1∶1 000),4 ℃孵育过夜、洗膜后加入二抗(稀释倍数为1∶2 000)37 ℃孵育2 h,清洗后于暗室中滴加化学发光液显影,于凝胶成像系统采集图像。以β-actin蛋白作为内参,各组目的条带灰度值与内参进行比值为蛋白的表达相对量。
1.8 RT-PCR检测VEGF165、Notch1 mRNA表达取大鼠脑组织提取总RNA,于PCR仪中行逆转录,按照预先设定荧光定量PCR反应程序进行扩增,行琼脂凝胶电泳,用凝胶成像分析系统对电泳条带的吸光度(OD值)半定量分析。结果以目的基因的OD值比上β-actin的OD值来表示。
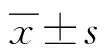
2 结果
2.1 BMSCs形态学变化原代培养的细胞呈圆形,1天后即开始贴壁生长,3天后可见细胞呈成纤维样,5天时细胞生长增加,10天左右细胞生长达到80%~90%融合,细胞呈长梭形。传代后,细胞增殖速度加快,随着传代代数的增加,细胞形态多逐渐趋于一致较均一为长梭形,并呈漩涡或束状排列生长(图1)。
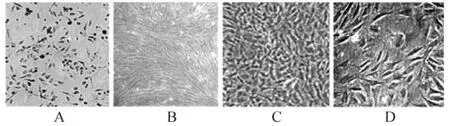
图1 骨髓间充质干细胞的形态学观察(200×)A:原代培养的细胞;B:呈成纤维样生长的贴壁干细胞; C:细胞生长达到80%~90%;D:第4代干细胞
2.2各个不同时间点大鼠脑组织MVD分析在假手术组微血管计数几乎很少,MCAO组、BMSCs组微血管数量显著高于假手术组(P<0.05),BMSCs移植后新生血管数量明显增多(P<0.05,表1)。

表1 大鼠脑组织不同时间微血管计数
与假手术对照组,aP<0.05;与MCAO组,bP<0.05
2.3 Wsternblot检测VEGF165、Notch1蛋白的表达MCAO组、BMSCs组在各个时间点VEGF165、Notch1蛋白表达均明显高于假手术对照组(P<0.05),BMSCs移植后,表达更高(P<0.05),在第14天各组蛋白表达开始下降(图2、表2)。
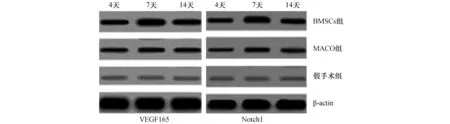
图2 各组大鼠不同时间点VEGF165、Notch1蛋白的表达
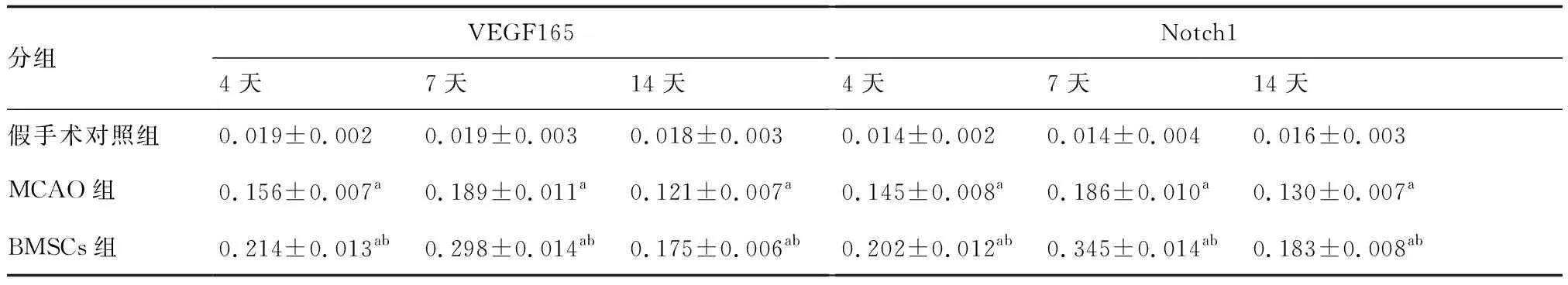
分组VEGF1654天7天14天Notch14天7天14天假手术对照组0.019±0.0020.019±0.0030.018±0.0030.014±0.0020.014±0.0040.016±0.003MCAO组0.156±0.007a0.189±0.011a0.121±0.007a0.145±0.008a0.186±0.010a0.130±0.007aBMSCs组0.214±0.013ab0.298±0.014ab0.175±0.006ab0.202±0.012ab0.345±0.014ab0.183±0.008ab
与假手术对照组,aP<0.05;与MCAO组,bP<0.05
2.4 RT-PCR检测VEGF165、Notch1 mRNA的表达
MCAO组、BMSCs组VEGF165、Notch1 mRNA表达均明显高于假手术对照组(P<0.05),BMSCs移植后表达更高(P<0.05,表3)。
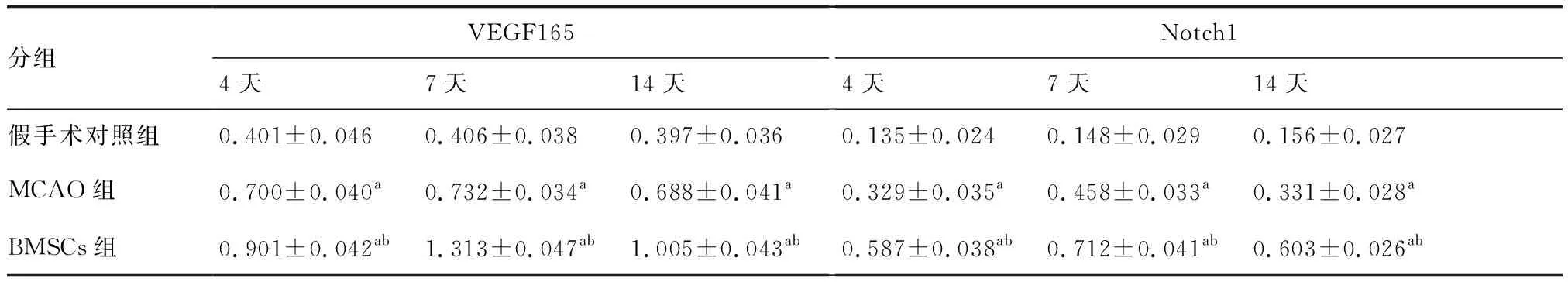
表3 各组大鼠不同时间点脑组织VEGF165、Notch1 mRNA的表达(n=5)
与假手术对照组比较,aP<0.05;与MCAO组比较,bP<0.05
3 讨论
脑栓塞有较高的发病率及致死率,会导致神经功能损害,随着对干细胞移植这一领域的研究越来越多,为治疗脑动脉栓塞提供了新的治疗手段。BMSCs来源充足,生物特性稳定,易于传代培养,可以分泌大量促血管生长因子[5]。BMSCs移植可以通过组织渗透、减少细胞凋亡、分泌细胞因子、减少炎症反应等许多途径而作用于神经系统,对受损组织发挥修复与保护的作用[6]。BMSCs具有多向分化的功能,有研究表明BMSCs移植可以迁移到病变部位,分化为神经细胞,改善脑梗死模型大鼠的神经功能[7]。BMSCs移植对脑缺血损伤具有恢复、保护作用,其作用机理可能是通过增加神经细胞数量与神经因子表达来实现[8]。
血管新生是指血管内皮细胞在血管生成因子的作用下形成新生血管,血管发生密度改变决定了脑梗死后神经元存活与否,同时也是干细胞移植成功与否的关键性因素[9]。本实验通过股静脉注射将BMSCs移植到MCAO大鼠模型体内,通过促进栓塞区血管新生降低神经功能的损失。本研究发现栓塞区脑组织血管新生明显多于对照组,BMSCs组有大量微血管生成,提示可能是VEGF表达上调,随着时间延长,数量增加,在第14天时数量开始下降,进一步Westernblot、PCR实验也证明了这一推论。
目前广大学者认为与血管新生密切有关的是VEGF和Notch信号通路。病理条件下,Notch信号通路与血管形成密切相关,而VEGF可以通过Notch信号通路发挥生理作用,促进血管生成[10-11]。VEGF是特异性促血管生成因子,对血管新生的起始具有关键性作用,其中VEGF165的作用最明显。MACO动物模型显示,MACO后24小时血管内皮细胞开始明显增生[12],在本实验中,BMSCs移植到脑栓塞大鼠体内后发现VEGF165蛋白、mRNA相较于假手术对照组明显升高,说明BMSCs移植能够通过增加VEGF165的表达从而促进血管新生。
研究发现,许多信号通路参与了血管新生的过程,其中Notch信号的调节作用尤为突出[13],另外,Notch信号激活可以促进BMSCs移植作用,使心肌梗死区BMSCs向内皮细胞分化,促进缺血心肌中毛细血管新生[14],此外还对一些组织的血管生成具有调控作用[15]。在本实验中,BMSCs移植到脑栓塞大鼠体内后发现Notch1蛋白、mRNA相较于假手术对照组明显升高,表明BMSCs移植后可能通过激活Notch信号通路而促进脑动脉栓塞组织中VEGF165的表达,从而促进形成新生的血管[2]。
组织器官缺血后VEGF和Notch信号通路均与血管新生有着密切关系。VEGF能刺激血管的新生,是血管生成的重要因素,VEGF表达增加激活Notch信号通路。本实验检测了脑栓塞组织区的VEGF165蛋白、mRNA与Notch1蛋白、mRNA,结果显示,MCAO组、BMSCs组VEGF165蛋白、mRNA与Notch1蛋白、mRNA表达较假手术对照组明显升高。表明Notch信号通路可以促进BMSCs分化,提示VEGF调控血管生成过程中,Notch信号通路也参与血管新生,起着重要调控作用。
综上所述,BMSCs移植可对脑动脉栓塞大鼠有很好的治疗效果,能够使BMSCs在栓塞区存活,加快促进血管新生,提高VEGF、Notch表达,激活VEGF/Notch通路,促进受损神经功能的恢复,在一定程度上保护了脑组织,为临床治疗脑栓塞提供了新的治疗方法。但VEGF/Notch通路在BMSCs移植促进脑微血管形成中的具体机制需要广大学者的进一步探索。
