18F-ML-10 PET/CT显像检测荷瘤兔细胞凋亡的初步研究
2018-12-03陈顺军宋乐乐李彦鹏王瑞华程兵
陈顺军,宋乐乐,李彦鹏,王瑞华,程兵*
1.河南科技大学第一附属医院超声科,河南洛阳 471003;2.河南科技大学第一附属医院影像科,河南洛阳 471003;3.郑州大学第一附属医院核医学科,河南省分子影像医学重点实验室,河南郑州 450052;
多项肿瘤细胞凋亡显像研究表明,化疗后肿瘤细胞凋亡程度明显增加;在一定时间内行凋亡检测,能够探测肿瘤细胞的凋亡情况,达到监测化疗疗效的目的[1-6]。Cohen等[7]合成一种新的小分子化合物5-氟代烷基-2-甲基-丙二酸(5-fluoropentyl-2- methyl-malonic acid,ML-10),能选择性地聚集于凋亡细胞,具有较好的临床应用前景[7-10]。国内关于18F-ML-10用于化疗后肿瘤细胞凋亡检测的报道较少。本研究利用紫杉醇诱导VX2肿瘤动物模型体内的肿瘤细胞发生凋亡。对细胞凋亡模型动物行18F-ML-10 PET/CT全身断层显像,测量肿瘤部位的最大标准化摄取值(maximum standardized uptake value,SUVmax)。对比相应的流式细胞仪定量检测细胞凋亡百分率,探讨18F-ML-10 PET/CT全身断层显像用于判断荷瘤兔体内细胞凋亡的可能性,为临床应用提供实验依据。
1 材料与方法
1.1 仪器与动物 PET/CT成像系统(Siemens Biography True Point64 52环),Syngo工作站(Siemens True D融合软件),放射性活度测量仪器(Capintec CRC-25R/W型放射性活度测量仪器),18F-ML-10放射性核素示踪剂(郑州大学第一附属医院核医学科PET中心提供),压力蒸汽灭菌锅(YXQ-SG46-280S,上海博讯公司)。药物:麻醉药物(戊巴比妥钠:Merck公司,德国)、紫杉醇注射液(深圳万乐药业有限公司,规格:10 ml/60 mg,批号:H20056878)、生理盐水、碘伏。一次性使用留置针(24G AD医疗集团公司),无菌注射器,输液器,棉签,弯盘。流式细胞仪(Becton Dickinson公司),Annexin V FITC凋亡试剂盒(Invitrogen公司)。VX2荷瘤兔模型12只,雄性,体重2.0~3.0 kg,购自河南省实验动物中心[动物合格证号:SCXK(豫)2015-0004]。
1.2 实验方法 VX2细胞荷瘤兔12只,按完全随机化法分为化疗组和对照组,每组6只,化疗组经耳缘静脉输注紫杉醇注射液(按兔子体表面积175 mg/m2计算)诱导肿瘤细胞凋亡[11],对照组静脉滴注等量生理盐水。2 d后,将12只兔逐个麻醉后,按兔体重计算 4.44×106Bq/kg(120 μCi/kg,0.2 ml)经耳缘静脉注射18F-ML-10,60 min后分别进行PET/CT显像。CT参数:常规全身扫描,80 kV,自动毫安;PET参数:1.5 min/床位,采集3个床位,扫描的图像采用迭代重建法重建,分别得到横断面、矢状面和冠状面CT、PET、PET/CT断层融合图像。应用ROI技术勾画瘤体,测定肿瘤组织的SUVmax。显像结束后,立即处死 VX2细胞模型动物,取出肿瘤组织,分为两部分,一部分用于流式细胞仪检测 VX2细胞凋亡情况,另一部分用作苏木精-伊红染色(hematoxylineosin staining,HE)观察。
1.3 统计学方法 采用SPSS 21.0软件,用Mann-Whitney检验比较化疗组与对照组的差异;采用Spearman秩相关分析化疗组瘤体组织SUVmax与肿瘤细胞凋亡百分率之间的相关性,P<0.05表示差异有统计学意义。
2 结果
2.1 两组VX2兔肿瘤模型SUVmax与细胞凋亡百分率比较 注射核素显像剂 60 min后行18F-ML-10 PET/CT全身断层显像,化疗组瘤体部位的SUVmax为 1.65±0.33,对照组瘤体部位SUVmax为 0.59±0.17,差异有统计学意义(P=0.004)。利用 Annexin VFITC/PI定量法检测VX2细胞凋亡情况,化疗组细胞凋亡百分率为(26.22±5.41)%,对照组为(4.55±2.23)%,差异有统计学意义(P=0.004)。
2.2 化疗组瘤体组织 SUVmax与肿瘤细胞凋亡百分率的相关性 化疗组瘤体组织SUVmax与肿瘤细胞凋亡百分率呈正相关(rs=0.943,P=0.005)。18F-ML-10 PET/CT全身断层显像显示:化疗组瘤体部位摄取18F-ML-10较明显,表现为放射性分布稍浓聚区(图1A);对照组瘤体部位摄取18F-ML-10不明显(图1B)。
2.3 流式细胞仪检测VX2细胞凋亡情况 化疗组细胞凋亡百分率较多;对照组细胞凋亡百分比非常少(图2)。化疗组HE染色病理切片镜下见较多的凋亡细胞呈片状分布,对照组HE染色病理切片镜下所见以正常VX2细胞为主(图3)。
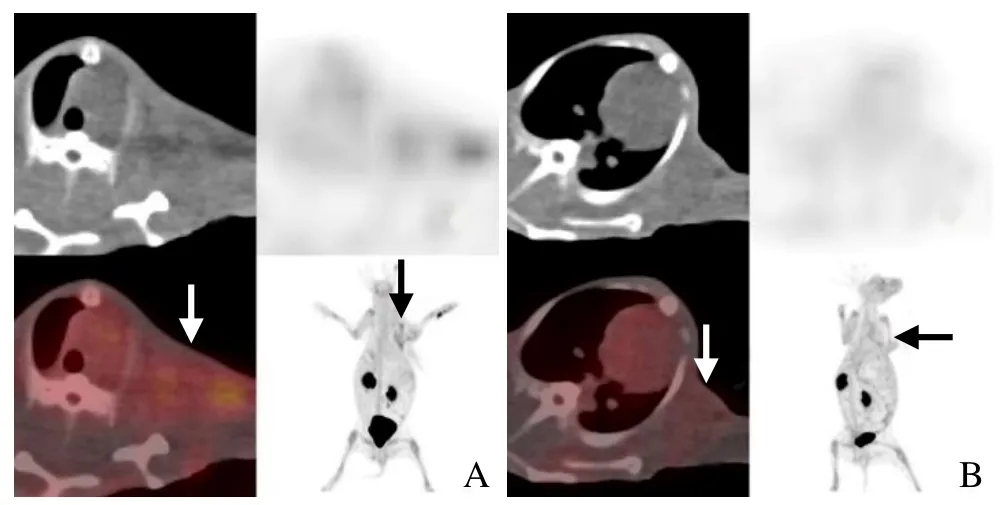
图1 VX2荷瘤兔动物模型18F-ML-10 PET/CT全身断层融合显像。A. VX2荷瘤兔紫杉醇化疗后,18F-ML-10 PET/CT全身断层融合显像,MIP图显示兔左侧腋窝水平放射性分布略浓聚,CT显示为左侧腋窝皮下肿瘤部位,PET/CT融合图像显示瘤体部位可见放射性分布略浓聚,SUVmax为1.76(箭);B.对照组荷瘤兔18F-ML-10 PET/CT全身断层融合显像,CT显示肿瘤位于左侧腋窝皮下,MIP图、PET/CT融合图均显示肿瘤部位未见明显放射性分布浓聚,SUVmax为0.58(箭)
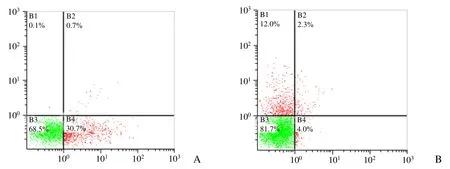
图2 流式细胞仪检测两组荷瘤兔VX2细胞凋亡百分率。A.经紫杉醇化疗后VX2细胞凋亡百分率:右上象限:Annexin V(+)/PI(+),晚期凋亡细胞(0.7%);右下象限:Annexin V(+)/PI(-),早期凋亡细胞(30.7%),细胞凋亡百分比较高;左下象限:Annexin V(-)/PI(-),正常细胞(68.5%)。B.对照组VX2细胞凋亡百分率:右上象限:Annexin V(+)/PI(+),晚期凋亡细胞(2.3%);右下象限:Annexin V(+)/PI(-),早期凋亡细胞(4.0%);细胞凋亡百分比较低,左下象限:Annexin V(-)/PI(-),正常细胞(81.7%)
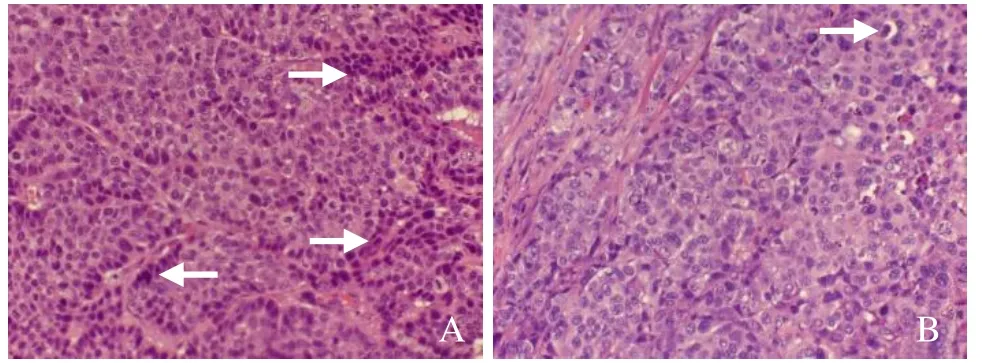
图3 荷瘤兔VX2肿瘤病理结果。紫杉醇化疗后VX2肿瘤病理切片显示较多的凋亡细胞呈片状及条状分布,细胞体积缩小,胞质浓缩、深染,细胞核浓缩(箭,A);对照组VX2肿瘤病理图片显示极少量的凋亡细胞,呈单个分布,细胞体积缩小,细胞核浓缩,深染,内可见凋亡小体(箭,HE,×200,B)
3 讨论
细胞凋亡在肿瘤的治疗过程中具有重要作用,并直接影响肿瘤患者的预后。分子影像为实体检测细胞凋亡提供了有效工具[12]。ML-10是一种用于细胞凋亡检测的新型化合物,其原理是:磷脂酰丝氨酸(Ps)是构成细胞膜的成分之一,细胞正常状态下依靠移位酶和翻转酶维持Ps位于细胞膜内侧,凋亡发生早期,这两种酶活性丧失,而另外一种爬行酶的激活使Ps由膜内侧移向外侧,并且暴露在细胞膜外侧,在细胞膜上,细胞膜的酸化使18F-ML-10酸化,酸化后的18FML-10结构发生改变,细胞膜上的爬行酶激活和细胞膜不可逆的去极化,促进已经酸化的18F-ML-10通过细胞膜疏水性的结构进入细胞内,酸化18F-ML-10与胞质内带负电荷的蛋白结合,促使更多的18F-ML-10进入细胞内,引起细胞内ph系统功能紊乱,当细胞内pH值降低到细胞质内蛋白质等电点以下,细胞发生脱水、皱缩等凋亡细胞所特有的改变,以上变化相互协同完成,导致18F-ML-10集聚在凋亡细胞内,这种特性仅发生在凋亡细胞[7-10]。本实验研究显示,化疗组肿瘤部位摄取18F-ML-10,呈放射性分布浓聚区域,而对照组肿瘤部位未见明显摄取18F-ML-10。化疗组与对照组 SUVmax比较,差异有统计学意义(P=0.004)。流式细胞仪检测结果证实化疗组肿瘤细胞凋亡百分比明显增加,差异有统计学意义(P=0.004)。化疗组细胞凋亡百分比与瘤体组织SUVmax呈正相关(rs=0.943),表明18F-ML-10 PET/CT显像可用于细胞凋亡评估。
既往已有研究将18F-ML-10用于人体肿瘤放疗后的疗效评估,Allen等[13]利用18F-ML-10评价全脑放疗对脑肿瘤患者的疗效,结果显示肿瘤体积的变化和18F-ML-10在肿瘤部位浓聚的变化有良好的相关性。张晓军等[14]对6例脑转移瘤患者放疗后行18F-ML-10显像结果显示,其可用于颅脑转移瘤患者放疗后的凋亡评价。上述研究是关于颅脑肿瘤经放疗后,肿瘤组织的18F-ML-10摄取量与细胞凋亡具有一定的相关性。肿瘤组织经化疗后,利用18F-ML-10 PET/CT显像评价肿瘤细胞凋亡程度及疗效判定的相关研究较少,本实验是对其的一种尝试。实验样本量较少,而且研究对象非人体,因此还需进一步深入研究。随着研究的不断深入,18F-ML-10 PET/CT显像应用于评价肿瘤细胞凋亡将发挥更加重要的作用。
