参芎化瘀胶囊通过MAPK/ERK对脑缺血/再灌注大鼠的神经保护作用研究*
2018-11-30杨徐一许仁军杨黎萍
杨徐一 许仁军 杨黎萍 戴 杰
[1.浙江省台州恩泽医疗中心(集团)路桥医院,浙江 台州 318050;2.浙江省台州市路桥广兴大药房,浙江 台州 318050]
脑卒中是严重威胁中国居民身体健康和生命安全的重大疾病之一,其中约70%脑卒中患者为脑缺血/再灌注(I/R)损伤,死亡率约为10%,致残率高达50%以上[1]。参芎化瘀胶囊是由石菖蒲、川芎、人参、地鳖虫、乳香、五味子、郁金等组成的中药复合方剂,具有化瘀通络等功效,可有效保护缺血/再灌注大鼠神经元,改善大鼠认知功能[2],但其具体作用机制尚不十分清楚。研究发现细胞凋亡是脑I/R损伤引起神经细胞死亡的重要原因[3]。 丝裂原活化蛋白激酶(MAPK)/细胞外调节蛋白激酶(ERK)通路通过调节转录因子的活性,参与调控细胞增殖、细胞分化、细胞凋亡等多种生物学过程,MAPK/ERK信号通路异常激活可诱导细胞凋亡[4]。因此,本文通过研究参芎化瘀胶囊对脑I/R模型大鼠脑组织MAPK/ERK通路的调节作用,旨在探究其保护脑I/R损伤的作用机制。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠160只,SPF级,体质量(200±10)g,购自上海市医学实验动物中心,许可证号:SCXK-(沪)20116-0001,批号:1140070009179。本研究涉及所有实验均通过本院动物实验伦理委员会批准。
1.2 试剂与仪器 参芎化瘀胶囊 (由河北联合大学附属医院药剂科提供,冀药制Z20051586);尼莫地平片(批号:Z15027),购自拜耳医药公司;ERK/MAPK激活剂 12-O-tetradecanoyl phorbol-13-acetate(TPA,货号:N2060),购自美国APExBIO公司;4%多聚甲醛、DMSO、戊巴比妥钠、TTC染料、HE染色试剂盒,购自上海生工生物技术公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒,购自碧云天公司;兔抗MEK1/2多克隆抗体(货号:ab131517)、兔抗 p-MEK1/2多克隆抗体(货号:ab194754)、兔抗ERK1/2多克隆抗体(货号:ab196883)、兔抗 p-ERK1/2多克隆抗体(货号:ab201015);兔抗 Bcl-2 单克隆抗体(货号:ab32124)、兔抗Bax单克隆抗体(货号:ab32503)、兔抗Caspase3单克隆抗体(货号:ab13847),兔抗GAPDH单克隆抗体(货号:ab181602),羊抗兔 IgG 抗体(货号:ab205718),均购自美国Abcam公司。大鼠电动立体定向注射仪(型号:ALC-H),购自上海奥尔科特生物科技有限公司;荧光显微镜(型号:BX43),购自美国Olympus公司;石蜡烤片机 (型号:HI1220)、切片机 (型号:RM2235),购自德国Leica公司;蛋白电泳仪(型号:PowerPac 基础)、半干转膜仪(型号:1703940),购自美国Bio-Rad公司;Tanon发光成像系统 (型号:5500),购自上海天能公司。
1.3 模型制备 术前给予大鼠2.5%戊巴比妥钠40 mg/kg腹腔注射麻醉。按照改进大脑中动脉线栓法(MACO)构建脑缺血/再灌注(I/R)模型大鼠[5]:将大鼠仰卧固定于手术台,常规消毒。沿大鼠颈部正中偏左处切开皮肤,暴露出颈三角位置,采用钝性分离法迅速分离出左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)。利用血管夹在远心端结扎ECA及其分支,在近心端夹闭CCA和ICA。利用眼科剪在ECA距CCA分叉处约3~5 mm处作一斜向切口,轻轻推入特定脑栓尼龙线(直径0.26 mm),至距CCA分叉处约19 mm处感觉有阻力时停止,将栓线在颈外动脉处扎紧。缝合手术切口并消毒。维持大脑缺血状态2 h后,拉出栓线实现血液再灌注。术中、术后维持大鼠体温均在(37±0.5)℃。假手术组,不植入脑栓尼龙线,其余步骤同模型组。造模成功标准:大鼠清醒后2 h,按照Longa EZ评分标准进行评分[6]。0分:神经功能无任何损伤症状;1分:右前爪不能完全伸直;2分:行走时向右侧不自主倾斜或向右侧转圈;3分:行走时向右侧跌倒或向右侧瘫痪;4分:出现昏迷,不能自主行走;5分,大鼠死亡。将1~3分大鼠纳入本次研究,0、4、5分大鼠排除。另于手术造模后第5日,再次进行神经功能评分。若实验组大鼠数量不足预定数量,则通过随机原则取备用大鼠补足。
1.4 分组与给药 建模成功后,随机分为模型组(含0.05%DMSO的0.9%氯化钠注射液)、SHC组(参芎化瘀胶囊)、尼莫地平组(尼莫地平)和TPA组(参芎化瘀胶囊+TPA),每组30只,另设假手术组(含0.05%DMSO的0.9%氯化钠注射液)30只。参芎化瘀胶囊、尼莫地平片溶于0.9%氯化钠注射液中使用,给药剂量参考动物体表面积剂量换算法[7],按成人70 kg给药剂量换算:参芎化瘀胶囊48 mg/kg,尼莫地平片15 mg/kg。造模成功后2 h,给予各组大鼠灌胃给药1次,随后每天同一时间按大鼠体质量灌胃相应药物1次,连续5 d。模型组及假手术组同一时间给予等体积含0.05%DMSO的0.9%氯化钠注射液灌胃处理。TPA溶于DMSO,0.9% 氯 化 钠 溶 液 稀 释 至 50 μmol/L(0.05%DMSO)使用,造模成功后2 h,采用立体定向注射仪于大鼠中线外侧1.5 mm、前囟前0.8 mm处进行穿刺,深度3.5 mm,将10 μL TPA轻轻注入脑室内,每天1次,连续5 d。
1.5 标本采集与检测 1)TTC染色法检测大鼠脑组织梗死体积:最后1次给药24 h后,颈部脱臼处死,取缺血脑组织,-20℃,25 min;切为6片,置于 1%TTC溶液中,37℃孵育15 min;移至10%甲醛溶液(pH7.4)中固定。红色部分为无梗死组织,白色部分为发生梗死组织。ImageProPlus软件测量各切片梗死面积,计算脑梗死体积。每组随机取10只大鼠检测。2)HE染色法观察脑组织形态:最后1次给药24 h后,给予各组大鼠2.5%戊巴比妥钠40 mg/kg腹腔注射麻醉,经CCA灌注4%多聚甲醛初步固定后,取缺血侧海马组织,置于4%多聚甲醛溶液中固定24 h,常规石蜡包埋,连续切片(4 μm/片),进行脱蜡、水化处理。严格按照 HE 法染色流程对脑组织切片进行染色,中性胶封片,置于光学显微镜下,观察大鼠脑组织形态并拍照。每组随机取10只大鼠制备石蜡切片。3)AnnexinV-FITC/PI法检测神经细胞凋亡情况:最后1次给药24 h后,颈部脱臼处死各组大鼠,取缺血侧海马组织,剪为1 mm3小块,加入胰蛋白酶消化,制备单细胞悬液,计数,取6~10万个细胞,严格按照AnnexinV-FITC/PI细胞凋亡双染试剂盒说明书逐步进行染色,流式细胞仪检测细胞凋亡率并分析。每组随机取10只大鼠进行检测。4)Western blotting 法检测 Bcl-2、Bax、Caspase3、MEK1/2、p-MEK1/2、ERK1/2和p-ERK1/2蛋白表达:研磨粉碎各组大鼠海马组织样品,加入蛋白裂解缓冲液(含protease inhibitor Cocktail),提取脑组织总蛋白,BCA试剂盒测定蛋白总量,以GAPDH作为内参,检测脑组织Bcl-2、Bax、Caspase3、MEK1/2、p-MEK1/2、ERK1/2 和 p-ERK1/2蛋白相对表达情况,Tanon软件采集图像并进行灰度分析。
1.6 统计学处理 应用SPSS 22.0统计软件。计量资料以(±s)表示,采用单因素方差分析,两两比较行LSD检验。P<0.05为差异有统计学意义。
表1 各组大鼠MACO术后神经功能损伤得分比较(分,±s)
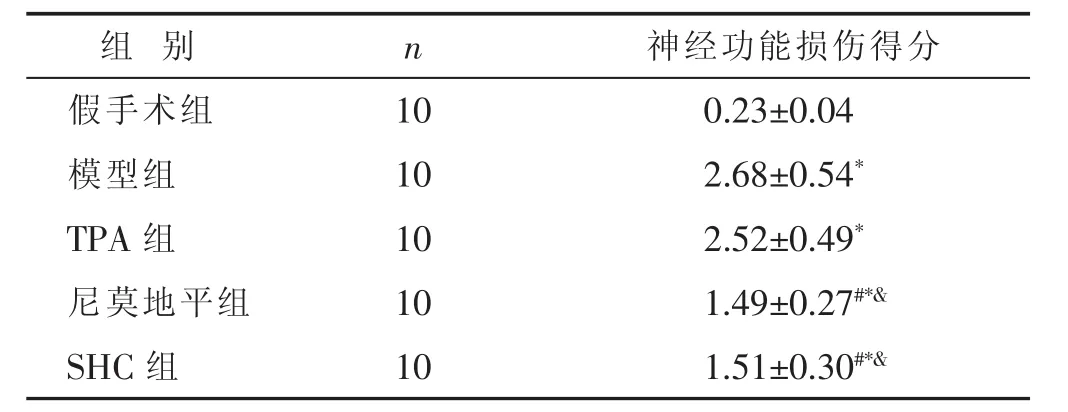
表1 各组大鼠MACO术后神经功能损伤得分比较(分,±s)
与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与 TPA组比较,&P<0.05;与尼莫地平组比较,◇P<0.05。 下同
组 别 n假手术组 1 0模型组 1 0 T P A组 1 0神经功能损伤得分0.2 3±0.0 4 2.6 8±0.5 4*2.5 2±0.4 9*尼莫地平组 1 0 1.4 9±0.2 7#*&S H C 组 1 0 1.5 1±0.3 0#*&
2 结 果
2.1 各组大鼠神经功能损伤得分[6]比较 见表1。与假手术组比较,模型组、TPA组、尼莫地平组、SHC组大鼠神经功能损伤得分显著增加(P<0.05);与模型组比较,SHC组、尼莫地平组大鼠神经功能损伤得分明显降低(P<0.05),TPA组大鼠神经功能损伤得分无明显变化(P>0.05);与TPA组比较,尼莫地平组、SHC组大鼠神经功能损伤得分均明显降低(P<0.05);尼莫地平组和SHC组比较差异无统计学意义(P>0.05)。
2.2 各组大鼠脑组织梗死体积的比较 见图1、表2。与假手术组比较,模型组、TPA组、尼莫地平组、SHC组大鼠脑梗死体积显著增加 (P<0.05);与模型组比较,SHC组、尼莫地平组大鼠脑梗死体积明显降低(P<0.05),TPA组大鼠脑梗死体积无明显变化 (P>0.05);与TPA组比较,尼莫地平组、SHC组大鼠脑梗死体积均明显降低(P<0.05);尼莫地平组和SHC组比较差异无统计学意义(P>0.05)。
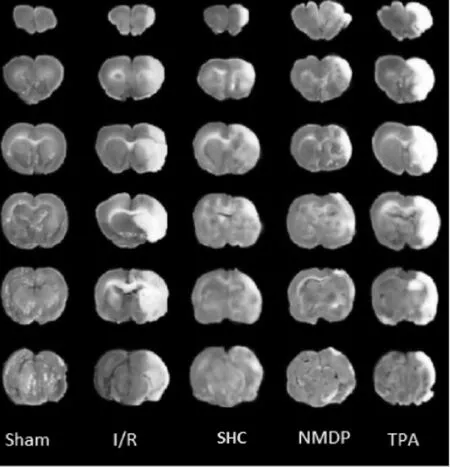
图1 各组大鼠脑组织TTC染色结果
表2 各组大鼠MACO术后脑梗死体积结果比较(±s)

表2 各组大鼠MACO术后脑梗死体积结果比较(±s)
组 别 n假手术组 1 0模型组 1 0 T P A组 1 0脑梗死体积(%)1.0 4±0.0 5 5 2.6 8±9.3 4*4 9.7 8±9.3 1*尼莫地平组 1 0 1 8.2 7±3.2 6#*&S H C 组 1 0 1 9.0 3±3.6 8#*&
2.3 各组大鼠海马组织病理变化比较 见图2。与假手术组比较,模型组大鼠海马组织细胞排列紊乱,神经元细胞萎缩,胞间缝隙增大,出现空泡。与模型组比较,SHC组、尼莫地平组能有效减轻海马组织病理变化。与SHC组比较,TPA组大鼠病理变化相对明显。
2.4 各组大鼠神经细胞凋亡情况的比较 见图3、表3。与假手术组比较,模型组、TPA组、尼莫地平组、SHC组神经细胞凋亡率显著增加(P<0.05);与模型组比较,SHC组、尼莫地平组大鼠神经细胞凋亡率明显降低(P<0.05),TPA组大鼠神经细胞凋亡率无明显变化(P>0.05);与TPA组比较,尼莫地平组、SHC组大鼠神经细胞凋亡率均明显降低(P<0.05);尼莫地平组和SHC组比较差异无统计学意义(P>0.05)。

图2 各组大鼠海马组织病理变化(HE染色,200倍)

图3 各组大鼠神经细胞凋亡的影响
表3 各组大鼠MACO术后神经细胞凋亡结果比较(%,±s)
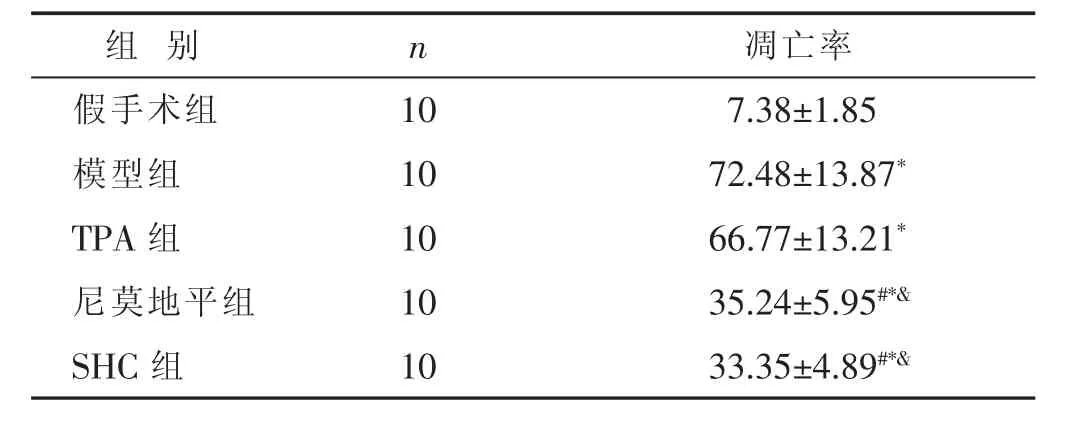
表3 各组大鼠MACO术后神经细胞凋亡结果比较(%,±s)
组 别 n假手术组 1 0模型组 1 0 T P A组 1 0凋亡率7.3 8±1.8 5 7 2.4 8±1 3.8 7*6 6.7 7±1 3.2 1*尼莫地平组 1 0 3 5.2 4±5.9 5#*&S H C 组 1 0 3 3.3 5±4.8 9#*&
2.5 各组大鼠Caspase3凋亡通路蛋白表达的比较见图4、表4。与假手术组比较,模型组、TPA组、尼莫地平组、SHC组Bax、Caspase3蛋白表达明显上调 (P<0.05),尼莫地平组、SHC组Bcl-2蛋白表达明显上调(P<0.05);与模型组比较,TPA 组、SHC 组、尼莫地平组大鼠Caspase3蛋白表达显著下调 (P<0.05),SHC组、尼莫地平组大鼠Bax蛋白表达显著下调(P<0.05),SHC组、尼莫地平组、TPA组Bcl-2显著上调(P<0.05);与TPA组比较,尼莫地平组、SHC组Bax、Caspase3蛋白表达明显下调(P<0.05),Bcl-2 显著上调(P<0.05),尼莫地平组和SHC组Caspase3蛋白表达比较差异有统计学意义(P<0.05),其余均无统计学意义(P>0.05)。
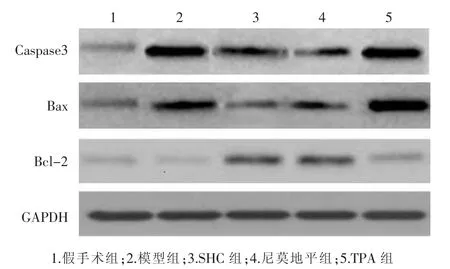
图4 各组大鼠Bax、Caspase3、Bcl-2蛋白的表达
表4 各组大鼠脑组织Bax、Caspase3、Bcl-2蛋白表达的比较(±s)

表4 各组大鼠脑组织Bax、Caspase3、Bcl-2蛋白表达的比较(±s)
组别 n假手术组 1 0模型组 1 0 T P A组 1 0尼莫地平组 1 0 S H C组 1 0 c a s p a s e 3/G A P D H B a x/G A P D H B c l-2/G A P D H 0.8 3±0.1 2 0.6 3±0.1 1 0.2 8±0.1 1 2.8 5±0.4 1* 2.1 7±0.2 6* 0.2 6±0.0 2 2.2 3±0.1 1*# 2.1 9±0.1 8* 0.3 5±0.0 6#1.1 7±0.1 5*#& 1.3 2±0.1 9*#& 0.6 9±0.1 3*#&1.6 3±0.0 5*#&◇ 1.1 5±0.1 2*#& 0.7 8±0.1 2*#&
2.6 各组大鼠MAPK/ERK信号通路蛋白表达比较见图5及表5。各组MEK1/2、ERK1/2蛋白的表达情况比较差异均无统计学意义 (P>0.05);与假手术组比较,模型组、TPA组、SHC组p-MEK1/2、p-ERK1/2蛋白表达明显上调(P<0.05),尼莫地平组p-ERK1/2蛋白表达明显上调 (P<0.05),p-ERK1/2蛋白表达差异无统计学意义(P>0.05);与模型组、TPA 组比较,SHC组、尼莫地平组p-MEK1/2、p-ERK1/2蛋白表达显著下调(P<0.05);尼莫地平组与SHC组大鼠p-MEK1/2、p-ERK1/2 蛋白表达无明显差异(P>0.05)。
3 讨 论
缺血/再灌注损伤指缺血一段时间恢复供血时,发生严重组织损伤及机能障碍,是某些疾病致死的重要原因[8],其中脑缺血/再灌注损伤是防治重点。近年来我国脑卒中虽致死率有所降低,但仍严重威胁我国居民生命健康[9]。参芎化瘀胶囊由石菖蒲、人参、川芎、地鳖虫、乳香、紫河车、没药、全蝎、龙血竭、五味子、郁金、桑椹子等组成,石菖蒲具有醒神健脑之功效,人参、紫河车可补气血,川芎、乳香、没药可活血行气,桑椹子可养血健脾,郁金、五味子可行气解郁、宁心安神,诸药合用可养血益气,化瘀通络。赵雅宁等发现,参芎化瘀胶囊能通过增加PI3-K/Akt信号活化保护小鼠脑缺血损伤[10]。本研究发现,参芎化瘀胶囊可明显减轻脑缺血/再灌注所致神经功能障碍,降低脑梗死体积,减轻脑组织病理损伤、降低神经细胞凋亡率,提示参芎化瘀胶囊对脑缺血/再灌注所致神经损伤具有保护作用。进一步研究发现,参芎化瘀胶囊对脑缺血/再灌注损伤的保护作用可被MAPK/ERK信号通路激活剂TPA特异性地逆转,提示参芎化瘀胶囊对脑缺血/再灌注损伤的保护作用与MAPK/ERK信号通路有关。
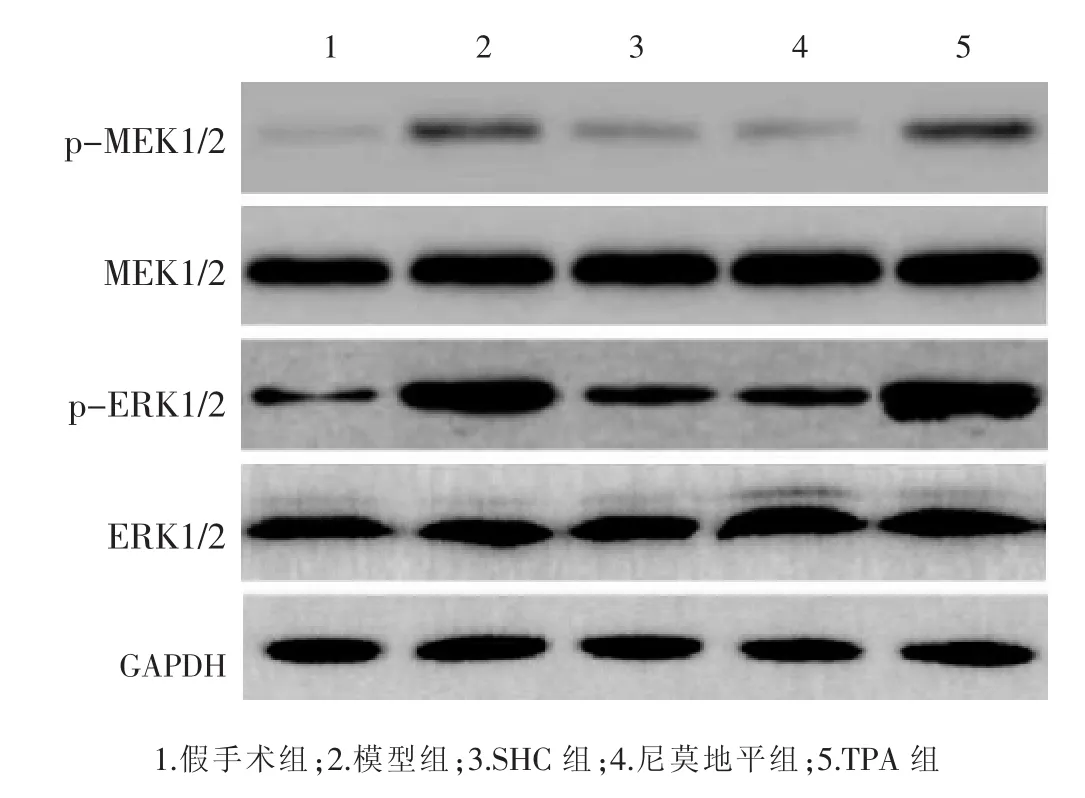
图5 各组大鼠 MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2蛋白的表达
表5 各组大鼠 MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2蛋白表达的比较(±s)
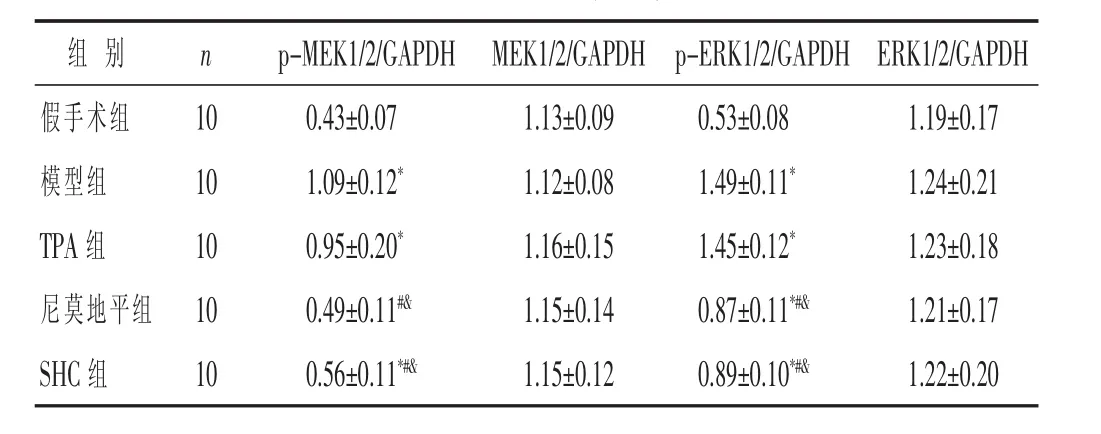
表5 各组大鼠 MEK1/2、p-MEK1/2、ERK1/2、p-ERK1/2蛋白表达的比较(±s)
组 别 n假手术组 1 0模型组 1 0 T P A组 1 0尼莫地平组 1 0 S H C组 1 0 p-M E K 1/2/G A P D H E R K 1/2/G A P D H 0.4 3±0.0 7 1.1 9±0.1 7 1.0 9±0.1 2* 1.2 4±0.2 1 0.9 5±0.2 0* 1.2 3±0.1 8 0.4 9±0.1 1#& 1.2 1±0.1 7 0.5 6±0.1 1*#& 1.2 2±0.2 0 M E K 1/2/G A P D H p-E R K 1/2/G A P D H 1.1 3±0.0 9 0.5 3±0.0 8 1.1 2±0.0 8 1.4 9±0.1 1*1.1 6±0.1 5 1.4 5±0.1 2*1.1 5±0.1 4 0.8 7±0.1 1*#&1.1 5±0.1 2 0.8 9±0.1 0*#&
细胞凋亡是缺血/再灌注损伤造成脑组织细胞死亡的主要原因,在脑I/R损伤过程中发挥着重要作用[11]。Bcl-2家族包括B淋巴细胞瘤-2蛋白(Bcl-2)等抑凋亡成员和Bcl-2相关X蛋白 (Bax)等促凋亡成员[12]。正常情况下,Bax与Bcl-2和Bcl-XL形成二聚体可阻止细胞凋亡发生;受到凋亡刺激时,Bax蛋白表达增加,促使Bax-Bax同二聚体在线粒体膜上形成,促使线粒体膜通透性增加,使得AIF、细胞色素C等凋亡因子进入细胞质中,激活Caspase级联反应而诱发细胞凋亡[13]。楼烨亮等发现,哈巴苷可通过抑制caspase依赖性凋亡通路抑制急性脑缺血所致小鼠海马神经细胞凋亡[14]。本研究发现,与模型组比较,SHC组神经细胞凋亡率明显降低。Western结果显示,模型组Bax、Caspase3蛋白表达明显上调,Bcl-2蛋白表达无明显变化;与模型组比较,SHC组Bax、Caspase3蛋白表达下调、Bcl-2蛋白表达上调。提示参芎化瘀胶囊能抑制Caspase3凋亡通路激活。进一步研究发现,参芎化瘀胶囊对脑缺血/再灌注所致神经细胞凋亡的保护作用可被TPA逆转,提示参芎化瘀胶囊对脑缺血/再灌注损伤所致细胞凋亡的保护作用与MAPK/ERK通路有关。
MAPK/ERK通路是由激酶级联反应介导的信号传导通路,通过一系列级联反应激活靶基因转录,参与细胞增殖、凋亡等生理病理过程[15]。研究表明,MAPK/ERK通路异常激活与心肌缺血再灌注损伤等疾病相关[16]。刘斌等发现,参芎化瘀胶囊可通过上调BDNF表达,促进血管性痴呆大鼠损伤神经元的修复[17]。本研究发现,脑缺血/再灌注损伤后,大鼠脑组织MEK1/2、ERK1/2蛋白总表达无明显变化,但p-MEK1/2、p-ERK1/2蛋白表达明显上调;参芎化瘀胶囊治疗后,p-MEK1/2、p-ERK1/2蛋白表达显著下调,对MEK1/2、ERK1/2蛋白总量没有影响,说明参芎化瘀胶囊具备激活MAPK/ERK信号通路的可能。进一步研究发现,参芎化瘀胶囊下调p-MEK1/2、p-ERK1/2表达的作用被TPA逆转,提示参芎化瘀胶囊可能通过抑制MAPK/ERK信号通路发挥神经保护作用。
综上所述,参芎化瘀胶囊可能通过抑制MAPK/ERK信号通路进而抑制Caspase3凋亡通路,发挥对脑缺血/再灌注所致神经损伤的保护作用。
