CTSD在阿尔茨海默病神经炎症反应中的作用机制研究
2018-11-29马琪林井初雅吕哲郑良城洪甘济方杰
马琪林 井初雅 吕哲 郑良城 洪甘济 方杰
组织蛋白酶D(cathepsin D, CTSD)基因, 位于11号染色体, 可编码形成功能蛋白 CTSD[1]。有文献报道, CTSD基因224 处 C~T [Ala~Val]多 态 与 阿 尔 茨 海 默 病 (alzheimer’s disease, AD)相关, 携带CTSD-T等位基因的个体比不携带T等位基因的个体患AD的几率增加了3.1倍[2], CTSD-C/T多态性会增加晚发型AD的患病风险[3]。在对于动脉粥样硬化的发病机制研究中有结果显示CTSD和NF-κB的表达有相关性[4], 提示CTSD可能会有抑炎作用, CTSD-T突变体可能与AD中的炎症反应相关。本研究检测了APP/PS1小鼠和野生型小鼠大脑内CTSD的表达情况, 并构建了Ctsd基因敲除小鼠, 检测其中各类促炎和抑炎因子的表达变化, 从而研究CTSD在AD免疫机制中发挥的作用。
1 材料与方法
1.1 材料 Ctsd基因敲除小鼠由广州赛业生物科技有限公司构建, APP/PS1小鼠和WT小鼠由厦门大学神经科学研究所提供, 在厦门大学实验动物中心进行饲养和繁殖, 饲养温度22~25℃, 空气湿度为50%, 12 h明暗交替。
1.2 方法
1.2.1 RT-PCR技术 剥离小鼠脑组织, Trizol法提取总RNA, 逆转录合成cDNA, 稀释引物浓度至10 μM的工作浓度 , 按照 2 ×SYBR Green Master 5 μl;Forward primer(10 μM)0.3 μl;Reverse primer (10 μM)0.3 μl;cDNA Template 10 ng ;Nuclease-free Water up to 10 μl进行混合。将反应板置于 Light Cycler 480荧光定量 PCR 仪中, 最后用2-△△CT方法进行数据分析。
1.2.2 Western blot技术 使用解剖器械取出小鼠脑组织,裂解、匀浆后制备样本。聚丙烯酰胺凝胶电泳进行分离, 将SDS-PAGE胶上的蛋白通过电转移到 PVDF膜上。电转过后的PVDF膜用TBS/T洗膜液清洗, 封闭2 h后加入一抗溶液,4℃包被过夜。洗涤后加入对应的辣根过氧化物酶标记的二抗溶液, 室温孵育1 h。再次洗涤后用新配制的增强型化学发光剂溶液浸润, 迅速于全自动化学发光仪曝光。
1.2.3 免疫组织化学 将小鼠麻醉灌注固定后取脑, 置于4% PFA中固定6 h, 然后蔗糖梯度脱水。OCT进行包埋后15 μm冰冻切片。60℃包埋烘片60 min, 1×PBS洗3次后室温下用预配好的封闭液封闭1 h, 在染色湿盒内4℃孵育一抗过夜。洗涤后避光孵育荧光二抗1 h。再次洗涤后加入DAPI使细胞核着色, 洗涤后封片在激光共聚焦荧光显微镜下观察并拍照。
1.3 统计学方法 采用GraphPad Prism5统计学软件进行统计分析。所有数据统计代表3次或者以上的平均值, 以均数±标准差( x-±s)表示, 采用t检验和方差分析。p<0.05表示差异具有统计学意义。
2 结果
2.1 APP/PS1小鼠脑内CTSD mRNA水平和蛋白水平明显下降 RT-PCR结果显示, APP/PS1小鼠大脑内CTSD mRNA表达水平较WT小鼠明显减少, 差异具有统计学意义(p<0.05)。见图1。Western blot显示, APP/PS1小鼠大脑内CTSD蛋白表达水平较WT小鼠明显减少, 差异具有统计学意义(p<0.05)。见图2。
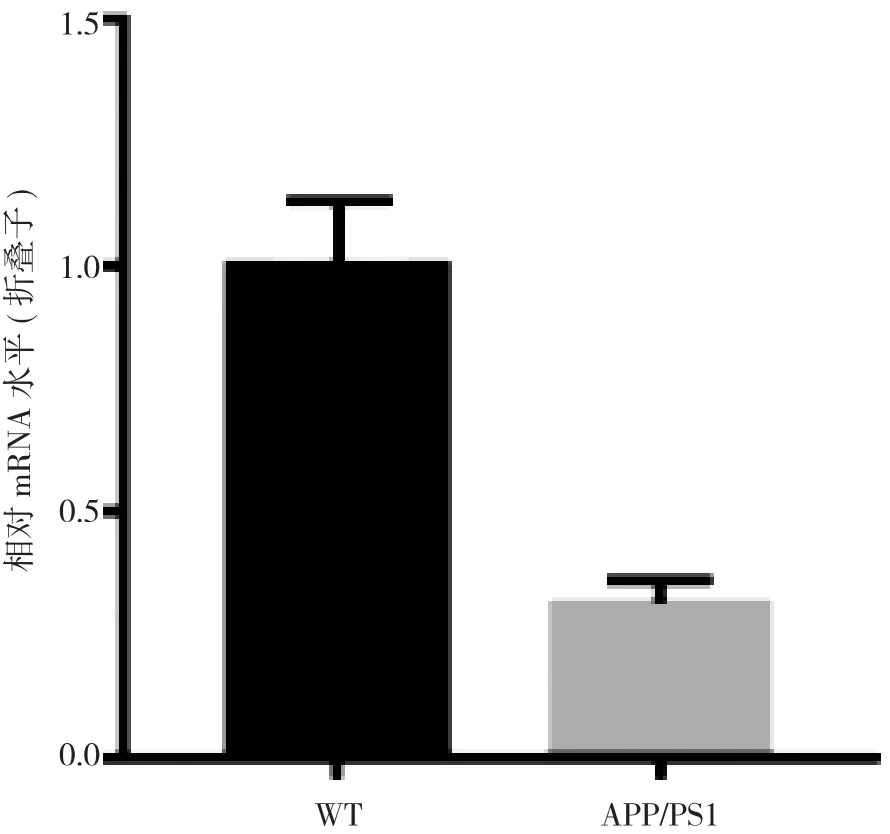
图1 WT小鼠和APP/PS1小鼠中CTSD mRNA的变化, ap<0.05
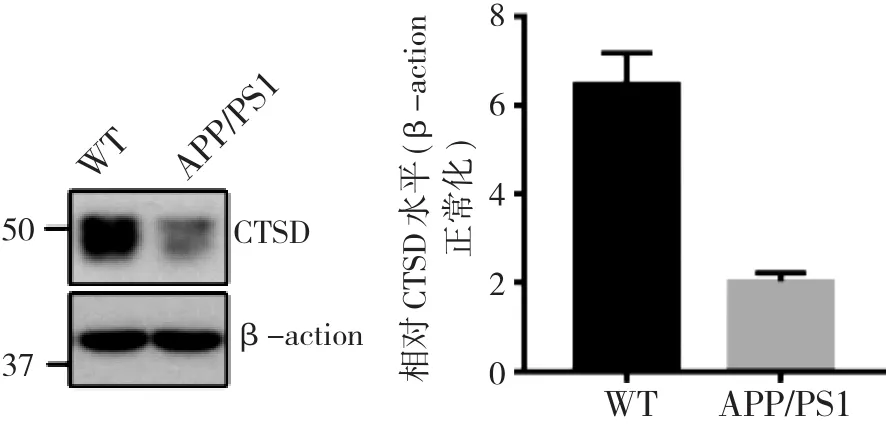
图2 WT小鼠和APP/PS1小鼠中CTSD蛋白表达水平的变化,ap<0.05
2.2 Ctsd敲除鼠中促炎因子表达上调、而抑炎因子表达下调 研究Ctsd敲除鼠中炎症因子的mRNA水平发现, 促炎因子肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、中性粒细胞巨噬细胞集落刺激因子(GM-CSF)的mRNA表达明显增加。见图3。而抑炎因子转化生长因子-β(TGF-β)、白介素-4(IL-4)和白介素-10(IL-10)的mRNA表达减少。见图4。2.3 Ctsd敲除鼠脑中NF-κB表达上调 研究Ctsd敲除鼠脑中核因子NF-κB表达的变化时发现, NF-κB在Ctsd-/-小鼠海马中的表达水平明显高于Ctsd+/+小鼠。见图5。
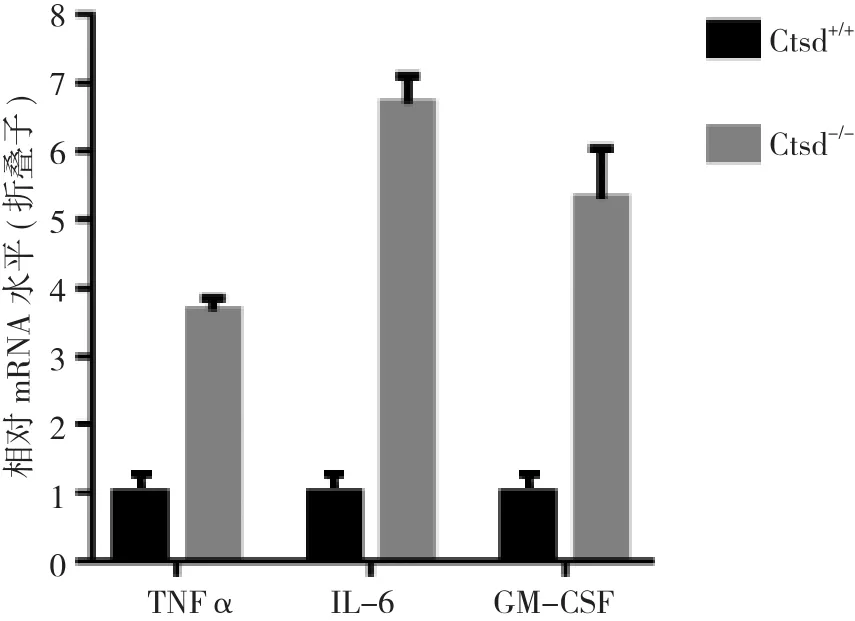
图3 Ctsd+/+小鼠和Ctsd-/-小鼠中促炎因子mRNA的变化, a p<0.05
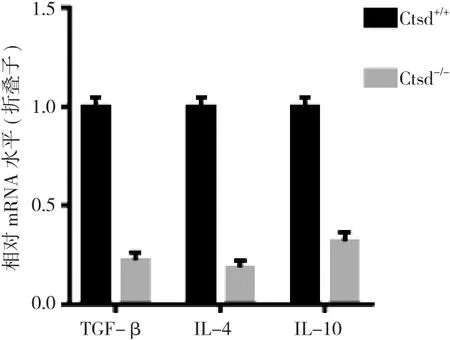
图4 Ctsd+/+小鼠和Ctsd-/-小鼠中抑炎因子mRNA的变化, ap<0.05

图5 Ctsd+/+小鼠和Ctsd-/-小鼠海马中NF-κB表达的变化, ap<0.05
3 讨论
既往研究发现CTSD能够通过剪切淀粉样前体蛋白参与清除Aβ、抑制其积聚纤维化和淀粉样沉积的生成, 最终抑制AD病情恶化[5]。体外实验表明其在酸性条件下具有类似β-和γ-分泌酶的水解活性, 能够水解载脂蛋白E, 从而减缓AD进展[6]。免疫炎症在AD中起着重要作用[7,8], CTSD基因突变可提高AD的患病风险, 另外CSTD冠心病模型中已被证实可以调控NF-κB信号通路而介导炎症反应。因此推测CSTD可能参与了AD病程中的神经炎症反应。
本实验首先验证了CTSD在AD模型小鼠大脑中表达水平的改变, 证实在APP/PS1小鼠脑内, CTSD mRNA水平和蛋白水平下降。接着, 作者构建了Ctsd敲除小鼠模型, 探究缺失CSTD小鼠与AD小鼠神经炎症反应的变化情况。实验首次发现, 在Ctsd敲除的老鼠中, 与神经炎症反应关系密切的促炎因子TNFα、IL-6和GM-CSF表达增加, 而抑炎因子TGF-β、IL-4和IL-10表达减少, 这与AD小鼠中炎症反应改变类似[9]。进一步我们通过免疫荧光实验证实Ctsd敲除的老鼠大脑中, NF-κB表达水平上调, 说明缺失Ctsd可激活NF-κB通路。
该结果证实了CTSD可影响与神经炎症反应相关的促炎因子和抑炎因子的表达, 并且可能是通过激活NF-κB通路介导。但CTSD在AD的病理生理过程是通过何种方式来发挥这种作用, 仍需进一步深入研究。
