脱氧核糖核酸酶抑制肺炎链球菌青霉素耐药基因转移的研究
2018-11-28谭艾娟吕世明
徐 核,谭艾娟,吕世明
(贵州大学:1.药学院微生物与生化药学系;2.生命科学学院;3动物科学学院,贵阳 550025)
细菌耐药已经成为严重的公共卫生危机,可能使人类重新面临感染性疾病的威胁。“遏制细菌耐药”已经成为医学界亟待解决的重大课题[1]。细菌产生耐药性的机制有很多,其中,耐药基因通过转化、接合和转导在不同细菌间形成水平转移最为重要[2]。因此,如果能抑制细菌的转化、转导和接合,即能抑制细菌耐药基因的转移,就可能抑制耐药菌或多重耐药菌的形成,为解决目前面临的严峻细菌耐药问题寻找到一种新的有效途径和方法[3]。为此本研究旨在以肺炎链球菌(streptococcus pneumonia,SP)标准菌株作为受体菌,以青霉素耐药SP(penecillin resistant SP,PRSP)的DNA作为外源性DNA,以脱氧核糖核酸酶(deoxyribonucleases,DNase)作为抑制剂[4],通过转化和抑制转化实验,探讨DNase在SP转化过程中抑制SP青霉素耐药基因转移的作用,以便为探究DNase抑制PRSP和其他相关耐药菌的形成提供前期研究,为开发阻断耐药基因水平传播的新型药物提供新思路。
1 材料与方法
1.1材料 (1)菌株来源:BNCC338425 SP标准菌株购于北纳创联生物技术有限公司。临床分离的PRSP最低抑菌浓度[(MIC)≥2 μg/mL],由重庆医科大学北碚附属医院惠赠。(2)主要仪器与试剂:微量移液器购自上海求精生化试剂仪器有限公司。超净工作台购自苏州安泰空气净化有限公司。SZ-9Z自动三重纯水蒸馏器购自上海亚荣生化仪器厂。LDZX-30FBS立式高压灭菌锅购自上海申安医疗器械厂。SH2-82A恒温振荡器(摇床)购自常州澳华仪器有限公司。高速台式离心机(TGL-161)购自上海安亭科学仪器厂。电热恒温水槽(DK-8D)购自上海一恒科技有限公司。NanoPhotometer超微量核酸测定仪购自德国的Implen公司。电热恒温箱购自上海贺德实验设备有限公司。FA2004电子天平购自上海精科天平厂。脑心浸液肉汤(BHI培养基)购自贵州鼎国生物技术有限公司。哥伦比亚血琼脂培养基购自重庆庞通医疗器械有限公司。苯唑西林药敏纸片购自贵阳宏硕生物科技有限公司。Optochin药敏纸片购自上海金穂生物科技有限公司。DNase Ⅰ购自北纳创联生物技术有限公司。
1.2方法
1.2.1提取PRSP的DNA并进行相关鉴定 用微量移液器将PRSP保种液200 μL分别加入含1 mL BHI培养基的离心管中,置于37 ℃摇床内振荡培养13 h(大约为SP生长曲线平台期的后期),然后将每管少量的细菌培养液在校正为0.5麦氏比浊度后涂于血平板上并在其内贴上Optochin和苯唑西林药敏纸片进行SP的培养、生化鉴定和青霉素药敏试验,同时将每管内的细菌培养液用煮沸法提取DNA以致每管获得大约70 μL的DNA提取液,并检测DNA溶液的浓度和纯度。将DNA提取液储存于-20 ℃冰箱内以备用于转化实验和DNase抑制实验。
1.2.2用外源性PRSP的DNA转化SP标准菌株并进行相关鉴定 将消毒处理后的SP标准菌株的冻干管移入超净工作台内,将0.3 mL无菌水注入冻干管中并吹打以便使冻干菌粉充分溶解成菌悬液,将菌悬液接种至血平板上,置于37 ℃及5%CO2的电热恒温箱内培养。待血平板上的菌悬液培养36 h并生长出典型成熟的SP菌落后,依次挑取SP标准菌株的单菌落分别放入含1 mL BHI培养基的20个离心管中,然后将这些离心管随机分成10个实验组和10个对照组并置于37 ℃摇床内振荡培养。当细菌进入感受态时才能易于捕获外源性DNA继而发生转化,而SP的感受态出现在对数生长期的后期,依据SP生长曲线在振荡培养6 h后才开始进入对数生长期后期,待振荡培养6 h适时地向实验组的每个离心管内加入浓度为(87.3±47.3)μg/μL PRSP的DNA提取液140 μL,同时向对照组的每个离心管内加入浓度为0.9%的盐水140 μL[5]。当细菌群体的生长繁殖处于对数期和稳定期交汇点时,液体培养基内的被转化和未被转化的活细菌数已达到顶峰并且细菌转化窗口已经关闭(SP感受态持续约40 min)[5],依据SP生长曲线这个交汇点大约为9 h,当振荡培养9 h实验组和对照组同时结束培养[6]。然后取实验组和对照组的每管少量细菌培养液在校正为0.5麦氏比浊度后涂于血平板上并在其内贴上Optochin和苯唑西林药敏纸片进行SP的培养、生化鉴定和青霉素药敏试验。
1.2.3DNase抑制PRSP的DNA转化SP标准菌株并进行相关鉴定 SP标准菌株的冻干菌粉复活培养与以上相关操作相同,实验组和对照组的培养容器、培养基、培养的最初菌落数、培养的随机分组及其他培养条件亦与以上相关内容相同。当实验组和对照组在摇床内培养6 h时,向实验组的每个培养管中加入PRSP的DNA溶液140 μL和浓度为18.75 U/μL的DNase溶液100 μL〈溶剂为生理盐水〉,以及分别向对照组的每个培养管中加入PRSP的DNA溶液140 μL。当振荡培养9 h时实验组和对照组结束培养。然后取实验组和对照组的每管少量细菌培养液在校正为0.5麦氏比浊度后涂于血平板上并在其内贴上Optochin和苯唑西林药敏纸片进行SP的培养、生化鉴定和青霉素药敏试验。

2 结 果
2.1提取PRSP的DNA及相关鉴定结果 在PRSP保种液活化培养后,各培养管细菌的Optochin试验均显示阳性,即Optochin纸片的抑菌环直径均大于14 mm;苯唑西林药敏试验显示各培养管细菌对青霉素不敏感,即苯唑西林药敏纸片的抑菌环直径均小于或等于19 mm;从各培养管的细菌悬液中均提取到DNA,即每管DNA提取液的体积约70 μL并且浓度为(87.3±47.3)μg/μL。
2.2PRSP的DNA转化SP标准菌株及相关鉴定结果 在转化实验后,实验组和对照组细菌的Optochin纸片抑菌环直径均大于14 mm,Optochin试验均显示阳性;在实验组的苯唑西林药敏试验中在每个抑菌圈外均有一个明显的由低到高直至正常菌落密度的铜钱状的抑菌环带,而在对照组的苯唑西林药敏试验中在每个抑菌圈外无此特征性的抑菌环带;实验组苯唑西林药敏纸片的抑菌环直径为(23.3±2.2)mm,对照组苯唑西林药敏纸片的抑菌环直径为(33.5±3.0)mm,两组比较差异有统计学意义(t=-8.74,P<0.01)。原始结果见图1。
2.3DNase抑制PRSP的DNA转化SP标准菌株及相关鉴定结果 在抑制转化实验后,实验组和对照组细菌的Optochin纸片抑菌环直径均大于14 mm,Optochin试验均显示阳性;在对照组的苯唑西林药敏试验中在每个抑菌圈外均有一个明显的由低到高直至正常菌落密度的铜钱状的抑菌环带,而在实验组的苯唑西林药敏试验中抑菌圈外的抑菌环带与对照组相比减弱;实验组、对照组苯唑西林药敏纸片的抑菌环直径分别为(29.6±4.7)、(17.6±9.4)mm,两组比较差异有统计学意义(t=3.60,P<0.05)。原始结果见图2。
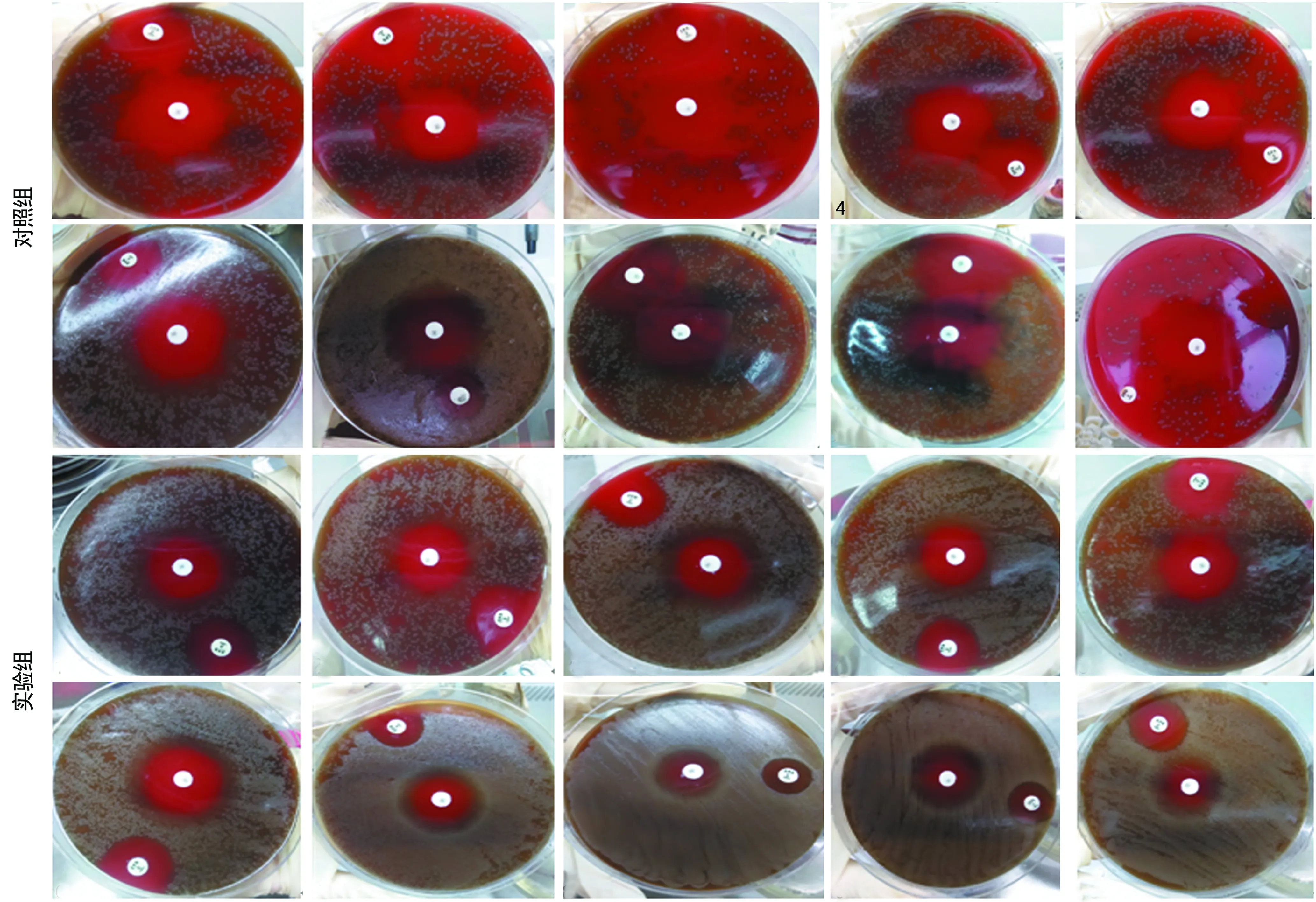
图1 转化实验后对照组和实验组的Optochin试验和青霉素药敏试验图片

图2 抑制转化实验后对照组和实验组的Optochin试验和青霉素药敏试验图片
3 讨 论
由于广谱抗菌药的滥用及细菌间耐药基因的转移,细菌对常用抗菌药物耐药的发展已成为人类健康事业面临的严重问题之一[7]。因此,合理应用抗菌药物是其主要的应对措施,而开发的新型抗菌药物不能随时满足临床耐药菌感染治疗的需求[1],阻断细菌间耐药基因转移的技术和药物也很匮乏,以致使细菌耐药危机日趋严峻[8]。鉴于细菌间耐药基因的水平传播是当今细菌产生耐药性的重要原因,探寻切断细菌间耐药基因水平传播的新技术和新药物将是破解细菌耐药危机的重要途径之一。为此,本研究以SP标准菌株作为受体菌,以PRSP的DNA作为外源性DNA,以DNase作为抑制剂,通过转化和抑制转化实验,探讨DNase在SP转化过程中抑制SP青霉素耐药基因转移的作用,为开发阻断耐药基因水平传播的新型药物提供新思路。
本研究在提取DNA实验阶段,获取了含SP青霉素耐药基因的外源性DNA提取液。在对PRSP菌株(MIC≥2 μg/mL)培养后,培养后的细菌Optochin试验显示阳性和青霉素药敏试验显示不敏感,说明PRSP菌株在培养过程中未被杂菌污染,培养后的细菌仍然是PRSP。用煮沸法从培养后的细菌悬液提取DNA后,DNA提取液的检测结果显示从各培养管的细菌悬液中均提取到DNA,表明每管均提取了PRSP的DNA。而据文献报道,SP临床菌株对β-内酰胺类抗生素耐药性与pbp2b、pbp2x和pbp1a基因突变密切相关[9],其中pbp2x基因突变可介导pbp2b、pbp1a等其他pbps基因突变,pbp2b基因突变导致低水平青霉素耐药,pbp2b和pbp1a基因突变导致高水平青霉素耐药[10]。结合以上研究,表明本研究从PRSP中提取的DNA应该含有pbp2b、pbp2x和pbp1a突变基因,符合本研究转化需要的含SP青霉素耐药基因的外源性DNA。
本研究在转化实验阶段,用含SP青霉素耐药基因的外源性DNA提取液,使SP标准菌株转化为青霉素低敏感的菌株。依据转化实验后的Optochin试验阳性结果,可判断在转化实验过程中实验组和对照组的SP均未受到杂菌污染;基于转化实验后的苯唑西林药敏试验结果:实验组抑菌环直径小于对照组(P<0.01),可判断实验组的细菌获得了青霉素低敏感的性状;根据对照组的对等、同步和专设的作用[11-12],判定实验组细菌获得的青霉素低敏感的性状不是由非处理因素引起,而是由含SP青霉素耐药基因的外源性DNA引起[5];根据文献[12]报道可知,实验组细菌获得的青霉素低敏感的性状是SP标准菌株摄入了SP青霉素耐药基因并成功地重组和表达的结果。实验组的特征性抑菌环带也间接地支持上述分子机制,因为只有不同的SP标准菌在转化实验过程中摄入不同种类的青霉素耐药基因并成功地重组和表达,使SP标准菌株转化为多种青霉素低敏感菌株,才能在抑菌圈外出现铜钱状的抑菌环带。
本研究在抑制转化实验阶段,用DNase抑制了SP标准菌株转化为青霉素低敏感菌株,显示DNase具有抑制SP青霉素耐药基因转移的作用。基于抑制转化实验后的Optochin试验阳性结果,可推断在抑制转化实验过程中实验组和对照组的SP均未受到杂菌污染。依据抑制转化实验后的苯唑西林药敏试验结果:实验组抑菌环直径大于对照组(P<0.05),可推断DNase抑制了SP标准菌株转化为青霉素低敏感菌株。根据实验组的抑菌环带与对照组相比减弱,也可支持DNase抑制了SP标准菌转化为青霉素低敏感菌株。由于生物大分子DNase不易进入细菌内,不可能作用于外源性基因的重组和表达,很可能作用于外源性基因的转移环节,因而DNase的分子抑制机制既有DNase随机剪切外源性SP青霉素耐药基因以显示抑制SP青霉素耐药基因转移的效应,又有DNase特异切割SP青霉素耐药基因调控序列以显现抑制SP青霉素耐药基因转移的功能[13-15]。
总之,DNase具有抑制SP青霉素耐药基因转移的作用,是依次通过外源性DNA提取实验、SP的转化实验和SP的抑制转化实验而揭示。本研究结果表明,DNase具有阻抑PRSP形成的潜在功能;同时,还表明DNase具有阻抑一些其他耐药菌形成的潜在作用。本研究结果将为深入研究DNase阻抑耐药细菌形成和开发阻断耐药基因水平传播的药物提供前期研究及思路。
