尿激酶型纤溶酶原激活物对食管鳞癌细胞增殖与转移的影响
2018-11-28孙晶莹霍雪萍王海鹏
侯 磊,雷 敏,孙晶莹,霍雪萍,王海鹏*
(1陕西省人民医院肿瘤内科,西安 710068;2陕西省康复医院护理部;3陕西省人民医院中心实验室;*通讯作者,E-mail:wang-hp@163.com)
我国为食管癌高发区,大部分患者就诊时已处于中晚期,3年生存率低于20%,其中转移是引起死亡主要原因。肿瘤细胞转移是一个多步骤、多环节过程,包括基底膜降解,侵入血管、循环至靶器官、侵出血管、转移灶形成。尿激酶型纤溶酶原激活物(urokinase plasminogen activator,uPA)为一种蛋白水解酶,与肿瘤细胞转移行为密切相关[1],在细胞外基质(extracellular matrix,ECM)降解过程中发挥着重要作用,并且能够促进肿瘤新生血管形成,增加肿瘤细胞远处转移几率。研究发现,uPA在乳腺癌、卵巢癌和前列腺癌等恶性肿瘤中均处于过表达,在肿瘤细胞侵袭、转移过程中发挥着至关重要的作用,同时也常被作为一种预后指标被研究[2-4]。Goscinski等[5]在食管癌研究中发现,远处转移食管癌患者中uPA表达阳性率为100%,显著高于无远处转移患者,并且uPA高表达的肿瘤其侵袭力更强。因此,uPA与食管癌细胞的转移能力有着密切关系。此外,研究还发现uPA与多条肿瘤细胞增殖相关信号通路作用密切,在肿瘤细胞增殖过程中发挥着重要作用[6,7]。因此,uPA能够成为一个有效治疗靶点,用于降低食管癌细胞转移和增殖,进而延长患者生存期。目前大多数关于uPA与食管癌的研究,都集中在将其作为一种预测指标判断上,而将其作为一种治疗靶点的相关研究较少[8]。本研究以此为依据,使用食管鳞癌细胞ECA-109,通过RNA干扰技术下调uPA表达,在此基础上研究uPA降低对食管鳞癌细胞侵袭与转移能力的影响,同时分析细胞增殖的变化。
1 材料与方法
1.1 细胞株及主要试剂
人食管鳞癌细胞株ECA-109购自中国科学院上海生科院细胞资源中心。甲基偶氮唑盐(MTT)购于美国Sigma公司。DMEM-H培养基和胎牛血清购于美国HyClone公司。胰蛋白酶购于美国Sigma公司。蛋白裂解液(Ripa)购于陕西先锋生物科技有限公司。免疫蛋白增强化学发光法试剂盒购于美国Thermo公司。兔抗人uPA、VEGF抗体购于武汉三鹰生物技术有限公司。Matrigel胶购于美国BD公司,Transwell小室购于美国Millpore公司。细胞周期检测试剂盒购于江苏凯基生物技术股份有限公司。Tubofect Transfection Reagent购于美国Thermo公司。uPA小干扰RNA由上海吉玛制药技术有限公司合成(序列5′-CGCAUGACUUUGACUGGAATT-3′和5′-UUCCAGUCAAAGUCAUGCGTT-3′)。
1.2 细胞培养与转染
细胞采用DMEM-H培养基(含10%胎牛血清)在5% CO2、37 ℃培养箱内培养。毎2-3 d传代1次。ECA-109细胞种植于6孔板内,使其密度达到80%-90%,按照Tubofect Transfection Reagent说明书将含有小干扰RNA片段转染液加入,均匀摇荡,放入培养箱内行后续试验。
1.3 MTT法检测细胞毒性
uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染后12 h消化细胞调整密度为2×104-5×104/ml,接种于96孔板,转染后20,44,68 h分别各孔中加入5 mg/ml MTT 20 μl,继续培养4 h,弃培养液,加入100 μl DMSO,酶标仪读取各孔A490值,取均值。
1.4 流式细胞术分析细胞周期
uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染48 h后使用胰酶消化细胞,取5×105-6×105细胞离心,PBS重悬细胞,洗涤2次,将细胞缓慢注入10倍体积70%冰乙醇中4 ℃固定24 h,离心后弃除乙醇,PBS洗涤2次,加入RNA酶37 ℃水浴30 min,加入PI 4℃避光30 min,400目筛网滤过细胞悬液,流式细胞仪选择488 nm波长检测细胞DNA含量,分析细胞周期。
1.5 Western blot检测uPA与VEGF蛋白表达
uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染48 h后弃上清,用含有蛋白酶抑制剂的裂解液提取蛋白,采用BCA法测定浓度。使用SDS-PAGE凝胶分离,将目的条带使用PVDF膜转膜,用含5%脱脂牛奶的TBS-T封闭2 h,加一抗(uPA稀释1 ∶500,VEGF稀释1 ∶500)后4 ℃温育过夜,TBS-T洗3次,每次15 min,加羊抗兔二抗(1 ∶1 000稀释),室温温育1 h,TBS-T洗3次,每次15 min,用ECL发光法检测蛋白表达状况。使用Image-Pro Plus软件分析灰度值。
1.6 迁移实验
uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染后12 h使用无血清DMEM-H调整细胞1×105/ml,吸取100 μl缓慢加入Transwell小室内,放入含有1 ml 20%血清DMEM-H培养基内,转染后36 h弃去小室培养基,用棉签擦去上室内细胞,使用4%多聚甲醛避光固定30 min,用0.1%结晶紫染色30 min,显微镜下观察穿透基底膜的细胞个数。取5个视野,计算每个视野细胞数,取平均值。
1.7 划痕实验
uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染后24 h细胞生长至100%,使用10 μl移液枪头划痕,PBS洗涤细胞,使用无血清DMEM-H孵育细胞24 h。使用Image J软件分析划痕愈合情况。
1.8 侵袭实验
matrigel基质胶与无血清DMEM-H培养液,以1 ∶8比例配置为工作液,取40 μl添加到Transwell小室底部膜上室面,37 ℃培养4 h。超净台内将20 μl培养液加入小室内放置5 min后吸出。uPA小干扰RNA及阴性对照RNA转染ECA-109细胞,转染后12 h使用无血清DMEM-H调整细胞为5×105/ml,取100 μl缓慢加入Transwell小室内,放入含有1 ml 20%血清的DMEM-H培养基内,转染后36 h弃去小室培养基,用棉签擦去基质胶和上室内细胞,使用4%多聚甲醛避光固定30 min,用0.1%结晶紫染色30 min,显微镜下观察穿透基底膜的细胞个数。取5个视野,计算每个视野细胞数,取平均值。
1.9 统计学分析
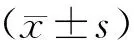
2 结果
2.1 uPA小干扰RNA在食管癌ECA-109细胞中干扰效果
使用Western-blot检测了uPA小干扰RNA在食管鳞癌细胞株ECA-109中干扰效果。si-RNA组细胞相较于control组和si-NC组细胞内uPA蛋白表达量明显减少,差异具有统计学意义(P<0.05),control组与si-NC组细胞间uPA蛋白表达量差异无统计学意义(P>0.05,见图1)。
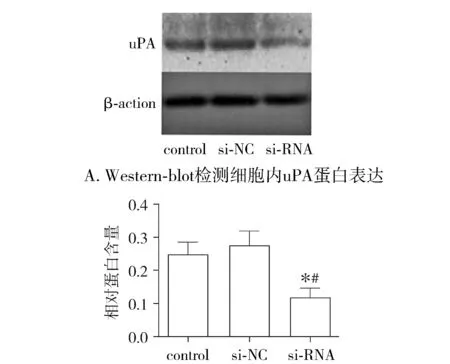
与control组比较,*P<0.05;与si-NC组比较,#P<0.05 B. uPA相对蛋白含量柱状图
2.2 uPA表达抑制降低了食管癌ECA-109细胞增殖能力
使用MTT方法检测uPA对食管癌细胞ECA-109增殖能力的影响。在转染后24 h,三组间OD值差异无统计学意义(P>0.05),转染后48 h时三组之间OD值差异仍无统计学意义(P>0.05),转染后72 h时,control组(1.634±0.217)、si-NC组(1.517±0.184)OD值较si-RNA组(1.188±0.184)明显增加(P<0.05),而control组与si-NC组间OD值差异无统计学意义(P>0.05,见图2)。因此MTT实验结果表明,转染后72 h uPA的抑制降低了ECA-109细胞增殖能力。
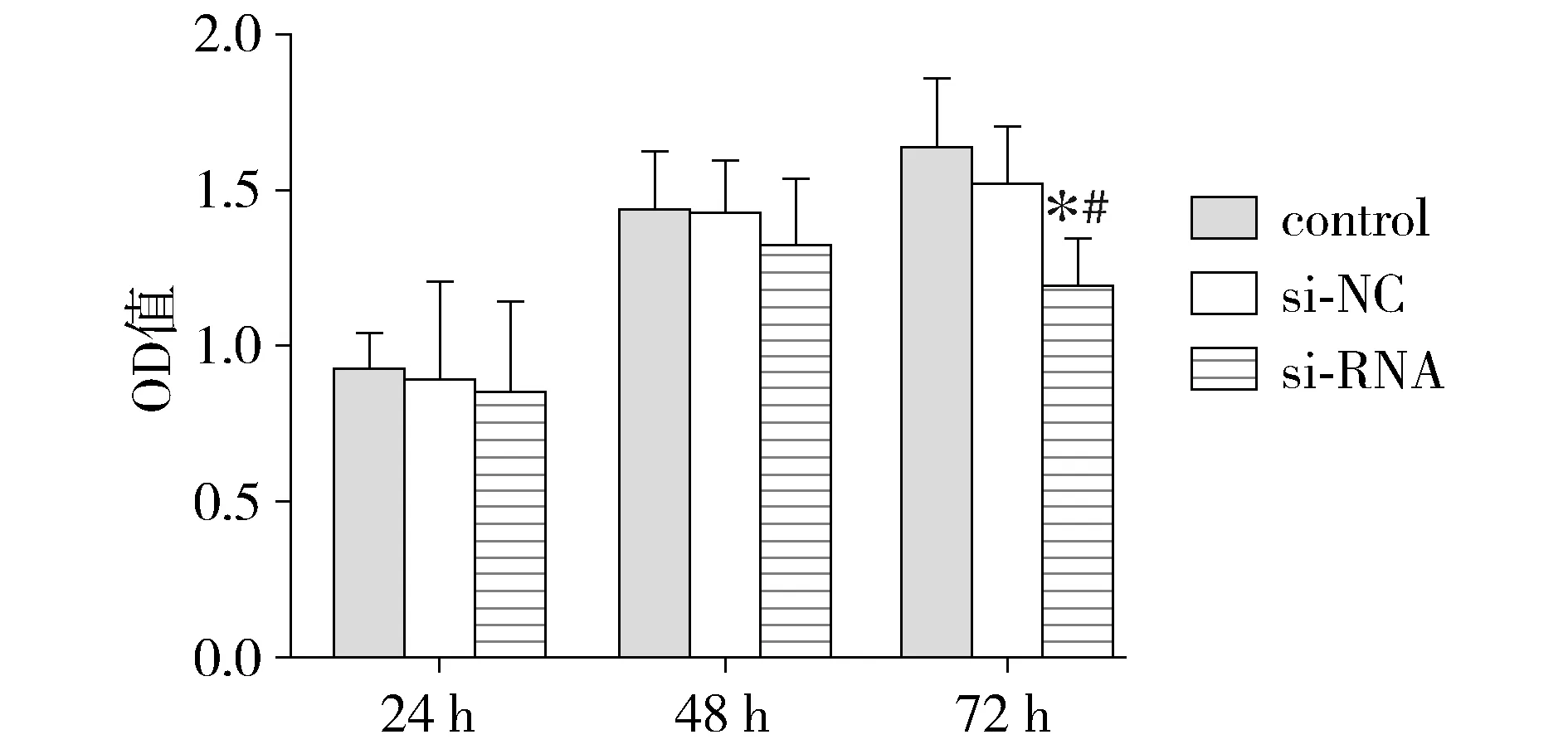
与control组比较,*P<0.05;与si-NC组比较,#P<0.05
2.3 uPA表达抑制诱导了食管癌ECA-109细胞周期阻滞
流式细胞术检测uPA对ECA-109细胞周期影响,结果显示:si-RNA组[(8.9±1.2)%]与control组[(14.2±2.6)%]和si-NC组[(18.6±1.9)%]相比,G2期细胞比例明显降低,其差异具有统计学意义(P<0.05)。control组与si-NC组相比,各期间差异无统计学意义(P>0.05,见图3)。结果表明,uPA抑制将ECA-109细胞周期阻滞于G2期。
2.4 uPA表达抑制降低了食管癌ECA-109细胞迁移能力
通过迁移实验检测uPA对ECA-109细胞迁移能力影响,结果发现,si-RNA组细胞(30.0±6.0)相较于control组(90.3±7.2)与si-NC组(82.0±8.7),细胞迁移数明显减少(P<0.05,见图4)。control组与si-NC组之间细胞迁移数差异无统计学意义(P>0.05,见图4)。结果表明,uPA的抑制降低了ECA-109细胞迁移能力。
同时使用划痕实验进一步观察uPA对ECA-109细胞运动能力的影响,结果显示:control组与si-NC组相较于0 h,24 h时划痕面积明显缩小(P<0.05,见图5)。si-RNA组在0 h与24 h时,其划痕面积变化无统计学意义(P>0.05)。结果表明,uPA抑制降低了ECA-109细胞运动能力。
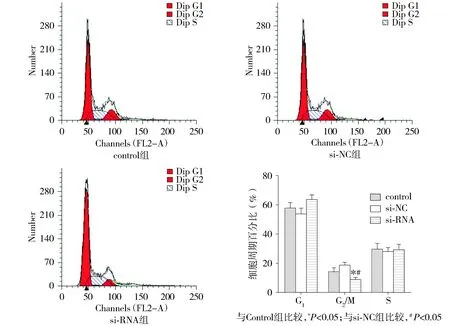
图3 uPA的siRNA对ECA-109细胞周期分布的影响Figure 3 Effect of uPA-siRNA on cell cycle distribution of ECA-109 cells
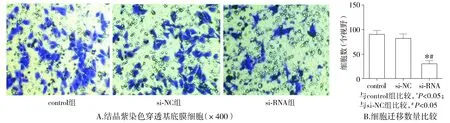
图4 uPA的siRNA对ECA-109细胞迁移能力的影响Figure 4 Effect of uPA-siRNA on migration ability of ECA-109 cells
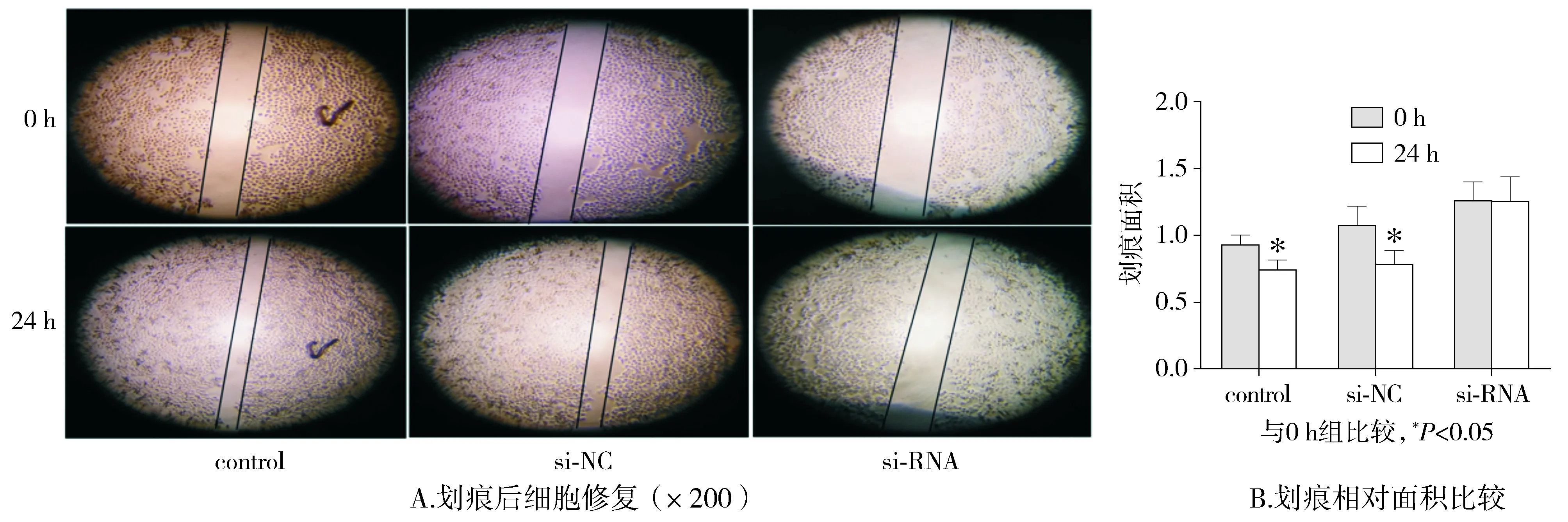
图5 uPA的siRNA对ECA-109细胞划痕24 h后修复能力的影响Figure 5 Effect of uPA-siRNA on repair ability of ECA-109 cells at 24 h after scratching
2.5 uPA表达抑制降低了食管癌ECA-109细胞侵袭能力
侵袭实验结果表明:si-RNA组(26.6±2.5)相较于control组(40.0±2.0)与si-NC组(39.3±1.5),侵袭细胞数明显减少(P<0.05)。control组与si-NC组之间侵袭细胞数差异无统计学意义(P>0.05,见图6)。结果表明,uPA抑制能够降低ECA-109细胞侵袭能力。
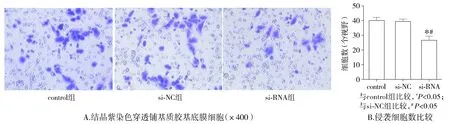
图6 uPA的siRNA对ECA-109细胞侵袭能力的影响Figure 6 Effect of uPA-siRNA on the invasion ability of ECA-109 cells
2.6 uPA表达抑制降低了食管癌ECA-109细胞VEGF蛋白表达
相较于control组和si-NC组,si-RNA组VEGF蛋白表达量明显减少(P<0.05),control组与si-NC组之间差异无统计学意义(P>0.05,见图7)。结果表明,uPA抑制降低了ECA-109细胞VEGF蛋白的表达。
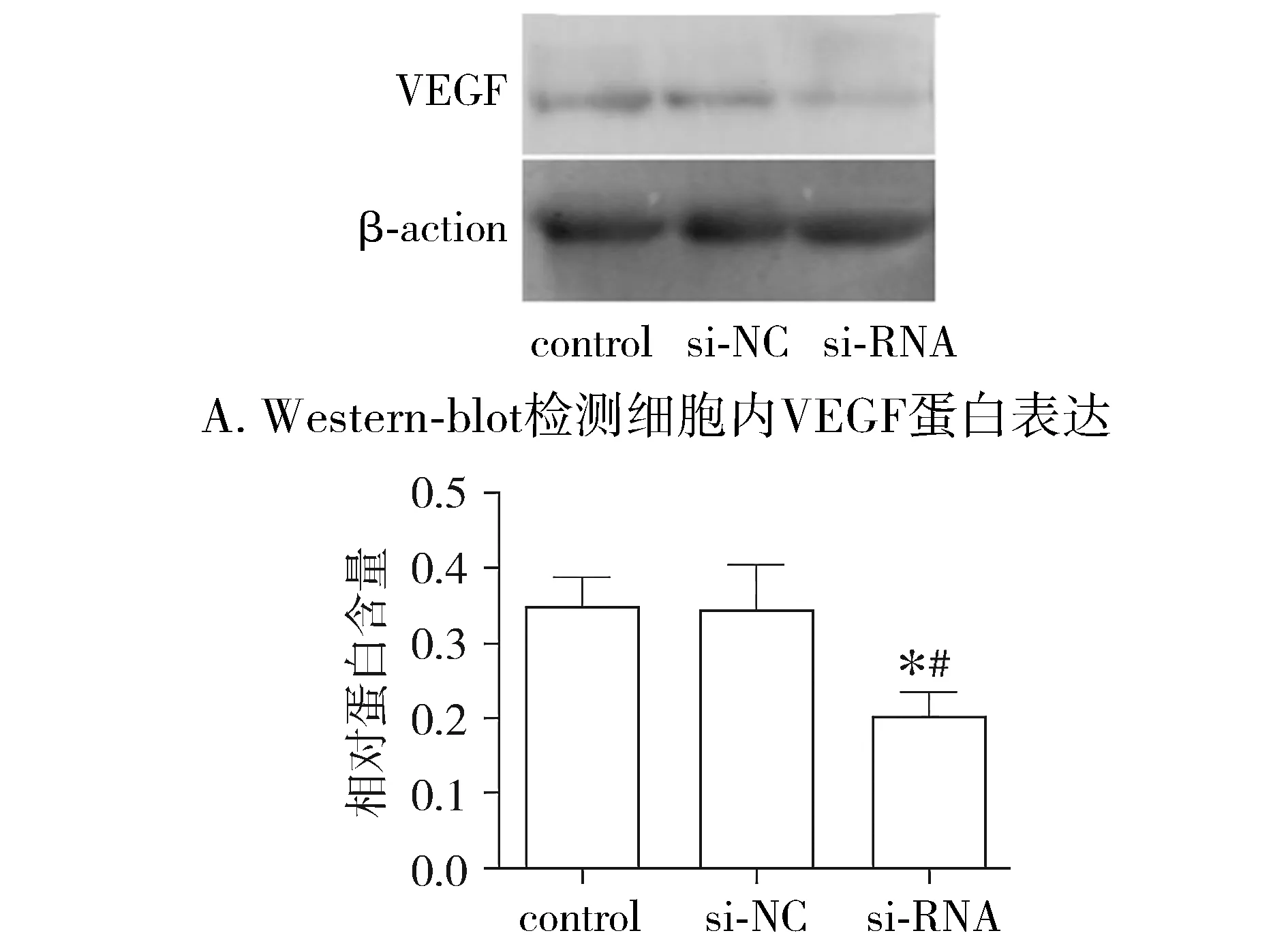
与control组比较,*P<0.05;与si-NC组比较,#P<0.05 B. VEGF相对蛋白含量分析
3 讨论
uPA是一种丝氨酸蛋白酶,由成纤维细胞、中性粒细胞、肿瘤细胞等合成。uPA通过与细胞表面uPA特异性受体(urokinase-type plasminogen activator receptor,uPAR)结合转变成具有活性的uPA,进而降解细胞外基质(extracellular matrix,ECM)。同时研究发现,uPA与uPAR结合产生的纤溶酶还具有信号传递作用,能够作用于多种信号通路,使肿瘤细胞出现趋化、迁移、增殖等生物效应行为,与肿瘤预后密切相关[9]。
近来发现uPA与肿瘤细胞侵袭、转移具有密切关系,如激活Notch信号通路[10],与MAPK[11]、核因子-κB(nuclear factor-κB,NF-κB)[12]信号通路相互作用促进肿瘤侵袭与转移。因此,uPA除了是一个预测肿瘤预后的因子,还是一个理想的抗肿瘤侵袭转移作用靶点。例如在恶性胶质瘤中,将uPA敲除后明显减少了肿瘤细胞的迁移和浸润[13]。本实验同样发现,通过RNA干扰技术降低uPA表达后,ECA-109这种高侵袭性食管鳞癌细胞侵袭与迁移能力也明显下降,表明在食管鳞癌中uPA的抑制同样可以降低细胞迁移与侵袭能力。
在肿瘤转移中,肿瘤新生血管的形成是必不可少的条件之一。血管内皮生长因子(vascular endothelial growth factor,VEGF)是促进血管生成的重要调节因子。研究表明,uPA/uPAR系统与VEGF有着密切关系[14,15]。Jiang等[16]发现,食管癌中uPA与VEGF的表达具有一致性,并且VEGF与uPA在食管癌血管形成中具有互相调节作用,uPA能通过上调或激活VEGF诱导肿瘤血管生成,而VEGF的高表达反过来又能上调uPA的表达,增加细胞外基质及微血管基底膜的降解,为肿瘤血管的生成提供一个有利的微环境。本实验中,uPA表达降低抑制了ECA-109细胞VEGF表达。因此,对于uPA的抑制,能够通过降低食管癌细胞运动、侵袭与抑制肿瘤新生血管形成,多种途径来减少食管癌细胞转移。uPAu/PAR系统除了促进肿瘤细胞转移外,还能维持肿瘤细胞高增殖性。研究显示,uPA能够诱导多个增殖信号通路的级联反应,如细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)通路与磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路[7]。在卵巢癌SKOV-3腺癌细胞系中,抑制uPAR表达能够使肿瘤细胞停留在细胞周期G0/G1时相[3]。Gondi等[13]在体外使用shRNA抑制uPAR表达,下调了脑胶质瘤细胞中促肿瘤增殖信号通路。在本研究中,uPA下调同样抑制了ECA-109细胞增殖,并且诱导其细胞周期阻滞在G2期。
综上所述,本研究证实在食管鳞癌细胞中能够通过对uPA的下调来降低细胞的侵袭与增殖能力。因此,uPA能够成为一个有效降低食管癌细胞转移与增殖的作用靶点,为我们临床上预防食管癌转移提供一个有效的治疗手段。
