Kiss和CDK7基因在胃癌中的表达及临床意义
2018-11-28焦丽玮王凤娇秦志山王亚明
杨 安,焦丽玮,王凤娇,秦志山,王亚明,刘 平
(1邯郸市中心医院普外科,邯郸 056001;2邯郸市中心医院病案科;3邯郸市中心医院妇科)
胃癌(gastric carcinoma)是起源于胃黏膜上皮的恶性肿瘤,是人类消化系统常见的恶性肿瘤之一,在世界范围内发病呈上升趋势,在我国各种恶性肿瘤中发病率居首位,胃癌可发生于胃的任何部位,常与胃炎、胃溃疡等胃慢性疾病症状相似,易被忽略,目前我国胃癌的早期诊断率仍较低[1-3]。因此,深入探讨胃癌的发生机制,为降低胃癌发病率,提早预防胃癌发生,提高胃癌患者成活率具有重要意义。
Kiss基因是在肿瘤发生发展中起抑制作用的基因。Kiss基因最早在黑色素瘤细胞中被发现,与多种恶性肿瘤的转移抑制有关,它编码一个由145个氨基酸组成的亲水蛋白,含4个外显子[4-6]。CDK7是细胞周期蛋白依赖性激酶(CDK,cyclin-dependent kinases)基因家族的成员,参与细胞周期的调控。CDK7可与相应的周期蛋白结合,参与到CDK/cyclins级联反应中,实现对细胞周期的调控,它的活跃与表达程度跟肿瘤形成有重要关系[7-9]。
本研究利用RT-PCR方法检测胃癌组织及癌旁正常组织中CDK7、Kiss的mRNA表达情况,利用Western blot检测CDK7、Kiss的蛋白表达,探讨CDK7、Kiss基因在胃癌细胞发生中的作用机制,为癌症诊治提供新的思路。
1 材料与方法
1.1 仪器与试剂
RT-PCR仪(Veriti,ABI),低温冷冻离心机(5418R,Eppendorf),琼脂糖凝胶电泳仪(164-5056,BIO-RAD),紫外分光光度(UV-2102PCS,上海尤尼柯仪器有限公司),蛋白电泳仪(Mini-PROTEAN Tetra,BIO-RAD),低温冰柜(BD/BC-221SEA,青岛海尔),凝胶成像系统(Gel DocTMXR+Gel Documentation System,BIO-RAD),RT-PCR试剂盒(B532431-0100,上海生工)、Trizol试剂盒(12183555,上海生工)以及蛋白质裂解液(C500001,上海生工),Kiss抗体(sc-101246,Santa Cruz)、CDK7抗体(sc-56284,Santa Cruz)。
1.2 组织标本材料
组织标本取自邯郸市中心医院2014-01~2017-01接受胃癌筛查及治疗的患者,其中正常胃组织42例,胃癌组织68例,组织标本手术切割后于液氮中贮存。68例胃癌患者术前均未经化疗,年龄32-72岁,平均53.6岁,男性38例,女性30例。
1.3 RT-PCR检测CDK7、Kiss表达
1.3.1 Trizol试剂盒提取胃组织总RNA 首先取新鲜胃组织50 mg磨成粉后,加入1 ml的Trizol试剂于离心管中混匀后室温静置10 min;加入300 ml氯仿后剧烈摇晃混匀后于12 000 r/min离心机上离心8 min;取上层清液于一新离心管中,加入500 ml异丙醇,混匀,室温放置15 min;12 000 r/min离心15 min,弃上清液,加75%酒精1 000 μl,混匀后4 ℃下12 000 r/min离心8 min,重复一次;弃上清,干燥15 min后,加50 μl DEPC处理水,溶解后在紫外分光光度计下检测提取的RNA样品的纯度和浓度。
1.3.2 反转录PCR检测Kiss与CDK7的相对基因水平 PCR反应条件:95 ℃预热5 min,然后95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环后72 ℃延伸5 min。Kiss所用引物序列F:5′-ACCTGGCTCTTCTCACCAAG-3′;R:5′-TAGCAGCTGGCTTCCTCTC-3′。CDK7所用引物序列F:5′-TCACATCTTCAGTGCAGCAGG-3′;R:5′-TGGCAGCTGACATCCAGGT-3′。以β-actin为内参。所得PCR产物取10 μl上样,用2%琼脂糖凝胶进行电泳,所得结果用BIO-RAD Gel Doc XR凝胶成像系统进行处理,然后用软件Image Lab4.0进行结果分析。目的基因在癌组织的条带灰度值大于癌旁组织时为阳性。
1.4 Western blot检测CDK7、Kiss蛋白表达
1.4.1 总蛋白提取 首先将胃组织样品和蛋白质裂解液以1 ∶10的比例混合。100 mg研磨粉碎的组织加1 000 μl裂解液;用组织搅拌器匀浆1 h;装入离心管于4 ℃ 12 000 r/min冷冻离心机内离心20 min;去中间无色液体到另一个新的离心管中,-80 ℃保存。提取的蛋白质用BCA蛋白浓度测定试剂盒来测定其浓度。
1.4.2 Western blot检测CDK7、Kiss的蛋白相对表达量 取适量提取的蛋白质进行SDS-PAGE电泳;用封闭液室温下封膜(PVDF膜)1 h后,加入CDK7、Kiss抗体(1 ∶300)、β-actin抗体(1 ∶1 000),4 ℃过夜;弃一抗,用1xTBST漂洗3次,每次20 min;加入辣根过氧化物酶标记的二抗(1 ∶1 000),室温30 min;弃二抗,用1×TBST漂洗3次,每次20 min;加入化学发光试剂,用Bio-Rad Chemi DOC MP成像系统拍照,用软件Image Lab4.0进行分析处理。目的基因在癌组织的条带灰度值大于癌旁组织时为阳性。
1.5 统计学分析

2 结果
2.1 CDK7、Kiss在不同组织中的表达差异
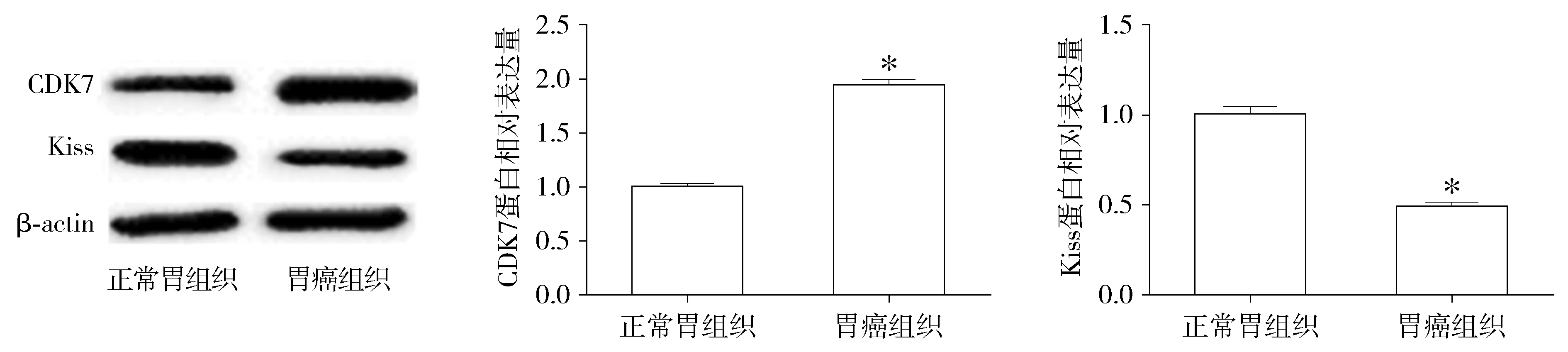
胃癌组织和正常组织中CDK7 mRNA的相对表达量分别为0.725±0.045和0.368±0.066。胃癌组织和正常组织中Kiss mRNA的相对表达量分别为0.325±0.056和0.648±0.036。胃癌组织中CDK7 mRNA表达量是正常组织的1.971倍(P<0.05),而Kiss mRNA表达量正常组织是胃癌组织的1.994倍(P<0.05,见图1)。

与正常组织比较,*P<0.05
2.2 胃癌组织中CDK7、Kiss的表达与临床病理特征的关系
中低分化的胃癌组织CDK7 mRNA表达的阳性率高于高分化的胃癌组织,这说明CDK7的表达与胃癌组织分化程度有关(P<0.05),与患者年龄、性别、TNM分期、侵犯神经血管、淋巴结转移、远端转移无显著相关关系(P>0.05)。无淋巴转移的胃癌组织Kiss mRNA表达的阳性率高于有淋巴转移的胃癌组织,表明Kiss的表达与淋巴转移和远端转移有关(P<0.05),与患者年龄、性别、TNM分期、侵犯神经血管无显著相关关系(P>0.05,见表1)。
2.3 Western blot检测CDK7、Kiss的表达
胃癌组织和正常组织中CDK7蛋白的相对表达量分别为0.578±0.015,0.291±0.045,胃癌组织和正常组织中Kiss蛋白的相对表达量分别为0.242±0.054,0.531±0.046(见图2)。胃癌组织中CDK7蛋白表达量是正常组织的1.986倍(P<0.05),而Kiss蛋白表达量中,正常组织是胃癌组织的2.194倍(P<0.05)。
2.4 胃癌组织中CDK7、Kiss的蛋白表达与临床病理特征的关系
中低分化的胃癌组织CDK7蛋白表达的阳性率高于高分化的胃癌组织,这说明CDK7蛋白表达与胃癌组织分化程度有关(P<0.05),与患者年龄、性别、TNM分期、侵犯神经血管、淋巴结转移、远端转移无显著相关关系(P>0.05)。无淋巴转移的胃癌组织Kiss蛋白质表达的阳性率高于有淋巴转移的胃癌组织,无远端转移的胃癌组织Kiss蛋白质表达的阳性率高于有远端转移的胃癌组织,这说明Kiss蛋白质与淋巴转移和远端转移有相关(P<0.05),与患者年龄、性别、TNM分期、侵犯神经血管无显著相关关系(P>0.05,见表2)。

表1 CDK7、Kiss mRNA在胃癌组织的表达与临床病理特征的关系Table 1 Relationship between the expression of CDK7, Kiss mRNA and clinicopathological features in gastric carcinoma
与正常组织比较,*P<0.05
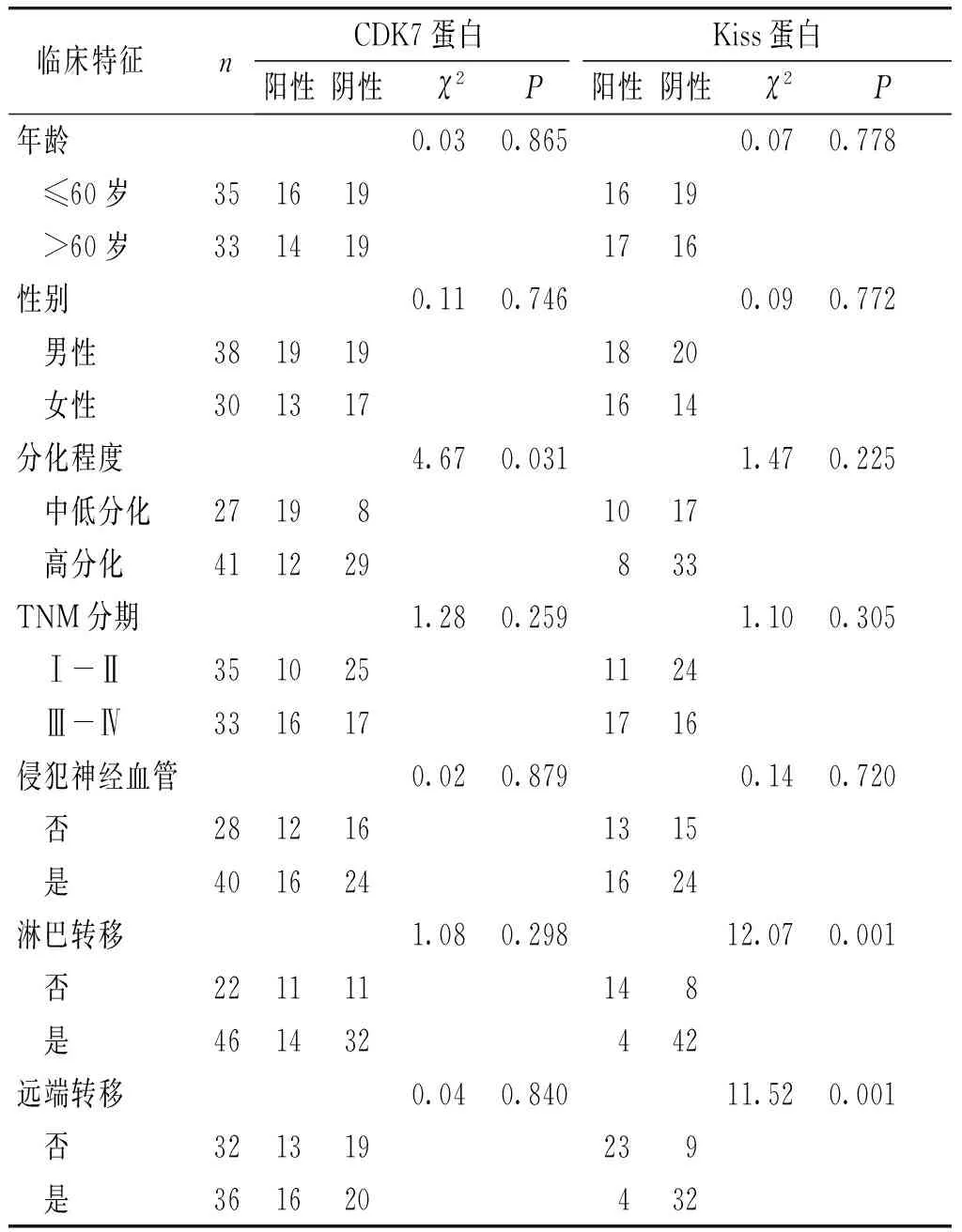
表2 CDK7、Kiss蛋白在胃癌组织的表达与临床病理特征的关系Table 2 Relationship between the expression of CDK7, Kiss proteins and clinicopathological features in gastric carcinoma
3 讨论
Kiss基因是肿瘤的抑制基因,当Kiss基因表达较高时,抑制肿瘤细胞的增殖和转移,在癌症发生发展中,Kiss基因通过表达调控抑制PI3K/AKT/NF-κB信号通路,促使MMP-9合成的减少,从而抑制癌细胞的增生和转移[10,11]。同时,Kiss蛋白介导PKC(蛋白激酶C)的活化,而PKC在多种细胞功能上具有关键的调控作用[12]。CDK7基因是CDK家族基因的一员,CDK可与相应的细胞周期蛋白(Cyclin)结合形成复合物,磷酸化对应的底物,调控细胞不同周期的进程。CDK7对应的细胞周期蛋白被认为是cyclin H,它在整个细胞周期过程一直存在,当CDK7表达活跃时,与cyclin H结合成复合物,促进其他CDK系列基因的表达,使细胞快速分裂和增殖[13,14]。CDK的活性依赖于其正调节亚基cyclin的顺序性表达和其负调节亚基CDI(cyclin dependent kinase inhibitor,CDK抑制因子)的浓度。同时,CDK的活性还受到磷酸化和去磷酸化,以及癌基因和抑癌基因的调节[15]。
本研究通过RT-PCR与Western blot检测技术来探索CDK7、Kiss基因在胃癌组织中的表达及其临床意义。RT-PCR检测结果显示CDK7 mRNA在胃癌组织中的表达高于正常组织,Western blot结果显示CDK7蛋白在胃癌组织中表达高于正常组织(P<0.05),同时,CDK7基因的表达与胃癌组织分化程度有关(P<0.05),与年龄、TNM分期、血管神经侵犯、淋巴结转移、远端转移无显著相关关系(P>0.05),这与刘庆滨等[16]在胃癌中的研究结果一致。RT-PCR检测结果显示Kiss基因mRNA在正常组织中的表达高于胃癌组织,Western blot结果显示Kiss蛋白在正常组织中的表达高于胃癌组织(P<0.05),同时,Kiss基因与淋巴转移、远端转移有显著相关(P<0.05),但与性别、血管神经侵犯、TNM分期无显著相关关系(P>0.05),这与王春晖等[17]在人胰腺癌中的研究结构类似。本研究揭示CDK7与Kiss基因在胃癌细胞增殖分化中的相关影响。胃癌组织中CDK7 mRNA及其蛋白表达含量显著增高,Kiss mRNA及其蛋白表达含量显著减少,提示Kiss基因与CDK7基因可能在胃癌细胞增殖分化中存在相互抑制作用。结合文献研究,我们推测Kiss基因可能通过Kiss蛋白的表达,促进PKC的活化,PKC磷酸化cyclins H而抑制CDK7基因的表达,但其具体机制仍需进一步研究。
综上所述,CDK7基因与胃组织癌细胞增殖分化有关,Kiss基因与淋巴结转移和远端转移有关。CDK7、Kiss蛋白含量检测可做为胃癌细胞早期形成、发展、转移诊断的新线索。但是由于胃癌形成的复杂性,CDK7、Kiss基因在胃癌细胞的形成过程的具体机制和相互作用目前尚未清楚,有待进一步的研究。
