PD-1/PD-L1抑制剂治疗中青年和高龄非小细胞肺癌患者有效性的Meta分析
2018-11-28尚聪聪
宋 鹏,尚聪聪,张 力*
(1中国医学科学院北京协和医学院北京协和医院呼吸内科,北京 100730;2河南省人民医院呼吸内科;*通讯作者,E-mail:zhanglipumch@aliyun.com)
肺癌是世界范围内死亡率最高的肿瘤,其中高龄人群的发病率和死亡率明显升高,约50%的肺癌患者确诊年龄在65岁以上,80%以上的肿瘤相关死亡发生在60岁以上人群[1]。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)通过阻断T细胞表面抑制性分子的作用增强T细胞的功能[2],近年来程序性死亡因子1(programmed death-1,PD-1)及其配体(programmed death ligand 1,PD-L1)的单克隆抗体在晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗中取得突破性进展。PD-1/PD-L1抑制剂nivolumab、pembrolizumab、atezolizumab、durvalumab在晚期肺癌的二线[3]、维持[4]甚至一线[5]治疗方面均有显著临床获益。但高龄患者机体免疫功能衰退,理论上PD-1/PD-L1抑制剂获益有限,大型临床试验Checkmate017/057[6,7]、Keynote010[5]显示高龄患者无ICIs治疗的显著获益,但OAK临床试验[8]证实高龄患者免疫治疗后总生存期(overall survival,OS)延长。因此,关于高龄NSCLC患者使用ICIs治疗是否获益尚无一致结论,本研究采用循证医学的研究方法,旨在分析不同年龄非小细胞肺癌(NSCLC)患者PD-1/PD-L1抑制剂治疗的有效性。
1 资料与方法
1.1 纳入标准
①研究类型为随机对照试验(RCT);②研究目的包含PD-1/PD-L1单药治疗非小细胞肺癌患者的有效性;③可从文中提取不同年龄分层患者无进展生存期PFS、OS的风险比(hazard ratio,HR)及其95%可信区间(confidence interval,CI)。
1.2 排除标准
①综述、个案报道、专家评论、无对照组;②提供信息不完整或重复发表的文献;③动物实验及基础实验;④中、英文以外的文献。
1.3 观察指标
对符合纳入标准的文献提取以下信息:第一作者姓名,发表年限,临床试验分期,免疫治疗线数,PD-L1表达限定截值、治疗方案、年龄分层及PFS、OS的风险比。
1.4 检索策略
以(“PD-1”OR“PD-L1”OR“nivolumab”、“pembrolizumab”OR“atezolizumab”OR“durvalumab”)AND(“lung cancer”OR“lung neoplasm”OR“lung carcinoma”)为检索式检索Pubmed、EMBASE、Science、Google Scholar等英文数据库,以(“PD-1”OR“PD-L1”OR“nivolumab”、“pembrolizumab”OR“atezolizumab”OR“durvalumab”)AND(“肺癌”OR“肺腺癌”OR“肺肿瘤”)为检索式检索知网、万方、维普等中文数据库,截止日期设定为2018年1月。首先通过文献题目和摘要部分确定可能需要的文献,再通过全文浏览筛选出包含年龄分层、PFS、OS等相关数据的文献。
1.5 资料提取和文献质量评价
由2名研究者独立查阅文献,阅读文献标题、摘要及全文进行筛选文献并提取数据、评价文献的偏倚风险。经交叉核对,如遇分歧,则通过双方讨论,或征求第三方意见协助解决。随机对照试验按照Cochrane评价手册[9]提供的评价标准进行质量评价:①随机分配方法;②分配方案隐藏;③是否采用盲法;④结果数据的完整性、随访情况;⑤基线是否可比。用Jadad评分进行说明,分数1-2分为低质量,3-5分为高质量。信息提取及文献质量评价均由两位研究者独立完成,若存在分歧则由第三位研究者核对后决定。
1.6 统计学处理
统计学分析使用软件Review Manager Version 5.3进行。不同年龄分层的PFS和OS使用其合并效应量HR及其95%可信区间(confidence interval,CI)进行评价。各研究间的异质性大小使用I2检验来进行评估。当P≥0.1且I2≤50%,认为各研究间异质性较小,采用Mantel-Haenszel固定效应模型来计算;当P<0.1且I2>50%,认为各研究间异质性较大,合并效应量使用DerSimonian-Laird随机效应模型来计算,检验水准选取双侧α=0.05。最终的分析结果使用森林图来展示,小矩形的大小表示权重,大菱形的宽度表示合并效应量的可信区间,无效线的标度为“1”,菱形与无效线不交叉时表明差异具有统计学意义。发表偏倚绘制倒漏斗图进行评估。
2 结果
2.1 纳入研究的基本情况及质量评估
纳入研究的入排流程见图1。通过筛选403篇文献,最终纳入6项临床试验。6项临床试验均为PD-1/PD-L1单药对比标准化疗的Ⅱ/Ⅲ期随机对照临床试验,共包含3 277例患者,其中65岁以下1 760人,65岁以上1 517人。PD-1/PD-L1作为一线治疗的临床试验2项,二线治疗4项。6项临床试验均采用PD-1/PD-L1对比化疗药物治疗方法,均为随机对照试验,Jadad评分均为高质量(见表1)。纳入研究的6项临床试验[5,7-11]基本特征见表2。
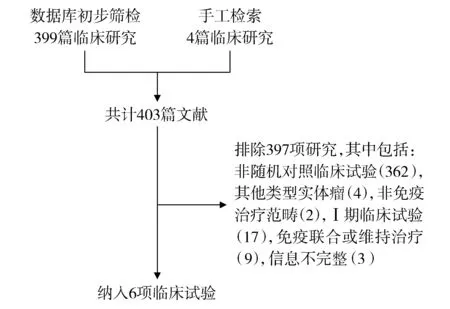
图1 文献筛选流程及结果Figure 1 Literature screening process and results

表1 纳入6项随机对照试验的Jadad评分Table 1 Jadad scores of 6 randomized controlled trials
2.2 Meta分析结果
共纳入6项随机对照临床试验,包含3 277例患者,以65岁为界分为中青年组和高龄组,分析两组人群免疫治疗OS、PFS的风险比。
2.2.1 PD-1/PD-L1抑制剂与化疗对中青年NSCLC患者OS及PFS的影响 PD-1/PD-L1抑制剂与化疗对中青年NSCLC患者OS的影响,各研究间异质性较大,合并效应量采用随机效应模型计算(P=0.01,I2=70%),结果显示PD-1/PD-L1抑制剂对比化疗对中青年患者OS获益(HR 0.76,95%CI 0.61-0.94,P=0.01);对于PFS的影响,各研究间异质性较大(P=0.01,I2=68%),合并效应量采用随机效应模型计算,结果显示PD-1/PD-L1抑制剂对比化疗对中青年患者PFS获益(HR 0.77,95%CI 0.60-0.97,P=0.03,见图2)。

表2 纳入6项随机对照临床试验的基本特征Table 2 Basic characteristics of 6 randomized controlled clinical trials
2.2.2 PD-1/PD-L1抑制剂与化疗对高龄NSCLC患者OS及PFS的影响 PD-1/PD-L1抑制剂与化疗对高龄NSCLC患者OS的影响,各研究间异质性相对较小(P=0.06,I2=51%),合并效应量采用固定效应模型计算,结果显示PD-1/PD-L1抑制剂可延长OS(HR 0.75,95%CI 0.66-0.86,P<0.000 1);对于PFS的影响,各研究间异质性较大(P=0.000 2,I2=77%),合并效应量采用随机效应模型计算,结果显示PD-1/PD-L1抑制剂对比化疗对高龄NSCLC患者PFS无明显获益(HR 0.92,95%CI 0.69-1.24,P=0.58,见图3)。
2.2.3 二线使用PD-1/PD-L1抑制剂与化疗对不同年龄段NSCLC患者OS的影响 纳入各研究同质性较好(I2=47%vsI2=26%),均采用固定效应模型,结果显示二线治疗中青年和高龄患者均有OS获益(HR 0.71,95%CI 0.62-0.81vsHR 0.70,95%CI 0.60-0.81,见图4)。
2.2.4 不同线数使用PD-1/PD-L1抑制剂与化疗治疗对中青年NSCLC患者PFS的影响 一线使用PD-1/PD-L1抑制剂纳入各研究异质性较大(P=0.01,I2=84%),合并效应量采用随机效应模型,结果显示PD-1/PD-L1抑制剂一线治疗对中青年患者PFS无显著获益(HR 0.86,95%CI 0.45-1.63);二线治疗纳入各研究异质性较小(P=0.18,I2=42%),合并效应量采用固定效应模型,结果显示二线使用PD-1/PD-L1抑制剂可延长PFS(HR 0.75,95%CI 0.64-0.87,见图5)。
2.2.5 不同线数使用PD-1/PD-L1抑制剂与化疗治疗对高龄NSCLC患者PFS的影响 一线或二线使用PD-1/PD-L1抑制剂对高龄NSCLC患者PFS的影响,纳入研究异质性较大(P=0.000 2,I2=93%vsP=0.01,I2=68%),合并效应量均采用随机效应模型,结果显示不同线数使用PD-1/PD-L1抑制剂与化疗相比对高龄NSCLC患者PFS均无显著获益(HR 0.75,95%CI 0.28-1.97vsHR 0.99,95%CI 0.73-1.34,见图6)。
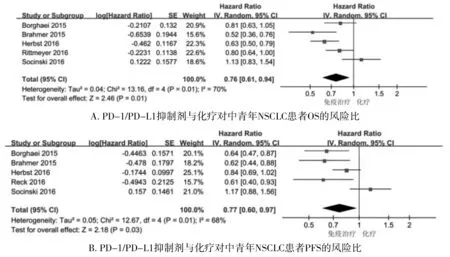
图2 PD-1/PD-L1抑制剂与化疗对中青年NSCLC患者OS/PFS的风险比Figure 2 Risk ratio of PD-1/PD-L1 inhibitor versus chemotherapy for OS/PFS in young and middle-aged NSCLC patients
2.3 发表偏倚
本研究发表偏倚以高龄患者OS绘制的倒漏斗图来评价,以HR值为横坐标,以LogHR为纵坐标绘制漏斗图,可见本文纳入文献的散点总体上分布比较均匀(见图7),提示纳入研究的发表偏倚较小。
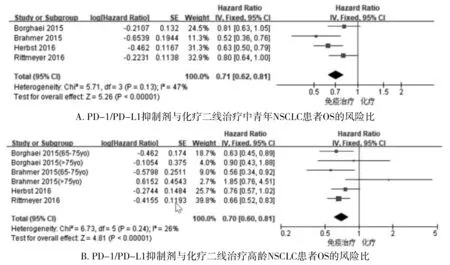
图4 二线使用PD-1/PD-L1抑制剂与化疗对不同年龄段NSCLC患者OS的风险比Figure 4 Risk ratio of second-line PD-1/PD-L1 inhibitors versus chemotherapy for OS in patients with different ages of NSCLC

图5 不同线数使用PD-1/PD-L1抑制剂与化疗治疗对中青年NSCLC患者PFS的风险比Figure 5 Risk ratio of PFS in young and middle-aged NSCLC patients treated with PD-1/PD-L1 inhibitor versus chemotherapy in different lines
3 讨论
本研究通过综合分析6项PD-1/PD-L1抑制剂单药治疗晚期非小细胞肺癌的随机对照临床试验证实PD-1/PD-L1抑制剂对高龄和中青年患者均有总生存期获益,高龄患者PFS获益不劣于传统化疗。近年来PD-1/PD-L1抑制剂在多项临床试验中证实了对晚期NSCLC的有效性。2015年一项关于ICIs对老年和中青年实体瘤患者治疗有效性的Meta分析[12]入组了9项随机对照临床试验,关于ipilimum-ab 3项,nivolumab 3项,tremelimab 1项,pembrolizumab 1项,实体瘤类型包括黑色素瘤(5项),NSCLC(2项),肾癌(12项)、前列腺癌(1项)。患者以65岁为年龄分界,结果显示ICIs对不同年龄段人群均有OS获益(中青年组HR 0.75,95%CI 0.68-0.82vs高龄组HR 0.73,95%CI 0.62-0.87),但其中4项PD-1抑制剂(nivolumab、pembrolizumab)治疗实体瘤的临床研究亚组分析未显示PD-1/PD-L1抑制剂显著获益(HR 0.86,95%CI 0.41-1.83),可能与PD-1抑制剂药物种类以及实体瘤种类不同有关。本研究提示高龄患者免疫治疗有总生存期获益,与有关研究一致[8],并通过纳入晚期NSCLC的PD-1/PD-L1免疫单药治疗降低了临床试验的异质性。

图6 不同线数使用PD-1/PD-L1抑制剂与化疗治疗对高龄NSCLC患者PFS的风险比Figure 6 Risk ratio of PFS in elderly patients with NSCLC using PD-1/PD-L1 inhibitor versus chemotherapy in different lines
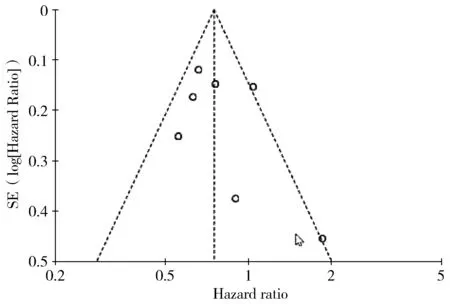
图7 高龄患者OS的发表偏倚漏斗图Figure 7 The funnel plots of publication bias for OS in elderly patients
高龄人群恶性肿瘤的发病率和死亡率明显升高,由于机体功能衰退,高龄晚期肺癌患者的药物治疗更需谨慎地权衡用药有效性和安全性。年龄增加导致免疫系统功能衰退,自身免疫性疾病、感染、肿瘤发病率上升[13-15]。高龄状态影响免疫系统的多种成分,其中最重要的影响是T细胞介导的免疫功能衰退[16]。动物实验和人体实验均证实T细胞活性随着年龄增长而下降,包括T细胞表面受体经抗原刺激后增殖存活能力下降和CD8+T细胞毒性减弱[17]。除此之外,高龄患者免疫系统还可发生CD28等共刺激因子下调,PD-1、淋巴细胞活化基因-3、T细胞免疫球蛋白黏蛋白-3等抑制性分子上调,抗原提呈细胞数量减少,调节性T细胞及骨髓源性抑制性细胞增多等改变[18-20],因此免疫治疗疗效对于中青年和高龄患者可能有所不同。近年来晚期非小细胞肺癌免疫治疗进展迅速,其有效性已在多项大型Ⅲ期临床试验中证实,但不同研究亚组分析对于高龄患者是否可获益于ICIs治疗的结论不一致。Checkmate026临床研究显示65岁以上人群免疫治疗相比化疗总生存期风险比为1.04(95%CI 0.77-1.41)[10],而OAK临床研究显示65岁以上人群免疫治疗OS有显著获益(HR 0.66,95%CI 0.52-0.83)[8]。随着世界人口老龄化进展,高龄肺癌患者必然面临免疫治疗的需求,该研究通过Meta分析的统计学方法收集评估PD-1/PD-L1抑制剂对高龄患者的治疗获益,但临床试验高龄人群入组数量有限,并且多数为体能评分较好,合并症较少的人群,不能完全代表真实世界的高龄人群,免疫治疗对于这一群体的有效性仍需Ⅲ期随机对照试验研究进一步证实。
本研究纳入的文献均为前瞻性随机对照临床试验,试验设计包含免疫一线和二线治疗方案,对不同免疫治疗线数进一步分层之后研究异质性减小,提示不同临床试验之间,使用免疫治疗应用时机不同为异质性产生的来源。此外,不同种类药物、不同治疗方案、人种、PD-L1界定水平等均可能产生异质性。
本研究存在一定的局限性:①包含的临床试验数量相对较少,不同临床试验之间存在免疫治疗一线用药和后线用药,PD-1/PD-L1药物种类不同以及入组人群PD-L1介值限定不同,这些因素均可能影响患者的总生存期,本研究采用随机效应模型尽可能减小异质性的影响;②本研究不能获得患者驱动性基因突变状态、既往治疗线数及用药方案、有无脑转移、吸烟史等更详细的信息,患者的总生存期可能受多种因素综合影响;③本研究所有患者的数据均从公开发表的文献中提取,可能存在选择偏倚及发表偏倚,但本文纳入的文献质量均较高,研究结果有一定参考意义。
总之,本研究初步证实PD-1/PD-L1抑制剂对高龄和中青年患者均有OS获益(以65岁分界),高龄患者必要时可以选择PD-1/PD-L1抑制剂治疗。未来临床试验需适度放宽高龄患者入组条件、细化高龄分层以更好地指导临床实践。
