大鼠肺上皮细胞体外机械拉伸损伤模型的建立与评价
2018-11-28张丽慧郭永清
王 哲,张丽慧,孙 丽,郭永清
(1山西医科大学麻醉系山西省人民医院麻醉教研室,太原 030001;2山西医科大学麻醉学系附属第二医院麻醉教研室;3山西医科大学附属人民医院麻醉科;*通讯作者,E-mail:gyq106968@aliyun.com)
机械通气为全麻患者提供呼吸支持的同时,也是治疗急性肺损伤和呼吸窘迫综合征的重要手段。然而,机械通气作为一种损伤因素可诱发或加重肺损伤,即机械通气所致肺损伤(ventilator-induced lung injury,VILI)[1-2]。据统计,22%-39%进行机械通气的患者会发生VILI,若伴有肺部疾患的病人发生率可高达83%[3]。研究机械通气所致肺损伤及机制对于改善全麻手术、危重患者的预后、提高患者生存率具有重要意义,尽管前人已经做了大量工作,机械通气诱发或加重肺损伤的机制目前还未完全阐明[4-6]。
在体动物实验已证实,在给予大潮气量、高频率机械通气时会诱发肺组织的炎症级联反应,引起肺组织不同程度的生物性损伤[7,8],但离体机械通气所致肺损伤模型制备还比较少见。本实验拟培养大鼠肺上皮Ⅱ型细胞株(RLE-6TN),并通过计算机控制的Flexercell-4000TTM细胞柔性基底加载系统建立离体细胞周期性机械拉伸模型,以期为进一步探讨机械通气所致肺损伤的机制建立实验基础。
1 材料与方法
1.1 细胞培养
采用大鼠肺上皮Ⅱ型细胞株(RLE-6TN,中南大学中心细胞室提供),以约1×105/m2的密度接种于包被多聚赖氨酸和胶原蛋白Ⅰ的BioFlex 6孔培养板上(BioFlex公司,美国),放入37 ℃、5% CO2培养箱中继续培养。
1.2 实验分组
随机分为对照组(C组)和机械拉伸组(S组),每组又分为4个亚组,3 h组(3C组、3S组)、6 h组(6C组、6S组)、16 h组(16C组、16S组)和24 h组(24C组、24S组)。
1.3 RLE-6TN机械拉伸损伤模型的构建
将接种有RLE-6TN的BioFlex 6孔培养板与Flexercell-4000TTM细胞柔性基底加载装置(Flexercell International公司,美国)相连接,实施对细胞的均匀周期性机械拉伸,本实验选择的加载参数为拉伸幅度:20%,频率:0.3 Hz,波形:正弦波。对照组细胞同样接种于BioFlex 6孔培养板上并与机械拉伸组细胞置于相同培养条件下,但不与拉伸装置相连。
1.4 流式细胞术检测细胞凋亡
各组弃上清培养液,用不含有EDTA的胰蛋白酶消化10-15 min,PBS洗涤2次,收集细胞,每样本细胞数约为106个,1 000 r/min离心5 min,加入400 μl Binding Buffer悬浮细胞,在细胞悬液中加入5 μl Annexin Ⅴ-FITC,10 μl PI轻轻混匀后室温、避光条件下孵育20 min,在1 h内用流式细胞仪(山西医科大学实验室提供)检测细胞凋亡率。
1.5 肿瘤坏死因子α(TNF-α)表达测定
收集细胞上清液,按照大鼠肿瘤坏死因子α(TNF-α)ELISA试剂盒(上海西唐生物科技有限公司)说明书对TNF-α进行检测,以标准品浓度为横坐标,OD值为纵坐标,利用EXCEL软件绘制标准曲线,通过待测样本的OD值在标准曲线上查出其浓度。
1.6 RLE-6TN的形态学电镜观察
每组取6孔细胞悬液,1 000 r/min离心5 min,将沉淀物用2.5%的戊二醛固定,PBS漂洗,丙酮脱水,1%四氧化锇后固定,环氧树脂包埋,枸橼酸铝染色(山西医科大学电镜室提供),电镜下观察分析标本。
1.7 统计学分析
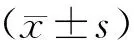
2 结果
2.1 RLE-6TN拉伸不同时间凋亡率的变化
流式细胞术检测细胞凋亡结果显示,3S组凋亡率为(5.89±0.07)%,6S组为(9.87±0.05)%,16S组为(12.16±0.19)%,24S组为(20.54±0.66)%。与各自的对照组3C组(2.52±0.01)%、6C组(2.67±0.12)%、16C组(2.73±0.19)%、24C组(3.38±0.82)%相比,凋亡率均增加,差异均有统计学意义(均P<0.05),且随着拉伸时间的延长而凋亡率增加(见图1)。
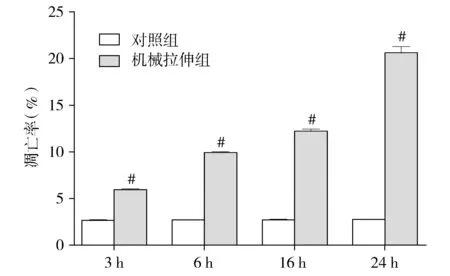
与各自对照组相比,#P<0.05
2.2 拉伸不同时间对RLE-6TN中TNF-α表达水平的影响
RLE-6TN暴露于20%机械拉伸刺激后,6S组、16S组、24S组与各自的对照组相比,TNF-α表达水平均明显升高(均P<0.05),且呈现时间递增趋势;3S组与3C组相比,差异无统计学意义(P>0.05,见表1)。

表1 不同组间TNF-α表达水平的比较Table 1 Comparison of TNF-α expression between different
2.3 RLE-6TN机械拉伸后形态学变化
电镜下可见对照组RLE-6TN细胞形态较规则,结构完整清晰,呈立方形或圆形,细胞游离面有很多长短不一的微绒毛、排列整齐,胞核明显,核呈圆形或椭圆形,胞质内含有许多线粒体、粗面内质网等细胞器且结构正常;机械拉伸组细胞形态学改变显著,细胞肿胀,表面微绒毛减少,线粒体肿胀、体积增大、甚至呈现空泡化,线粒体嵴减少、部分嵴排列紊乱、融合或消失,可见粗面内质网扩张呈池状,部分粗面内质网出现脱颗粒现象,以上改变以24S组最为明显(见图2)。
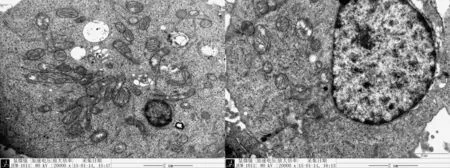
A.对照组 B.24S组
3 讨论
本研究以大鼠肺泡Ⅱ型上皮细胞(RLE-6TN)为研究对象,利用Flexercell-4000TTM柔性基底加载系统建立离体细胞周期性机械拉伸模型,模拟在体机械通气时肺泡上皮细胞的受力情况,选用加载拉伸幅度为20%,相当于大潮气量机械通气。本研究实验结果显示,细胞凋亡率、TNF-α表达水平随着拉伸时间的延长而上调,呈时间依赖性,形态学观察到细胞损伤,出现细胞肿胀、线粒体肿胀、粗面内质网扩张等表现,提示体外肺泡上皮细胞机械拉伸损伤模型制备成功,以24S组形态学改变最明显,细胞凋亡率和炎性反应表达水平也最显著,同时未引起细胞大量死亡而影响后续实验。因此,本实验表明,给予肺泡上皮细胞20%拉伸幅度24 h、0.3 Hz拉伸频率的正弦波用于模拟大潮气量机械通气体外拉伸模型中较为合适。
离体损伤模型相比在体动物模型,更有利于对细胞内事件的深入研究,对实验条件有着更为精准的控制,可以避免在体实验或者离体的整体肺脏研究时遇到的诸多干扰因素,如体液因素、肺血流剪切力以及内分泌和神经递质等体内其他因素的影响[9,10]。多年来,经过不断的摸索和改进,人们提出了多种离体培养细胞的力学实验方法,根据不同的载荷加载方式大体可以分为微吸管吸吮技术、压力载荷法、基底拉伸法和流体剪切法等[11-13]。力学因素对细胞水平的影响主要表现在两个方面,一是引起细胞增殖、迁移、分化等适应性反应;二是引起细胞因子和炎症介质的释放、细胞凋亡等损伤性反应[14]。
FlexercellTM柔性基底加载系统是通过一个真空泵抽吸特制的细胞柔性培养膜,形成的负压对培养膜产生一个拉伸应变,从而使黏附于培养膜上的细胞受到张力的作用,细胞所受力的大小正比于培养膜的拉伸幅度,即应变率,整个加载过程由计算机软件自动控制。本实验应用的Flexercell-4000TTM柔性基底加载系统在前一代产品的改进升级上,可以使生长在培养膜上的细胞受到周期性双向、径向的拉伸作用[15],受力更加均匀可控,更为真实地模拟临床上机械通气时肺泡上皮细胞的受力情况[16,17]。
机械通气所致肺损伤是一种肺部弥漫性肺泡-血管膜损伤和通透性增加综合征,包括气压伤、容量伤、萎陷伤和生物伤四类[18]。目前关于机械通气所致肺损伤致病机制的相关研究表明:一方面,机械通气使肺泡和周围毛细血管内皮细胞受到过度牵拉,直接导致屏障结构受损,即机械性损伤;另一方面,过度机械拉伸肺泡上皮细胞可以激活相关信号转导通路,引起细胞因子和炎性介质的大量释放,导致细胞骨架重排、细胞氧化应激、凋亡和肺泡水增加等一系列炎性损伤过程[19,20]。肺泡上皮细胞是机械通气所致肺损伤过程中主要的效应细胞,Ⅱ型肺泡细胞(AT Ⅱ)数量较AT Ⅰ多,是肺泡上皮细胞的“干细胞”,其功能多样,能增殖、分化为AT Ⅰ、AT Ⅱ,这种特点与损伤修复有关,近些年发现,AT Ⅱ具有强大的液体转运能力,对肺泡内液体的产生和清除具有重要意义[21]。同时AT Ⅱ还具有复杂的免疫功能,它一方面能直接合成多种免疫调节物质,另一方面可以调节肺泡巨噬细胞的各种功能,这些构成了肺损伤时引起炎症的重要因素[22]。
综上,本实验成功地构建了大鼠肺上皮细胞体外周期性机械拉伸损伤模型,模拟了在体机械通气时肺泡上皮细胞的受力情况,从细胞力学层面研究机械拉伸诱发肺损伤过程提供了研究基础。然而,机械通气所致肺损伤的机制目前尚未完全明确,有部分研究提示抵抗素样分子家族在该过程中可能起到关键作用,其具体的机制还有待于进一步的研究。
