鱼类海豚链球菌病研究进展
2018-11-28罗晓雯朱永肖孔祥会
罗晓雯,李 莉,朱永肖,裴 超,孔祥会
( 河南师范大学 水产学院,河南 新乡 453007 )
海豚链球菌(Streptococcusiniae)最初由Pier等[1]自美国旧金山捕获的亚马逊淡水海豚——亚河豚(Iniageoffrensis)皮下“高尔夫球”样化脓灶中分离出来,因此被命名为海豚链球菌。1978年,Pier等[2]自美国纽约尼亚加拉大瀑布水族馆皮肤受损的亚河豚上第二次分离到海豚链球菌,之后在美国俄亥俄州的患病亚河豚中也可分离出该菌[3]。关于海豚链球菌感染鱼类的报道始于20世纪80年代,Kitao等[4]自患病的尼罗罗非鱼(Oreochromisnilotica)、虹鳟(Oncorhynchusmykiss)和香鱼(Plecoglossusaltivelis)中分离出海豚链球菌,之后在澳大利亚、美国、中国等世界各地均相继出现有关海豚链球菌感染鱼类的报道。海豚链球菌感染鱼类引起疾病爆发,导致鱼类大批量死亡,严重威胁到水产养殖业的健康发展。笔者就当前国内外有关海豚链球菌的研究概况进行综述,以期为鱼类海豚链球菌的检测和疾病防控提供参考。
1 海豚链球菌的病原学
海豚链球菌属于芽孢杆菌纲、乳杆菌目、链球菌科、链球菌属,具有感染宿主广、传染性强、死亡率高等特点。1994年版的《伯杰氏鉴定细菌学手册》将其归入化脓性链球菌[5],将ATCC29178作为模式菌株。
海豚链球菌是一种兼性厌氧的革兰氏阳性菌(图1a),为球形或卵圆形,直径约为0.2~0.8 μm,有荚膜,无鞭毛,无运动性,不形成芽孢,通常在液体培养基中呈长链排列,在固体培养基中呈短链或成对排列。在绵羊血平板上30 ℃培养48 h,菌落呈现白色小圆点(直径≤1 mm)[6],不能水解过氧化氢酶和氧化酶。Barnes等[7]利用精氨酸水解和核糖产酸初步将海豚链球菌分为两个血清型,Ⅰ型菌株精氨酸双解酶和核酸酶均为阳性,Ⅱ型菌株均为阴性。Bachrach等[8]使用RAPD方法将海豚链球菌分为两个核酸型,若海豚链球菌的基因组可扩増出750 bp的条带,则为Ⅰ型,反之为Ⅱ型。
海豚链球菌有α和β两种溶血类型,其溶血型与血平板中所加的血液和基础培养基有关。Eldar等[9-11]研究发现,海豚链球菌在含5%的牛血或人血的平板上呈现α溶血或部分α溶血(一条窄的β溶血环被一条更宽的α溶血环围绕),而在添加5%羊血的平板上呈完全β溶血(图1b)。Nguyen等[12]研究显示,海豚链球菌在含3%的马血心浸液血平板(HIA)上呈β溶血,而在含3%的马血Todd-Hewitt平板(THA)上呈α溶血。其溶血环的大小与血平板中所加的血液有关,海豚链球菌在含有羊血的平板上产生的溶血环相比人血和牛血平板产生的溶血环更宽[10]。
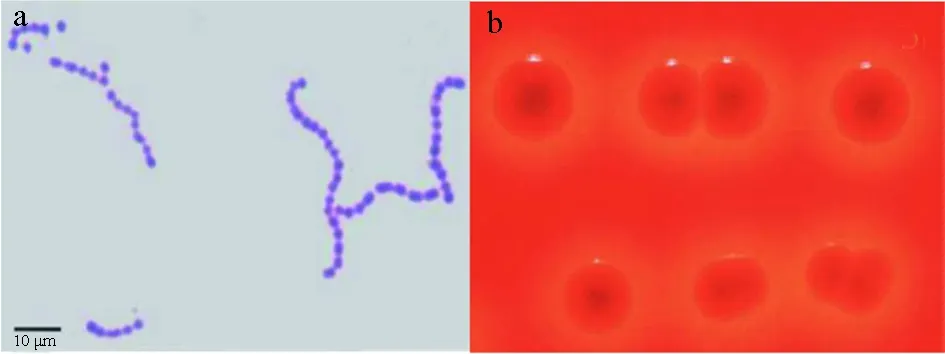
图1 海豚链球菌的革兰氏染色形态(a)[13]及在5%羊血平板上的溶血活性(b)[14]
2 鱼类海豚链球菌病的流行病学
目前国内外有关报道显示,海豚链球菌可以感染30余种鱼类,导致其发病(表1)。鱼类海豚链球菌病一般发生在6—10月,尖吻鲈(Latescalcarifer)感染海豚链球菌后,在25~28 ℃时死亡率最高[15]。但是一些鱼类在低温时也易感染海豚链球菌,沈智华等[16]发现,浙江省网箱养殖眼斑拟石首鱼(Sciaenopsocellatus)在7—12月均有被海豚链球菌感染的现象发生;罗璋等[17]报道显示,天津市某养殖场的银鼓鱼(Selenotocamultifasciata)3月发生海豚链球菌病,发病率超过50%;张俊等[18]报道,罗非鱼、花鲈(Lateolabraxjaponicus)、尖吻鲈全年均有可能感染海豚链球菌,但不同鱼类对海豚链球菌的易感程度不同,罗非鱼较其他鱼类更易感且感染程度强,而花鲈也远比石斑鱼(Epinephelis)、卵形鲳鲹(Trachinotusovatus)和眼斑拟石首鱼等易感染海豚链球菌。体表损伤、水环境条件恶劣等常是导致鱼类感染发病的重要因素[18]。

表1 海豚链球菌感染鱼类的报道
3 鱼类海豚链球菌病的临床症状
鱼类被海豚链球菌感染的临床症状分为急性和亚急性型,感染率与鱼的种类及规格、菌株的毒力、养殖环境条件相关[18]。急性感染的鱼类常出现爆发性死亡,但无典型症状[28]。亚急性感染的病鱼常出现体色发黑、食欲减退、嗜睡、脊椎畸形、单侧或双侧眼球突出、角膜混浊(图2a),鳃盖下缘、胸鳍基部、体表的其他部位有出血现象(图2b),鳍条边缘褪色、肛门红肿,死前出现间断性狂游、翻滚或转圈等症状[38]。有些病鱼脑部充血(图2c)[39],腹腔有血色腹水,肝、脾、肾等脏器充血肿胀、变色(图2d),严重者肝脏和肾脏糜烂[17]。也有表现为胆囊肿大、胆汁暗绿,肠道内无食物,后肠肠壁充血等症状[6,35],或在心外膜上出现大量“米粒样大小”泡样囊状物[40]等症状。
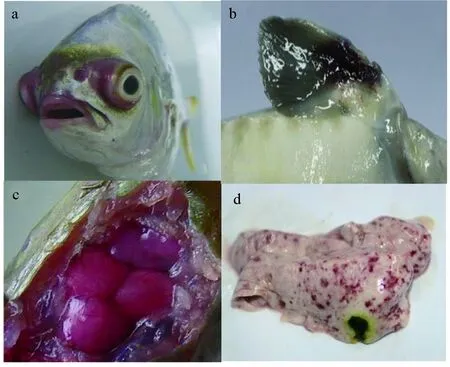
图2 卵形鲳鲹(a,c)和西伯利亚鲟(b,d)被海豚链球菌感染的症状[40]a.眼突或角膜混浊;b.胸鳍基部点状出血;c.脑出血肿胀;d.肝脏发白,弥散性点状出血.
4 海豚链球菌的致病机理
Zlotkin等[41]认为,海豚链球菌感染鱼类发病是一个多步骤的过程。首先,水环境中的海豚链球菌经鱼体受伤部位直接感染或经消化道途径侵入鱼体,进入血液循环,利用吞噬细胞的保护躲避宿主免疫系统,穿透血—脑屏障,进入中枢神经系统。Russo等[42]通过试验鱼体腔注射海豚链球菌发现,注射后2 d内,鱼体血液、脾、肾、脑中的细菌持续增加,之后血液、脾、肾中的链球菌数量减少或维持在一定密度,而脑中细菌数量继续上升,直至病鱼死亡。Aamri 等[43]认为,在链球菌逃避吞噬细胞的吞噬作用中,荚膜起到了非常关键的作用,海豚链球菌的荚膜可有效地阻止宿主免疫分子与病原菌的结合与激活。
Weinstein等[44]的研究显示,致病性和非致病性海豚链球菌的脉冲场凝胶电泳分子分型识别系统图谱存在一定的差异,推测有一种或多种特异基因编码的毒力因子决定着海豚链球菌的致病性。Fuller等[45]比较了海豚链球菌致病菌株与非致病菌株间致病力的差异,发现两者均具有良好的黏附和侵袭功能,但具备直接的细胞毒性和抵抗吞噬细胞的清除能力是决定其致病性的关键因素。海豚链球菌主要的致病因子有M蛋白、链球菌溶血素S、荚膜多糖、葡萄糖磷酸变位酶、α-烯醇化酶、C5a肽酶等毒力因子。
4.1 M蛋白
M蛋白由simA和simB基因编码,是一类由复合基因调节蛋白调控的表面蛋白,是海豚链球菌主要的毒力因子之一[46]。Baiano等[47]首次克隆了海豚链球菌(K288)的simA(QMA0076),M蛋白能够结合人类纤维蛋白原,还能与鳟鱼免疫球蛋白的FC结合位点结合,刺激机体产生特异性抗体,有利于细菌黏附上皮细胞和逃避吞噬细胞。
4.2 链球菌溶血素S
链球菌的细胞溶素包括A群链球菌的溶血素S、溶血素O,B群链球菌的 β-溶血素/细胞溶素。这些溶血素均与致病菌的毒力有着密切的关系[48]。Locke等[46]研究表明,海豚链球菌溶血素S能损伤红细胞、上皮细胞、巨噬细胞,还可能促进脑血管创伤,这是其发挥毒性的主要作用方式。
4.3 荚膜多糖
Fuller 等[45]研究发现,海豚链球菌致病株能产生荚膜多糖,而非致病菌株不产生,提示海豚链球菌的致病性可能与荚膜多糖有关。Miller等[49]研究也显示,具有荚膜多糖的海豚链球菌菌株毒性要比无荚膜多糖的菌株毒性强,荚膜多糖能够抑制和调理吞噬细胞的吞噬作用,阻止宿主补体因子C3b的沉积,产生荚膜多糖是海豚链球菌逃避被吞噬细胞吞噬最有效的方式之一,而且荚膜多糖也能增强溶血素S的形成。
Barnes等[7]发现,血清Ⅱ型的海豚链球菌由于荚膜表面抗原覆盖率更高,具有更强的抗吞噬活性。Locke等[50]利用等位基因交换突变技术构建了荚膜△cpsD突变株,发现突变株的荚膜比野生株荚膜明显要薄,同时抵抗吞噬细胞的吞噬作用也变弱,进一步证明荚膜多糖与菌体抵抗吞噬细胞的吞噬作用有关。
4.4 葡萄糖磷酸变位酶
葡萄糖磷酸变位酶与荚膜合成有关,它由pgmA基因编码,包含571个氨基酸,在维持正常细胞壁形态、荚膜表达和对抗宿主先天性免疫中发挥作用。Buchanan等[51]用△pgm的突变株(pgmA缺失株)和野生株对杂交条纹鲈进行攻毒试验,结果显示,野生株以4×105cfu/mL剂量接种死亡率达100%,而突变株4×108cfu/mL的接种剂量死亡率仅2.5%。观察发现,突变株的细胞荚膜厚度变薄,脆性降低,能被杂交条纹鲈全血细胞迅速清除掉,证实了pgmA基因是决定海豚链球菌致病性的毒力基因。
4.5 C5a肽酶和α-烯醇化酶
C5a肽酶是由scpⅠ基因编码的123 ku的蛋白质,通过水解补体C5a,阻止多核细胞靠近菌体,延缓免疫系统对链球菌的杀灭,从而损伤宿主的抗侵袭能力,是A群和B群链球菌的重要毒力因子[52]。而海豚链球菌可通过α-烯醇化酶激活纤溶酶原降解纤维层,逾越各种组织障碍侵袭动物体,致宿主发病[53]。
5 海豚链球菌的检测方法
张新艳等[54]报道显示,广东、福建、海南等省爆发的罗非鱼无乳链球菌(S.agalactiae)病的主要症状和流行状况与之前国内已报道的罗非鱼海豚链球菌病相似,但无乳链球菌被认为是唯一拥有B群特异性抗原的链球菌[55],而海豚链球菌不具有Lancefield B群链球菌特异性抗原。另外在生理生化特征(表2)和分子生物学方面,两种细菌也有一定的差异。因此,可以结合多种方法来对海豚链球菌进行检测,目前其检测方法主要包括传统的细菌学方法、免疫学检测和分子生物学检测方法。
5.1 传统的细菌学检测方法
传统的细菌学检测方法包含选择培养基筛选和生理生化指标的测定。
5.1.1 使用选择培养基筛选
选择培养基是根据海豚链球菌对不同抗菌物质的耐受性,选择合适的抗菌物质来抑制其他菌的生长,进而从养殖水体或病鱼中检出海豚链球菌。Nguyen等[12]设计了醋酸铊—噁喹酸和硫酸黏杆菌素—噁喹酸两种选择性培养基,将其应用于褐牙鲆海豚链球菌的分离。而后Nguyen 等[56]将培养基配方进行了改良,以Todd-Hewitt肉汤代替脑心浸液作为基础培养基,硫酸黏杆菌素—噁喹酸培养基中加入醋酸铊0.5 g/L,并将其用于日本褐牙鲆养殖场的海豚链球菌的调查,发现醋酸铊—硫酸黏杆菌—噁喹酸培养基比硫酸黏杆菌素—噁喹酸培养基对杂菌的抑制效果更好。
5.1.2 根据生理生化特征鉴定
海豚链球菌在10 ℃生长,45 ℃不生长;接触酶阴性;可水解七叶灵和精氨酸,V-P试验和马脲酸试验阴性;海豚链球菌发酵葡萄糖、水杨苷,不发酵阿拉伯糖、菊糖、乳糖、棉子糖和山梨醇等(表2)。微生物鉴定系统能够自动测定多种生化反应,依据其自带的数据库进行鉴定后输出结果。目前商品化的适合链球菌鉴定的微生物鉴定系统主要有Biolog Microlog System、API 20 Strep Rapid ID 32 Strep、BioMerieux Vitek、the ATB Expression System和the Microscan WalkAway System等[32]。

表2 海豚链球菌和无乳链球菌的生理生化特征
注:+表示为阳性;-表示为阴性;α表示α溶血;β表示β溶血.
5.2 分子生物学检测方法
虽然无乳链球菌与海豚链球菌的16S rRNA基因的同源性较高(95.6%~96.8%)[59],但也存在一定的差异。Zlotkin等[25]设计的一对16S引物可特异性扩增海豚链球菌,产生约300 bp的清晰特异性条带,而无乳链球菌无扩增条带。Berridge等[60]根据链球菌16S~23S rDNA间隔区序列设计引物对链球菌进行了PCR鉴定。也有学者应用伴侣蛋白60(cpn60) 基因[61]以及乳酸盐氧化酶基因LctO[62]设计特异性引物建立了海豚链球菌检测方法。Park等[63]针对gyrB、23S rRNA、16S rRNA基因设计引物,使用多重PCR方法检测了使褐牙鲆染病的迟缓爱德华菌(Edwardsiellatarda)、副乳链球菌(S.parauberis)和海豚链球菌。王瑞娜等[64]建立了一种可应用于海豚链球菌快速检测的环介导等温扩增联合横向流动试纸条的技术,能准确高效的检测出海豚链球菌。Cai等[39]利用Si、cfb、tuf基因序列设计特异性引物进行多重PCR,结合16S rRNA的BLAST结果,鉴定出广西患病卵形鲳鲹的致病菌为海豚链球菌、无乳链球菌和停乳链球菌(S.dysgalactiae)。
5.3 免疫学检测方法
沈智华等[16]采用间接酶联免疫技术检测海豚链球菌。Klesius 等[65]基于高度特异性单克隆的间接荧光抗体技术建立了快速检测罗非鱼海豚链球菌技术。张友平[66]采用海豚链球菌 SO3 为抗原,制备了兔抗高效免疫血清,基于生物素与亲和素的高亲和力及酶标反应的放大效应,建立了海豚链球菌双夹心BA-ELISA 的检测方法。该方法对海豚链球菌的特异性强,最低检测限度为4×104~16×104cfu/mL,该法与PCR法的一致性达91.3%。
6 海豚链球菌病的防治
鱼类链球菌病的发生是由环境因素、鱼体抵抗力和病原菌共同作用的结果,对于链球菌病的防治,主要使用改善水体养殖环境、免疫预防和药物治疗等方法。
6.1 疾病预防
Aruety 等[67]研究设计了零排放循环水产养殖系统的污泥消化器,降低污泥中病原菌的含量。Iwashita等[68]通过在饲料中添加枯草芽孢杆菌(Bacillussubtilis)、酿酒酵母(Saccharomycescerevisiae)和米曲霉(Aspergillusoryzae)等微生态制剂增强罗非鱼鱼苗的免疫力,提高了罗非鱼对海豚链球菌和嗜水气单胞菌(Aeromonashydrophila)的抵抗力,Shiau等[69]则通过在低鱼粉和高豆粕的饲料中补充核苷酸,提高了罗非鱼对海豚链球菌的免疫力。
接种疫苗是预防链球菌病的有效方法。目前关于海豚链球菌疫苗的研究主要有灭活疫苗、减毒疫苗、亚单位疫苗和DNA疫苗。Eldar等[70]利用福尔马林灭活疫苗免疫虹鳟,使得由海豚链球菌引起的虹鳟的死亡率由50%降至5%。Klesius等[71]用异源海豚链球菌菌株(海水菌株与淡水菌株),按一定比例混合制备成多价疫苗免疫罗非鱼, 并利用制备疫苗的菌株进行攻毒, 相对保护率分别达到63.1% (淡水菌株攻毒)和 87.3%(海水菌株攻毒)。张生等[72]利用自患病罗非鱼分离到的海豚链球菌菌株制备的灭活疫苗,通过腹腔注射免疫尼罗罗非鱼,使用8倍半数致死量的剂量攻毒获得100%的相对保护率。Locke等[52]将编码毒力因子M蛋白的simA基因敲除,构建了一株simA突变菌株,使该菌株的毒力大大减弱,对条纹鲈和斑马鱼(Daniorerio)均显示出较好的保护效应。孙黎等[73]对褐牙鲆源海豚链球菌保护性抗原Sip11重组蛋白构建了亚单位疫苗,免疫褐牙鲆的保护率达100%。也有一些研究人员研究出针对海豚链球菌的烯醇化酶亚单位疫苗,该疫苗免疫斑马鱼后对海豚链球菌的免疫保护率为100%[74]。Sun 等[75]构建了一个针对海豚链球菌的 DNA 疫苗pSia10,用该 DNA 疫苗免疫大菱鲆(Scophthalmusmaximus)后,不仅鱼体内的特异性抗体水平显著增高,而且非特异性的免疫因子IgM、C3、Mx、NKEF、TLR3和 TNF-α 在mRNA水平表达上调。
6.2 药物治疗
鱼类海豚链球菌病的治疗,目前主要使用抗菌药物和中草药。药敏试验结果显示,海豚链球菌对恩诺沙星、头孢噻肟、头孢拉定、头孢唑啉、卡那霉素等药物较为敏感,可用于海豚链球菌的治疗[35-36]。吴颖瑞等[76]研究了153种中草药对罗非鱼无乳链球菌和海豚链球菌的抑制活性,发现博落回、紫草、田基黄、补骨脂、三颗针、田七须和五倍子对无乳链球菌和海豚链球菌均具有较好的抑菌效果。杨剑等[77]的研究发现,三黄连合剂(黄芩、黄连、黄药子等)可以减轻因海豚链球菌感染造成的免疫抑制,从而保护机体的免疫系统,提升免疫力。
7 展 望
海豚链球菌是一种世界性分布的鱼类致病菌,感染宿主广、传染性强、死亡率高,危害严重。防止鱼类海豚链球菌病的发生,首先要探明海豚链球菌的传播途径和致病机制,目前海豚链球菌的致病机理还仅限于对部分毒力因子的研究,有关致病机制还有待深入研究。海豚链球菌病的治疗,目前主要使用抗菌药物,而抗菌药物的长期使用和滥用,使得海豚链球菌对很多药物产生耐药性。中草药是否能替代抗生素用于链球菌病的治疗,尚需体内试验和综合评价。链球菌疫苗的研究较多,但多数仍处于试验阶段,临床效果有待于进一步检验,研发安全高效的海豚链球菌疫苗,是防控鱼类链球菌病的最有效手段。
